眼脑肾综合征(oculocerebrorenal syndrome of Lowe)是一种罕见的 X 连锁隐性遗传病,临床上 以先天性白内障、肾脏损害、智力低下、肌张力 减低等为特点[1]。眼脑肾综合征也称 Lowe 综合征,发病率约 1/50 万,一般为男性发病,患者多在婴 幼儿或儿童时期即出现症状。多数病人预后差,可死于感染、肾功能衰竭、电解质紊乱、脱水 等[2]。OCRL 基因是目前唯一确定的眼脑肾综合征 致病基因,位于 Xq25-q26 区域内,编码磷脂酰肌 醇 4,5-磷酸氢盐 5-磷酸酶[3]。本研究对一个眼脑 肾综合征家系进行调查,并在临床诊断的基础上 应用 DNA 直接测序法进行 OCRL 基因突变筛查,现报告如下。 1 资料与方法 1.1 研究对象
收集 1 个 3 代共 7 人的眼脑肾综合征家系(图 1 )资料。先证者,男,2 岁 1 个月。患儿系足月 顺产,第 1 胎第 1 产。生后 3 个月家长发现患儿 双瞳孔区发白,不追光。生后 6 个月确诊为双眼 先天性白内障,即行双眼白内障超声乳化摘除术。 1 岁 8 个月时因肺炎住院,尿常规检查发现尿蛋白 (2+),其后多次复查尿常规示蛋白(2+~3+)。 体查:体重 10.5 kg,身高 80 cm。精神可,不能独 走。方颅,前囟闭合,前额隆起。眼窝深陷,双 眼内斜视,眼球水平震颤,可追光追物。马鞍鼻。 肋缘外翻。心肺腹无异常。脊柱无畸形。四肢肌 张力低下,膝腱反射减弱。右侧隐睾。实验室检查: 贝利婴幼儿智力发育量表测评智力发育指数及精 神运动发育指数均 <50 分。头颅 CT 扫描未见异常。 双肾 B 超提示双肾实质光点增多。24 h 尿蛋白定 量 1.45 g。尿蛋白(3+),尿 pH 6.5,尿比重 1.012,尿糖阴性,尿 β2 微球蛋白增高(2 500 μg/L)。 血 pH 降低(7.30),血钙降低(1.98 mmol/L),血磷降低(1.5 mmol/L),血氯正常(108.7 mmol/L),血钠降低(132.1 mmol/L),血钾降低(3.2 mmol/L),二氧化碳结合力降低(12.1 mmol/L),骨碱性磷 酸酶升高(270 U/L),碱性磷酸酶升高(612.7 U/L),乳酸脱氢酶升高(448.1 U/L)。血常规检查示 Hb 93 g/L,MCV 69.9 fL,MCH 19.7 pg,MCHC 284 g/L。
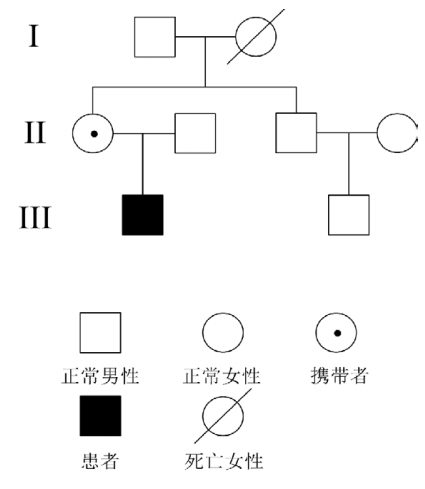 |
图 1家系图谱 |
细胞免疫 CD3+63.07(参考值 61.1~77.0),CD3+CD4+16.91( 参 考 值 25.8~41.6),CD3+CD8+32.97( 参 考 值 18.1~29.6),CD4+/CD8+0.51( 参 考值 0.8~2.1)。肾功能正常。
患儿母亲体健,无明显眼部症状,行眼裂隙 灯显微镜检查可见晶状体点线状浑浊(图 2)。尿 常规、血气分析、血电解质检查均无异常。其余 家庭成员体健,尿常规检查均正常。
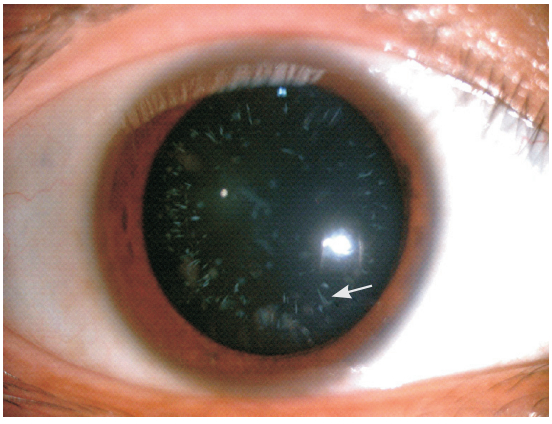 |
图 2患者母亲眼裂隙灯显微镜检查晶状体可见点线状浑浊(箭头所示)。 |
抽取家系成员每人 外周血 6 mL(EDTA 抗凝),采用 Gentra 公司提 供的全血基因组纯化试剂盒提取 DNA,l×TB 溶 解,-80℃保存。 1.2.2 引物设计
根据参考文献[4] 合成 OCRL 基因引物共 21 对。扩增产物包括全部外显子序列 和部分内含子序列。 1.2.3 目的基因的扩增
以提取的基因组 DNA 为模板,在9700PCR 仪上扩增目的基因。反应 条件如下:50 μL 反应体系中含 DNA 模板 1.5 μL (浓度 90 ng/μL),上下游引物各1.5 μL(浓度 10 mmol/L),dNTP 4 μL( 浓 度 各 2.5 mmol/L),TaqDNA 聚 合 酶 0.5 μL( 浓 度 5 U/μL),镁离子 2.0 mmol/L。95℃预变性 5 min 后,94℃变性 30 s,60~66℃退火 30 s,72℃延伸 55 s,循环 30~35 次,最后 72℃延伸 10 min。PCR 产物经 2% 琼脂糖凝 胶电泳检测。 1.2.4 基因突变检测
PCR 产物用 Promega 公司 提供的 Wizard TM PCR 产物纯化试剂盒纯化。以 PCR 反应的引物为测序引物,用 PE 公司提供的 Bigdye 末端标记测序反应试剂盒,用 4 色荧光标 记 4 种脱氧核昔酸,按 Sanger 双脱氧终止法进行 测序反应。PCR 反应条件:96℃变性 10 s,56℃ 退火 5 s,60℃延伸 5 min,共 30 个循环。反应产 物用 70% 乙醇沉淀,95℃变性 5 min 后,在美国 PE 公司的 ABI377 测序仪上进行测序,上机电泳。 采用 PolyPhred 软件对测序结果进行分析,根据测 序结果识别突变位点。 2 结果
该家系先证者为男性,表现为以先天性白内 障、肾小管性酸中毒、大量蛋白尿、精神运动发 育迟滞为主要特点的多样临床表现。家系其他成 员未见类似临床表现。患儿母亲眼裂隙灯显微镜 检查见晶状体点线状浑浊,无其他明显异常。家 系表现符合眼脑肾综合征的临床特点。
基因检测在患者 OCRL 基因 15 号外显子发现 第 1736 号碱基发生了 A/G 突变,导致编码蛋白第 507 号氨基酸由组氨酸(H)变为精氨酸(R),即发生了 OCRL 基因 H507R 错义突变,家系中患 者母亲为突变基因杂合携带者(图 3)。家系其他 成员未检出该基因异常。
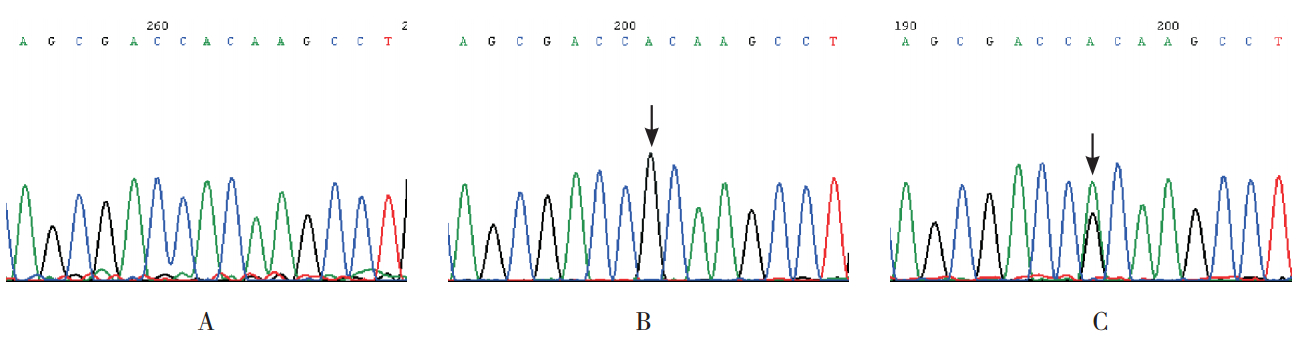 |
图 3 OCRL 基因 15 号外显子测序图A:正常人 15 号外显子测序;B:患者,第 1736 号碱基发生了 A/G 突变(箭头所示);C:患儿母亲,第 1736 号碱基为 A、G 双峰(箭头所示)。 |
眼脑肾综合征首先由Low 等人于1952 年报道,临床表现主要有眼部症状、神经系统症状和肾小 管功能障碍等。眼部症状包括双眼先天性白内障、 可伴有先天性青光眼、视力障碍,常有畏光、粗 大的眼球震颤、小眼球和眼球内陷等。神经系统 症状主要是智力发育迟缓,还有肌张力低下,腱 反射减弱或消失、癫癎等。肾小管功能障碍主要 是肾小管性酸中毒,尿检可见蛋白尿、尿红细胞、 白细胞,还存在电解质、酸碱平衡紊乱。其他表 现主要有隐睾、脐疝、马鞍鼻等畸形[5]。
本家系患者有较为典型的眼脑肾综合征临床 表现,包括双眼先天性白内障、双眼斜视、眼球 震颤、明显的精神运动发育迟滞、四肢肌张力低下、 腱反射减弱、肾小管性酸中毒、大量蛋白尿及隐睾、 佝偻病。家系调查显示家系其他成员无类似临床 表现。因该病是 X 连锁隐性遗传病,故推测患者 母亲为突变基因携带者。有报道对该病携带者行 眼裂隙灯显微镜检查,可发现晶状体浑浊以协助 早期诊断[4]。本家系患儿母亲行眼裂隙灯显微镜检 查,可见晶状体点线状浑浊。故本研究家系临床 表现较为典型,患者可临床诊断为眼脑肾综合征。
OCRL 基因是唯一已知的眼脑肾综合征致病基 因,其编码的蛋白呈两种异构体,分别长 901 和 893 个氨基酸。OCRL 通过水解磷脂酰肌醇 4,5-磷 酸氢盐,参与调解肌动蛋白聚合过程,进而影响 细胞迁移、细胞间接触,在眼晶状体、脑组织、 肾小管等发育中起重要作用[6]。目前报道的致眼脑 肾综合征 OCRL 基因突变达 200 余种,主要有无 义突变、移码突变、缺失突变、错义突变[7]。突变 主要影响编码蛋白的折叠、表达数量、与受体结 合等,从而影响其正常功能。已经报道的错义突 变占所有已知突变的 30%,而其中的 70% 位于 15 号外显子,该外显子编码区域是氨基酸高度保守 区域[8]。
为进一步明确家系致病基因突变点,本研究 进行了 OCRL 基因筛查,发现的错义突变位于基 因的 15 号外显子,系第 1736 号碱基发生了 A/G 突变,导致编码蛋白第 507 号氨基酸由组氨酸(H) 变为精氨酸(R),即发生了 OCRL 基因 H507R 错义突变,家系中先证者的母亲为突变基因杂合 携带者。OCRL 基因位于 X 染色体 q25-q26 区域内,男性先证者表现症状,其母亲携带突变基因但不 表现症状,符合 X 连锁隐性遗传的特点。国外已 有眼脑肾综合征家系第 1736 号碱基发生 H507R、 H507L(亮氨酸)、H507Q(谷氨酰胺)突变的报 道[9],国内尚未见相同位点发现突变的报道。
眼脑肾综合征的女性患者十分罕见,其遗传 基础是 X 常染色体异位且断裂点累及 OCRL 基因,或是 OCRL 基因突变发生于活性 X 染色体[10]。眼 脑肾综合征也可由新生的基因突变引起,无家族 史的先证者可能是家族唯一的受累者。
眼脑肾综合征比较罕见,临床医生应加强对 本病的认识,根据患者临床表现作出早期初步诊 断,以免漏诊误诊,有条件时应进一步进行基因 检测。因为眼脑肾综合征尚无有效治疗方法,对 于有患者的家族,母亲再次妊娠应进行产前基因 检测以提供优生优育指导。
| [1] | Addis M, Meloni C, Congiu R, et al. A novel interstitial deletion in Xq25, identified by array-CGH in a patient with Lowe syndrome[J]. Eur J Med Genet, 2007, 50(1): 79-84. |
| [2] | Ruellas AC, Pithon MM, Oliveira DD, et al. Lowe syndrome: literature review and case report[J]. J Orthod, 2008, 35(3): 156-160. |
| [3] | Hou X, Hagemann N, Schoebel S, et al. A structural basis for Lowe syndrome caused by mutations in the Rab-binding domain of OCRL1[J]. EMBO J, 2011, 30(8): 1659-1670. |
| [4] | Roschinger W, Muntau AC, Rudolph G, et al. Carrier assessment in families with lowe oculocerebrorenal syndrome: novel mutations in the OCRL1 gene and correlation of direct DNA diagnosis with ocular examination[J]. Mol Genet Metab, 2000, 69(3): 213-222. |
| [5] | Tasic V, Lozanovski VJ, Korneti P, et al. Clinical and laboratory features of Macedonian children with OCRL mutations[J]. Pediatr Nephrol, 2011, 26(4): 557-562. |
| [6] | Pirruccello M, De Camilli P. Inositol 5-phosphatases: insights from the Lowe syndrome protein OCRL[J]. Trends Biochem Sci, 2012, 37(4):134-143. |
| [7] | Luo N, West CC, Murga-Zamalloa CA, et al. OCRL localizes to the primary cilium: a new role for cilia in Lowe syndrome[J]. Hum Mol Genet, 2012, 21(15): 3333-3344. |
| [8] | Maia ML, do Val ML, Genzani CP, et al. Lowe syndrome: report of five cases[J]. J Bras Nefrol, 2010, 32(2): 216-222. |
| [9] | Satre V, Monnier N, Berthoin F, et al. Characterization of a germline mosaicism in families with Lowe syndrome, and identification of seven novel mutations in the OCRL1 gene[J]. Am J Hum Genet, 1999, 65(1): 68-76. |
| [10] | Cau M, Addis M, Congiu R, et al. A locus for familial skewed X chromosome inactivation maps to chromosome Xq25 in a family with a female manifesting Lowe syndrome[J]. J Hum Genet, 2006, 51(11): 1030-1036. |
 2014, Vol. 16
2014, Vol. 16


