免疫性血小板减少症(immune thrombocyto- penia,ITP)是一种由血小板抗体介导的加速血 小板的破坏及抑制其生成的获得性自身免疫出血 性疾病。目前对于其发病机制尚不完全清楚。既 往研究发现 ITP 患者的细胞及体液免疫存在失衡 现象,是导致 ITP 患儿血小板减少的另一主要原 因 [1, 2],但目前关于导致细胞及体液免疫失衡的机 制尚未完全明确。
白细胞相关免疫球蛋白样受体 -1(leukocyte- associated Ig-like receptor,LAIR-1)是一类含有 Ig 样胞外结构域的跨膜糖蛋白,属于免疫球蛋白超 家族成员,它可在多种免疫细胞膜上表达,也可 从细胞膜表面脱落至血清中成为可溶性 LAIR-1 (sLAIR-1)[3]。LAIR-1 是一类抑制性受体,可 通过其所在细胞质的免疫受体酪氨酸抑制基序 (immunoreceptor tyrosine-based inhibition motif, ITIM)发挥其免疫抑制功能,从而使其所表达的免 疫细胞的功能失衡 [4]。已有研究报道显示 LAIR-1 的表达异常与系统性红斑狼疮、类风湿关节炎等 免疫性疾病的发病机制相关 [5, 6, 7]。但在儿童 ITP 急 性期 LAIR-1 的表达是否存在异常现象,目前尚未 见相关报道。为此本研究对 ITP 患儿外周血 T 细 胞及B细胞膜LAIR-1、sLAIR-1的水平进行了检测, 以探讨 LAIR-1 在 ITP 发病中可能的机制。
1 资料与方法 1.1 研究对象参照 2009 年国际 ITP 工作组制定的儿童 ITP 诊断标准 [8],选取 ITP 患儿 40 例,其中男 24 例, 女 16 例,平均年龄 32±29 个月(1~108 个月), 均为我院住院治疗患儿;入院时平均血小板计数 19×109/L(1×109/L~40×109/L);所有 ITP 患儿 均为急性期,受试前 4 周均未使用免疫抑制剂及 细胞毒性药物。同年龄健康对照组患儿 32 例,男 17 例,女 15 例,平均年龄 35±26 个月(3~120 个月),平均血小板计数 210×109/L。两组受试者 年龄及性别差异无统计学意义。本研究获受试者 家属知情同意,并通过医院医学伦理委员会批准。
1.2 材料FITC 标记 CD8+ T 细胞、CD19+ B 细胞、PE 标 记 LAIR-1、PerCP-cy5 标记 CD4+ T 细胞、APC-cy7 标记 CD20+ B 细胞抗体等均购自 BD Pharmingen 公 司;总RNA的提取及纯化试剂盒购自QiaGen公司; SYBRGeen 试剂盒购自德国 QIAGen;酶联免疫吸 附试验(ELISA)试剂盒购自武汉 EIAab 公司。
引物与酶:实时荧光定量 PCR 检测的引物根 据 GenBank 设计,由上海英骏(Invitrogen)公司 合成。LAIR-1 正向序列:5'-GGGGTCTCAGTGGTC-TTCCT-3';3'-CCCCAGAGTCACCAGAAGGA-5'。 LAIR-1 反向序列:5'-TCCATTGACTGTGGCCTTG- T-3';3'-AGGTAACTGACTCCGGAACT-5'。
1.3 标本采集在 ITP 患儿用药前采集外周静脉血 EDTA 抗 凝管1.5~2 mL,干燥管3 mL。为避免其他刺激干扰, 所有标本采集后均在 2 h 内处理。240 μL 全血用 作流式细胞仪分析;1 mL 提取总 RNA,-80℃保 存,批量纯化、cDNA 合成及 mRNA 检测;干燥管 3 mL 静脉血离心 20 min(1 000 r/min),分离上层 血清,分装至 EP 管中,-80℃保存,采用 ELISA 集中检测 sLAIR-1。
1.4 流式细胞仪检测全血法配制流式上机液,采用流式细胞仪检 测 CD4+ T 细 胞、CD8+ T 细 胞、CD19+ B 细 胞、 CD20+ B细胞比例及其细胞膜上的LAIR-1的表达, 并设PE标记IgG1作同型对照,阴性表达控制在1% 左右,全部数据经 FlowJo 软件分析。
1.5 cDNA 合成总 RNA 的提取及纯化:取外周血 1 mL,按 试剂盒说明步骤提取及纯化 RNA。抽取总 RNA 10 μL,按照逆转录试剂盒方法操作,进行逆转录 合成 cDNA,取 1 μL cDNA 进行 PCR 扩增 50~70 个循环。
1.6 实时荧光定量 PCR采用SYBRGeen试剂盒,罗氏(LightCycler480) PCR 仪荧光定量检测总 LAIR-1 mRNA 表达水平, 应用 Relative Quantification 模式进行数据分析,结 果以目的基因 /β-actin GAPDH 比值表示。具体操 作步骤参照试剂说明书。
1.7 ELISA双抗夹心 ELISA 法检测 ITP 患儿血清 sLAIR-1 水平。具体操作步骤见试剂盒说明书。
1.8 统计学分析所有数据分析采用 SPSS 17.0 统计软件包进 行,正态分布资料以均数 ± 标准差(x±s)表示, 非正态分布资料以中位数(四分位间距)[M(P25, P75)] 表示。经正态性和方差齐性检验后,采用 t 检验或非参数检验比较各组之间的差异,P<0.05 为差异有统计学意义。
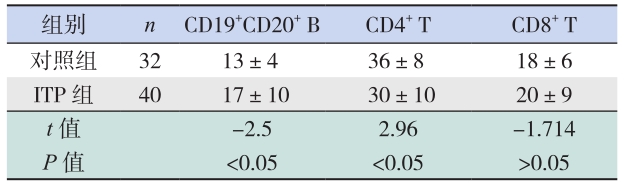
2 结果 2.1 两组免疫细胞亚群比例的比较ITP 组外周血 CD19+CD20+ B 细胞的比例较对 照组明显升高,差异有统计学意义(P<0.05); CD4+ T 细胞比例较对照组降低,差异有统计学意 义(P<0.05);CD8+ T 细胞较对照组稍升高,但 两者差异无统计学意义(P>0.05)。见表 1。
| 表 1 两组免疫细胞亚群比例的比较 (x±s,% ) |
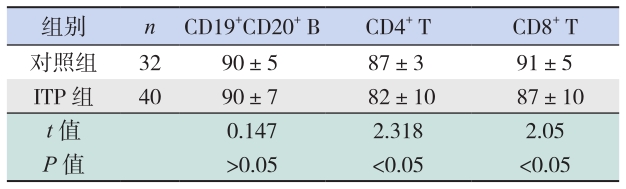
ITP 组外周血 CD4+ T 细胞膜 LAIR-1 的表达 低 于 对 照 组(P<0.05);CD8+ T 细 胞 膜 LAIR-1 表达低于对照组(P<0.05);CD19+CD20+ B 细胞 膜 LAIR-1 的表达与对照组比较差异无统计学意义 (P>0.05)。见表 2、图 1、图 2。
| 表 2 两组细胞膜 LAIR-1 表达的比较 (x±s,% ) |
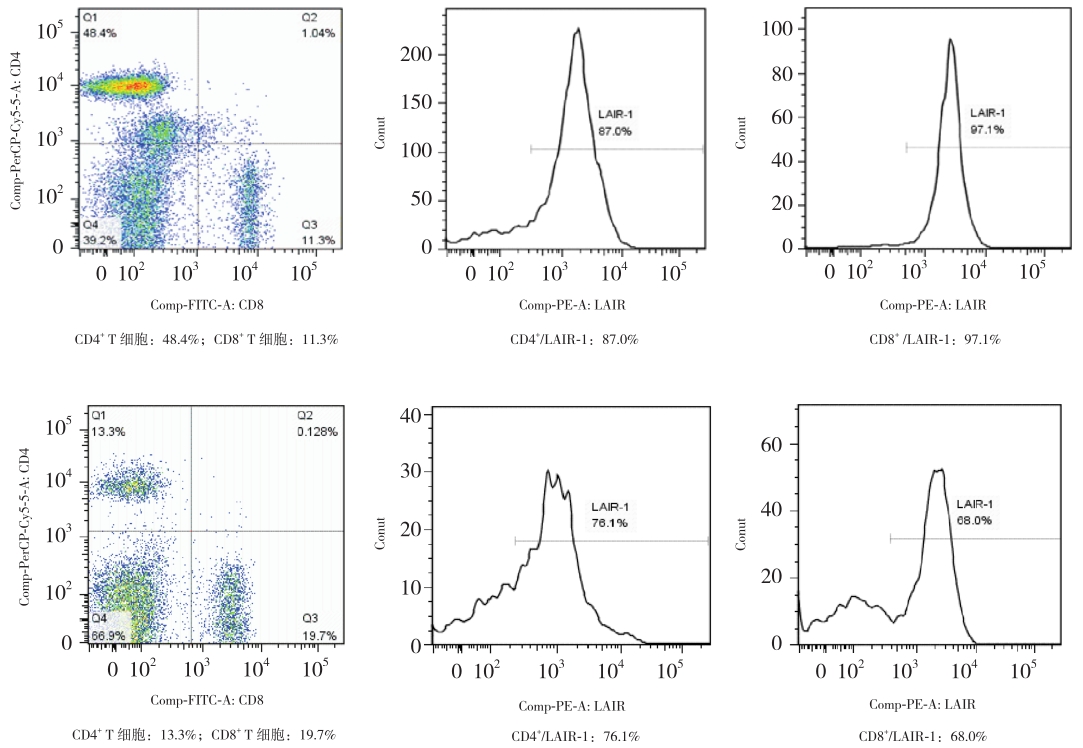 |
图 1 CD4+、CD8+ T 细胞表达率及 LAIR-1 在 CD4+、CD8+ T 细胞膜的表达率流式细胞仪示意图 上排 为对照组,下排为ITP组。ITP组CD4+ T 细胞表达率较对照组降低,差异有统计学意义,而CD8+ T细胞 表达率较对照组稍增高, 但两者差异无统计学意义;LAIR-1 在 CD4+、CD8+ T 细胞膜上的表达率较对照组降低,差异有统计学意义。 |
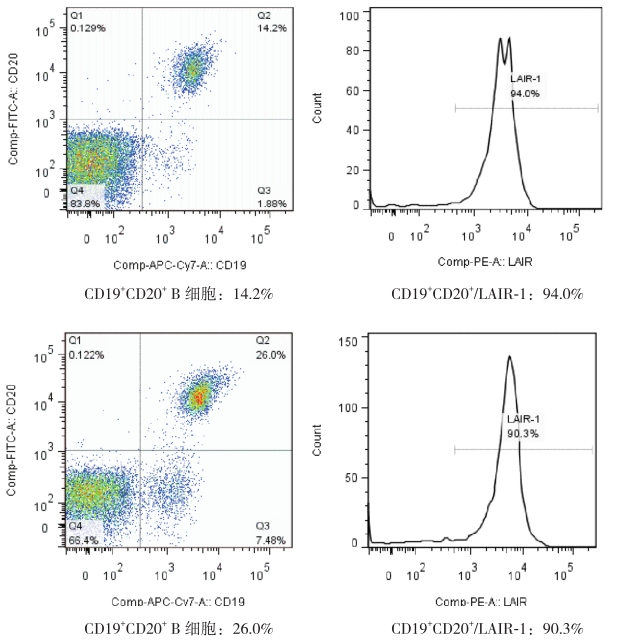 |
图 2 CD19+CD20+ B 细 胞 的 表 达 率 及 LAIR-1 在 CD19+CD20+ B 细胞膜的表达率流式细胞仪示意图 上 排为对照组,下排为 ITP 组。ITP 组 CD19+CD20+ B 细胞 表达率较对照组升高,差异有统计学意义,但 LAIR-1 在 CD19+CD20+ B 细胞膜上的表达率与对照组比较差异无统计 学意义。 |
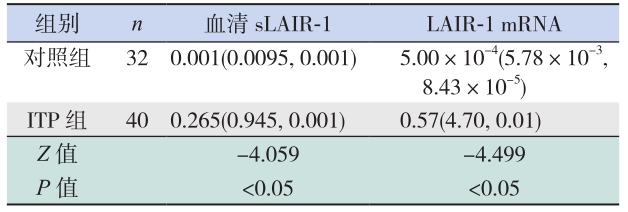
ITP 组血清 sLAIR-1 水平较对照组明显升高 (P<0.05),总 LAIR-1 mRNA 水平高于对照组 (P<0.05)(表 3)。
| 表 3 两组血清 sLAIR-1 水平及 LAIR-1 mRNA 表达的比较 [M(P25,P75)] |
儿童 ITP 的发病机制尚不十分清楚,普遍认 为血小板的减少是由自身反应性 B 细胞和浆细胞 产生的抗血小板抗体介导所致 [9],这些抗体通过单 核巨噬细胞系统的巨噬细胞的 Fcγ 受体诱导血小 板吞噬 [10]。近年研究发现 ITP 患儿 CD4+ T 细胞及 分泌的细胞因子也可影响 B 细胞产生抗血小板抗 体 [11],另外 CD8+ T 细胞也可发挥其细胞毒作用 [12], 对血小板进一步破坏。因此,ITP 的发病机制与机 体免疫功能失衡密切相关。
人 LAIR-1 是一种跨膜蛋白质,可抑制 B 细胞 的活化及增殖,同时减少相关抗体和细胞因子的 产生 [13];也可抑制 T 细胞相关的 TCR 介导的信号, 最终可抑制 T 细胞活化、辅助体液免疫及细胞毒 性等功能 [4, 14, 15]。
对系统性红斑狼疮患者的研究发现 B 细胞膜 上 LAIR-1 的表达缺失,该研究认为因 LAIR-1 在 系统性红斑狼疮患者的 B 细胞上的缺失表达, LAIR-1 不能发挥其抑制作用,导致 B 细胞异常活 化,致使患者产生较多的异常抗体 [7]。同时,类风湿关节炎的患者关节液中血清可溶性 LAIR-1 的 表达水平均高于正常人,血清 sLAIR-1 可与膜型 LAIR-1 竞争结合配体,从而导致患者的免疫细胞 过度活化后发生免疫失衡 [5, 6]。
本研究结果显示,ITP 患儿中外周血 CD4+ T 细胞比例较正常对照组显著降低, CD8+ T 细胞较 对照组稍升高,CD19+CD20+ B 细胞的比例显著升 高,这与既往研究结果相似,说明 ITP 患儿体内 存在细胞及体液免疫失衡现象 [11, 12]。重要的是本 研究发现,ITP 患儿外周血 CD4+ T 细胞膜 LAIR-1 的表达降低,导致其对自身的细胞抑制功能减弱, 这可能使 CD4+ T 细胞参与的细胞免疫及辅助体液 免疫应答的功能增强,产生较多的抗血小板自身 抗体,介导单核巨噬细胞对血小板的吞噬;同时 CD8+ T 细胞膜 LAIR-1 降低,LAIR-1 对 CD8+ T 细 胞发挥的抑制性作用减弱,使其细胞毒性功能增 强,对血小板破坏增多。另外,研究结果中注意 到,LAIR-1 在 CD19+CD20+ B 细胞膜上的表达与 对照组比较差异无统计学意义,这提示膜 LAIR-1 并不影响体液免疫的抗体产生;但 ITP 患儿的 CD19+CD20+ B 细胞比例较对照组增高,前期研究 结果提示 ITP 患儿存在 Th2 细胞的过度活化 [16], 推测由于 CD4+ T 细胞膜 LAIR-1 表达降低,加之 sLAIR-1 的增加,两者导致其对 T 细胞的抑制功能 减弱、Th2 细胞过度活化,后者促进体液免疫的 功能增强,从而使 B 细胞活化增殖。因此,推测 LAIR-1 主要是依靠对 T 细胞功能及其辅助体液免 疫应答的作用进行调节,从而导致 ITP 患儿机体 的免疫失衡。
另外,本研究发现 ITP 患儿血清中的 sLAIR-1 表达增加,这可能是由于位于细胞膜上的 LAIR-1 脱 落 至 血 清 所 致。 血 清 中 的 sLAIR-1 可 与 膜 LAIR-1 互相竞争配体,从而进一步使 ITP 患儿体 液及细胞免疫功能失衡。对 LAIR-1 mRAN 检测发 现,ITP 组患儿 LAIR-1 mRAN 表达高于对照组, 推测与以下因素有关:(1)由于细胞膜 LAIR-1 表达降低,而使 LAIR-1 mRNA 表达代偿性(反馈) 增加;(2)尽管 ITP 患儿的 LAIR-1 mRNA 转录 水平增高,但可能存在翻译过程的障碍。以上结 果进一步提示 ITP 患儿 LAIR-1 表达的变化在其发 病机制中起着重要的作用。
本研究发现 ITP 患儿 LAIR-1 在 CD4+ T 细胞、CD8+T 细胞膜 LAIR-1 的表达降低致使对免疫细胞 的抑制功能减弱,血清中 sLAIR-1 的表达升高进 一步削弱了膜 LAIR-1 的抑制功能,提示 LAIR-1 可能是导致 ITP 患儿的免疫失衡的重要因素。有 待进一步研究 ITP 患儿经激素及丙种球蛋白治疗 后是否可调控细胞膜及血清中LAIR-1的表达变化, 或通过影响 T 细胞及 B 细胞的功能、体内细胞因 子水平[17],从而间接调控细胞膜上 LAIR-1 的表达。 概括起来,本研究证实了细胞膜上 LAIR-1 与小儿 ITP 体液及细胞免疫功能紊乱的机制相关,血清中 LAIR-1 可能参与细胞膜上 LAIR-1 发挥抑制功能的 调控。深入探讨 LAIR 在 ITP 发病机制中的作用, 可进一步了解导致 ITP 免疫功能紊乱的机制。
| [1] | McMillan R. The role of antiplatelet autoantibody assays in the diagnosis of immune thrombocytopenic purpura[J]. Curr Hematol Rep, 2005, 4(2): 160-165. |
| [2] | McKenzie CG, Guo L, Freedman J, et al. Cellular immune dysfunction in immune thrombocytopenia (ITP)[J]. Br J Haematol, 2013, 163(1): 10-23. |
| [3] | Walk J, Westerlaken GH, van Uden NO, et al. Inhibitory receptor expression on neonatal immune cells[J]. Clin Exp Immunol, 2012, 169(2): 164-171. |
| [4] | Jansen CA, Cruijsen CW, de Ruiter T, et al. Regulated expression of the inhibitory receptor LAIR-1 on human peripheral T cells during T cell activation and differentiation[J]. J Immunol, 2007, 37(4): 914-924. |
| [5] | Olde Nordkamp MJ, van Roon JA, Douwes M, et al. Enhanced secretion of leukocyte-associated immunoglobulin-like receptor 2 (LAIR-2) and soluble LAIR-1 in rheumatoid arthritis[J]. Arthritis Rheum, 2011, 63(12): 3749-3757. |
| [6] | Zhang Y, Ding Y, Huang Y, et al. Expression of leukocyte-associated immunoglobulin-like receptor-1 (LAIR-1) on osteoclasts and its potential role in rheumatoid arthritis[J]. Clinics (Sao Paulo), 2013, 68(4): 475-481. |
| [7] | Colombo BM, Canevali P, Magnani O, et al. Defective expression and function of the leukocyte associated Ig-like receptor 1 in B lymphocytes from systemic lupus erythematosus patients[J]. PLoS ONE, 2012, 7(2): e31903. |
| [8] | Rodeghiero F, Stasi R, Gernsheimer T, et al. Standardization of terminology, definitions and outcome criteria in immune thrombocytopenic purpura of adults and children: report from an international working group[J]. Blood, 2009, 113(11): 2386-2393. |
| [9] | 刘晓帆, 薛峰, 张磊, 等. 血小板膜糖蛋白特异性抗体在原发免疫性血小板减少症患者中的分布及与疗效的关系[J]. 中华血液学杂志, 2013, 34(7): 610-613. |
| [10] | 周燕, 钟周琳, 申卫东. ITP患者血小板特异性自身抗体的检测及意义[J]. 广西医学, 2010, 32(6): 708-709. |
| [11] | 胡莹贤, 邱虹, 徐海洋, 等. 35例特发性血小板减少性紫癜患者治疗前后T淋巴细胞亚群检测分析[J]. 宁夏医科大学学报, 2011, 3(36): 576-577. |
| [12] | Zhang J, Ma D, Zhu X, et al. Elevated profile of Th17, Th1 and Tc1 cells in patients with immune thrombocytopenic purpura[J]. Haematologica, 2009, 94(9): 1326-1329. |
| [13] | Meyaard L. LAIR and collagens in immune regulation[J]. Immunol Lett, 2010, 128(1): 26-28. |
| [14] | Maasho K, Masilamani M, Valas R, et al. The inhibitory leukocyte associated Ig like receptor-1 (LAIR-1) is expressed at high levels by human naive T cells and inhibits TCR mediated activation[J]. Mol Immunol, 2005, 42(12): 1521-1530. |
| [15] | Tang X, Tian L, Esteso G, et al. Leukocyte-associated Ig-like receptor-1-deficient mice have an altered immune cell phenotype[J]. J Immunol, 2012, 188(2): 548-558. |
| [16] | 王国兵, 李成荣, 李长钢, 等. 儿童急性ITP Th1/Th2细胞功能状态初步研究[J]. 中国小儿血液与肿瘤杂志, 2008(4): 156-160. |
| [17] | Del Vecchio GC, Giordano P, Tesse R, et al. Clinical significance of serum cytokine levels and thrombopoietic markers in childhood idiopathic thrombocytopenic purpura[J]. Blood Transfus, 2012, 10(2): 194-199. |
 2014, Vol. 16
2014, Vol. 16