新 生 儿 坏 死 性 小 肠 结 肠 炎(necrotizing enterocolitis of newborn,NEC) 为 新 生 儿 尤 其 是 早产儿严重的胃肠道疾病,在极低出生体重儿 (very low birth weight infant,VLBW)中发病率可达 5%~10% [1]。近年来,随着新生儿重症监护技术的 进步,早产儿存活率显著提高,但 NEC 的发病率 明显增加,在美国 NEC 病死率高达 10%~50%[2], NEC 短期内可引起一些严重并发症如肠穿孔、肠 狭窄、腹膜炎、脓毒败血症和肠瘘等[3]。此外, NEC 还是早产和 VLBW 新生儿远期神经发育障碍 的高危风险因素[4]。目前,尚无特异性手段防治 NEC,为此,本研究收集我院近 2 年早产儿重症监 护室(NICU)中 NEC 患儿的围产期资料,对胎龄 小于 33 周早产 NEC 患儿的发病时间及围产高危因 素等进行分析,以期为临床医生对 NEC 高危儿的 防治提供线索。 1 资料与方法 1.1 研究对象及分组
收集 2010 年 10 月至 2012 年 12 月在我院早 产 NICU 收住的 49 例胎龄 <33 周、Bell 分期Ⅱ期 以上的 NEC 患儿的临床资料。同时期入院的非 NEC 患儿共 2 597 例,从这些患儿中随机抽取 121 例生后 24 h 转入我院住院治疗,且治愈出院的患 儿作为非 NEC 组,排除严重的先天畸形,胎龄 25~33 周。 1.2 NEC 的诊断标准
采用修正 BELL-NEC 分级标准进行诊断及分 期[5]。 1.3 观察指标
收集两组患儿临床资料,共有 10 个因素列入 统计:性别、胎龄、出生体重、小于胎龄儿(SGA)、 分娩方式、新生儿窒息、发病日龄(根据修正 BELL-NEC 分级标准明确诊断的最早时间)、产前 是否应用激素、NICU 住院日、转归。 1.4 统计学分析
应用 SPSS 13. 0 统计软件,计量资料用均值 ± 标准差(x±s)表示,组间比较采用t检验或方差 分析;计数资料以率(%)表示,组间比较采用卡 方检验;对发生 NEC 的高危因素进行 logistic 回归 分析。P<0.05 为差异有统计学意义。 2 结果 2.1 两组患儿 NICU 平均住院日比较
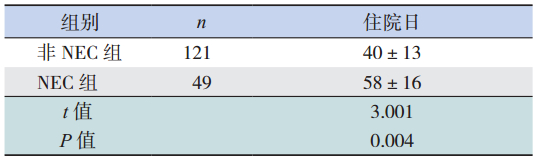
非 NEC 的 患 儿 平 均 NICU 住 院 日 为 40 d, NEC 患 儿 平 均 NICU 住 院 日 为 58 d,NEC 患 儿 NICU 平均住院日明显长于非 NEC 组(P<0.01), 见表 1。
| 表 1 两组患儿 NICU 平均住院日的比较(x±s,d) |
49 例 NEC 患儿发病日龄最早在生后 3 d 发病, 最晚为生后 106 d,中位数为 17.5 d。胎龄小于 30 周的 NEC 发病日龄的中位数为 19 d,30~32 +6周早 产儿 NEC 平均发病日龄的中位数为 17 d,胎龄大 的相对发病时间较早,胎龄小的发病时间相对滞 后,但两组比较差异无统计学意义。 2.3 两组围产期情况比较
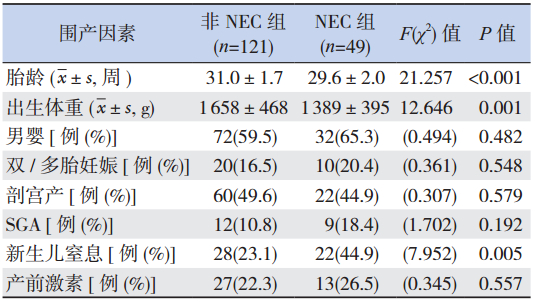
NEC 组胎龄、出生体重均显著低于非 NEC 组 (P<0.01),合并新生儿窒息的比例显著高于非 NEC 组(P<0.01),而两组间患儿性别、出生方式、 SGA 比例、双 / 多胎妊娠比例及产前糖皮质激素应 用比例等差异无统计学意义(P>0.05),见表 2。
| 表 2两组围产期情况比较 |
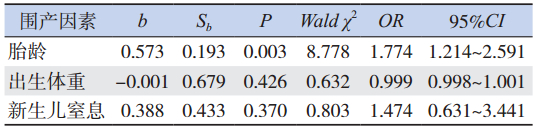
对胎龄、出生体重及新生儿窒息 3 个因素进 行 logistic 回归分析,显示胎龄小是 NEC 发病的独 立高危因素,见表 3。
| 表 3 NEC 患儿发病高危因素的多元 logistic 回归分析 |
由于 NEC 对患儿短期和远期均可带来较大的 影响,NEC 患儿平均住院日显著延长,不良预后 率高[6]。本研究发现,NEC 患儿 NICU 平均住院日 较非 NEC 患儿显著延长。NEC 给患儿增加疾病痛 苦,也增加了家庭和社会的经济负担。因此,总 结 NEC 的发病高危因素,可为预防 NEC 提供线索, 具有重要的实践指导意义。
NEC 的病因和机制尚不完全明确。本研究发 现,在胎龄小于 33 周的 49 例 NEC 早产儿中,平 均胎龄 <30 周,显著低于非 NEC 组;且合并新生 儿窒息的患儿比例显著高于非 NEC 组。围产因素 中,小胎龄为 NEC 的独立发病高危因素。胎龄 30 周以前的早产儿肠道发育极不成熟,肠黏膜屏障 结构及功能发育不完善,加之胃肠道消化液分泌 不足,肠道蠕动功能差,是构成 NEC 发病的基础。 有关 NEC 的病因学研究认为,NEC 是一个多种因 素参与引发肠道多种病变的一个过程,早产、低 出生体重、配方奶喂养、肠缺血、静脉营养和细 菌定植等是 NEC 重要的危险因素,不成熟的肠道 暴露于这些危险因素后,将启动并活化促炎性因 子反应,导致机体抗炎和促炎信号途径的失衡, 引起肠上皮细胞凋亡或坏死,最终损伤肠屏障功 能,有时甚至引起多器官功能障碍综合症导致死 亡[7, 8]。
本研究发现出生时窒息可增加 NEC 的发病风 险,早产儿如合并窒息,可导致肠道缺氧缺血, 增加 NEC 发病风险。任何影响肠道血流的因素都 可能增加 NEC 的发生,如出生时阿氏评分低、红 细胞增多症、动脉导管未闭、输血、应用大剂量 丙种球蛋白、脐静脉置管等[9, 10]。围生期缺氧可导 致机体防御反射,机体血流重新分布,肠系膜血 管强烈收缩,导致肠道缺血,甚至坏死。由于病 例数量限制,未能对其他危险因数如胎膜早破、 动脉导管未闭、合并严重呼吸系统疾病等进行统 计分析,尚需开展多中心大样本量研究进一步探 讨 NEC 的围生期高危因素。
Neu 等 [11] 研究发现早产儿经典的 NEC 多发生 在生后 13~23 d,发病高峰在矫正胎龄 32 周时。 Yee 等 [12]研究发现,在胎龄相对大的早产儿中, NEC 呈现为早发型(发病日龄小于7 d),在小胎龄、 低出生体重的早产儿中 NEC 可延迟至生后 32 d 发 病(晚发型)。国内尚未见有关 NEC 发病时间规 律的研究。本研究主要关注胎龄小于 33 周早产 儿,结果有不同发现,NEC 平均发病日龄的中位 数为 17.5 d,胎龄小于 30 周发病日龄的中位数为 19 d,大于 30 周患儿的中位数为 17 d,发病日龄 与胎龄并无很好的相关性。这可能与国内外研究 人群不同有关,尚需进一步开展多中心研究证实。
国外临床研究表明,产前应用糖皮质激素对 肺成熟具有促进作用,同时也能降低 NEC 的发生 率[13, 14]。动物实验研究表明,产前应用糖皮质激 素对不成熟的肠道也具有一定保护作用,能减轻 NEC 发病时肠道的病变程度,改善临床表现 [15]。 但本研究未发现产前糖皮质激素对 NEC 发病产生 影响。分析原因:国外研究中所纳入病例为接受 正规产前宫内转运,规范激素治疗率比较高的人 群,使得早产儿得到正规的产前保胎治疗。而本 研究中,多数病例产前激素治疗不规范,导致结 果存在差异。因此,建议对孕周小于 34 周、有早 产高危因素的孕妇,产前应给予一疗程类固醇激 素,这在促肺成熟同时,可降低 NEC 发病。
综上,本研究结果提示,在临床救治胎龄小 于 30 周的极早产儿时,如合并新生儿窒息等发病 高危因素,在启动喂养方案时,应尽可能母乳喂 养,注意添加肠道益生菌制剂,增加奶量应谨慎 进行,如果在生后 20 d 左右出现呼吸暂停伴有腹 胀、胃潴留等腹部表现时,要考虑 NEC 发病高危 人群,需密切关注病情进展,必要时外科会诊, 掌握手术指征。当然,除了胎龄小之外,合并宫 内感染、抗生素及静脉营养应用、是否母乳喂养、 喂养方案是否合理、输血、大剂量丙球等应用等 也对 NEC 发病具有一定的影响,对这些因素的分 析尚需进行大样本量的流行病学研究。
| [1] | Piazza AJ, Stroll BJ. Digestive System Disorders[M]// Kliegman RM, Behrman RE, Jenson HB, et al, eds. Nelson Textbook of Pediatrics. 18th ed. Philadelphia, Pa: Saunders Elsevier, 2007. |
| [2] | Song R, Subbarao GC, Maheshwari A. Haematological abnormalities in neonatal necrotizing enterocolitis[J]. J Matern Fetal Neonatal Med, 2012(Suppl 4): 22-25. |
| [3] | Christensen RD, Gordon PV, Besner GE. Can we cut the incidence of necrotizing enterocolitis in half——today?[J]. Fetal Pediatr Pathol, 2010, 29(4): 185-198. |
| [4] | Miller RJ, Sullivan MC, Hawes K, et al. The effects of perinatal morbidity and environmental factors on health status of preterm children at age 12[J]. J Pediatr Nurs, 2009, 24(2): 101-114. |
| [5] | Bell MJ, Ternberg JL, Feigin RD, et al. Neonatal necrotizing enterocolitis. Therapeutic decisions based upon clinical staging[J]. Ann Surg, 1978, 187(1): 1-7. |
| [6] | Torrazza RM1, Ukhanova M, Wang X, et al. Intestinal microbial ecology and environmental factors affecting necrotizing enterocolitis[J]. PLoS One, 2013, 8(12): e83304. |
| [7] | Thompson AM, Bizzarro MJ. Necrotizing enterocolitis in newborns: pathogenesis, prevention and management[J]. Drugs, 2008, 68(9): 1227-1238. |
| [8] | 李联侨, 吴斌, 高璇璇, 等. 微生态制剂防治新生儿坏死性小肠结肠炎病例对照研究[J]. 中国当代儿科杂志, 2006, 8 (6): 464-466. |
| [9] | 郑继芳. 围产儿窒息并发坏死性小肠结肠炎(NEC)临床探讨[J].中国社区医师, 2002, 18(15): 26-27. |
| [10] | Marin T, Strickland OL. Transfusion-related necrotizing enterocolitis: a conceptual framework[J]. Adv Neonatal Care, 2013, 13(3): 166-174. |
| [11] | Neu J, Walker WA. Necrotizing enterocolitis[J]. N Engl J Med, 2011, 364(3): 255-264. |
| [12] | Yee WH, Soraisham AS, Shah VS, et al. Incidence and timing of presentation of necrotizing enterocolitis in preterm infants[J]. Pediatrics, 2012, 129(2): 298-304. |
| [13] | Roberts D, Dalziel S. Antenatal corticosteroids for accelerating fetal lung maturation for women at risk of preterm birth[J].Cochrane Database Syst Rev. 2006, (3): CD004454. |
| [14] | Romejko-Wolniewicz E, Oleszczuk L, Zareba-Szczudlik J, et al. Dosage regimen of antenatal steroids prior to preterm delivery and effects on maternal and neonatal outcomes[J]. J Matern Fetal Neonatal Med, 2013, 26(3): 237-241. |
| [15] | Bortolin L, Boer M, Christiansen S, et al. Effects of prenatal steroids in the development of necrotizing enterocolitis in Wistar rat neonates[J]. Arch Argent Pediatr, 2011, 109(1): 24-29. |
 2014, Vol. 16
2014, Vol. 16