据相关报道,胎儿心脏畸形的发生率为 4‰ ~10‰,且还在逐年升高,占人类出生缺陷病 例总数的 1/3 左右,先天性心脏病(以下简称先心 病)是我国出生缺陷中最常见的疾病,已成为严 重影响公共卫生、人口健康的重大社会问题[1, 2]。 但先心病病因复杂,受到遗传和环境的双重影响, 任何微小的变化均会导致该病的发生,目前人类 仍无法从根本上解决这一世界性的难题。要明确 该病是如何发生的,首先需要了解正常心脏发育 的整个过程,明确心脏发育在不同的阶段及不同 的部位都受哪些因素的调控,这样才能更好的为 防治先心病提供充实的科学依据和干预措施。大 量研究表明,Mef2c 核心转录因子在心脏发育中参 与了多种心脏发育基因及蛋白的调控,与心脏发 育密切相关[3, 4, 5]。因此,本研究通过探讨心脏发育 相关核心转录因子 Mef2c 在心脏发育的几个关键 时间点表达水平的变化,同时探讨组蛋白乙酰化 酶 P300、PCAF、SRC1 对 Mef2c 的调控作用,为 下一步明确先心病的病因提供新的理论基础。 1 材料与方法 1.1 实验动物及分组
选择健康成熟 SPF 级昆明小鼠(由重庆医科 大学动物中心提供),按雌︰雄 = 2 : 1 比例合笼交 配,次日清晨发现有阴栓的雌鼠,将胎龄(E)计 为 0.5 d,孕鼠分笼饲养,自由饮水进食,并计算 妊娠天数。依据 E 和出生后日龄(P)将所有子代 昆明小鼠随机分为胚胎期 2 组(E14.5 组、E16.5 组) 和新生期 2 组(P0.5 组、P7 组)。 1.2 标本制备
分别取孕期 E14.5 和 E16.5 的孕鼠,二氧化碳 麻醉处死,75% 酒精消毒皮肤并剖腹,找到含有 胚胎的串珠状子宫,轻柔地将胚胎从子宫分离出 来,放入装有预冷 PBS 缓冲液的培养皿中冲洗, 在解剖显微镜下小心剖开胎鼠的胸腔,分离心脏; E14.5 组取 60 只胎鼠,每 20 只胎鼠心脏作为一个 检测标本,E16.5 组取 45 只胎鼠,每 15 只胎鼠心 脏作为一个检测标本。P0.5 组取 30 只新生鼠,每 10 只新生鼠心脏作为一个检测标本,P7 组取 21 只新生鼠,每 7 只新生鼠心脏作为一个检测标本, 解剖显微镜下分离新生鼠心脏。将各组完整心脏 放入预冷 PBS 中清洗后置于 -80℃冰箱保存备用。 1.3 主要试剂及仪器
染色质免疫共沉淀(ChIP)试剂盒(Millipore, 美国),ChIP 级抗 P300、抗 PCAF 和抗 SRC1 单 克隆抗体均购自英国 abcam 公司,ChIP 级抗乙酰 化组蛋白 H3(ac-H3)抗体(Millipore,美国), 总 RNA 提取试剂盒(BioTeke,北京百泰克生物技 术有限公司),SYBRI 荧光定量 PCR 试剂盒和逆 转录试剂盒均购自日本 TaKaRa 公司,超声破碎仪 (diagenode,比利时),荧光定量 PCR 仪(Bio-Rad, CFX96,美国)。 1.4 ChIP 法提取 DNA
将各组小鼠心脏组织用眼科剪剪碎,预冷 PBS 清洗后加入终浓度为 1% 的甲醛交联。用超声 破碎仪切割 DNA 至 200~1 000 bp 之间。加入 ChIP 级 P300、PCAF、SRC1 和 ac-H3 抗体4℃摇床过 夜沉淀 DNA,65℃逆转交联 8~10 h,纯化和回收 DNA。用核酸蛋白测定仪测定 A260 nm/A280 nm 比值,以确定ChIP 产物DNA的纯度和浓度, 于 -20℃保存。 1.5 ChIP-Real-Time-PCR 引物序列和退火温度
选 取 Mef2c 基 因 外 显 子 5' 端 前 1 000 bp 序 列,针对该序列设计特异性引物。引物用 Primer Premier 5.0 软 件 设 计,由 宝 生 物 公 司 合 成。 将Mef2c基因产物进行梯度稀释,运用BioRad CFX96 荧光定量 PCR 仪扩增,做出标准曲 线,得到R2 值和扩增效率。Mef2c 引物序列: F:5'-CACGCATCTCACCGCTTGACG-3',R: 5'-CACCAGTGCCTTTCTGCTTCTCC-3',产物大小: 172 bp。反应条件:95℃ 预变性 3 min;95℃变性 5 s,55℃ 退火 15 s,68℃ 延伸 20 s,45 个循环。 所得数据用 Bio-Rad CFX96 荧光定量 PCR 仪自带 的基于 pfaffl 原理的相对定量数据分析软件分析。 1.6 Real-Time PCR 引物序列和退火温度
针对Mef2c 基因CDS 核心编码区设计特异 性引物,引物用 Primer Premier 5.0 软件设计,由 宝生物公司合成。将 Mef2c 基因产物进行梯度稀 释,运用 Bio-Rad CFX96 荧光定量 PCR 仪扩增, 做出标准曲线,得到 R2 值和扩增效率。Mef2c 引 物 序 列:F:5'-AGCGCAGGGAATGGATACG-3', R:5'-TGCCAGGTGGGATAAGAACG-3',产 物 大 小:157 bp。 反 应 条 件:95 ℃ 预 变 性 30 s; 95 ℃ 变 性 5 s,55 ℃ 退 火 30 s,39 个 循 环。 选 取β-actin 作 为 内 参,β-actin 引 物 序 列:F: 5'-CCTTTATCGGTATGGAGTCTGCG-3',R:5'-CCTGACATGACGTTGTTGGCA-3',产物大小: 104 bp。反应条件:95℃ 预变性 30 s;95℃ 变性 5 s,59℃ 退火 30 s,39 个循环。所得数据用 BioRad CFX96 荧光定量 PCR 仪自带的基于 pfaffl 原理 的相对定量数据分析软件进行分析。 1.7 统计学分析
应用 SPSS 21.0 统计软件对数据进行统计学分 析,计量资料用均数 ± 标准差(x±s)表示,多 组间比较采用单因素方差分析,组间两两比较采 用 LSD-t检验,P<0.05 为差异有统计学意义。 2 结果 2.1 组 蛋 白 乙 酰 化 酶 P300、PCAF、SRC1 在Mef2c 基因启动子区域的动态变化
ChIP-Real-Time-PCR结果显示,心脏发育 相关核心转录因子Mef2c 启动子区域乙酰化酶 P300、PCAF、SRC1 结合水平均具有一定的时序性。 在各时间点组,组蛋白乙酰化酶 P300、PCAF 和 SRC1 在 Mef2c 基因启动子区域的表达量比较差异 均有统计学意义(分别F=31.17、41.25 和 28.29, 均P<0.001);且均在 E14.5 时表达水平最高,与 其他时间点组(E16.5、P0.5、P7)比较,差异均 有统计学意义(均P<0.01)。随着心脏发育成熟, 所有组蛋白乙酰化酶表达量逐渐降低,出生后呈 较低水平的表达。其中 P300 的表达量在 E16.5 时 高 于 P7(P<0.01);PCAF 的 表 达 量 在 E16.5 和 P7 时均高于 P0.5(均P<0.01)。见图 1~3。
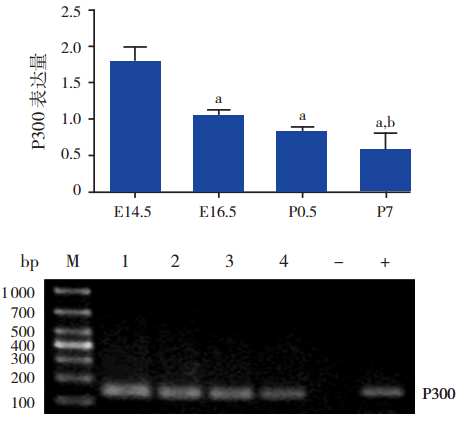 |
图 1 P300 抗体 ChIP 沉淀后 Mef2c 基因启动子区域 P300 表达量 上图为 P300 表达统计图;注:a 为与 E14.5 组 比较,P<0.01;b 为与 E16.5 组比较,P<0.01(n=3)。下图为琼 脂 糖 凝 胶 电 泳 图;M:marker;1:E14.5;2:E16.5;3:P0.5; 4:P7;-:阴性对照(正常鼠 IgG 免疫沉淀后的 DNA 扩增); +:阳性对照(RNA 多聚酶Ⅱ免疫沉淀后的 DNA 扩增)。 |
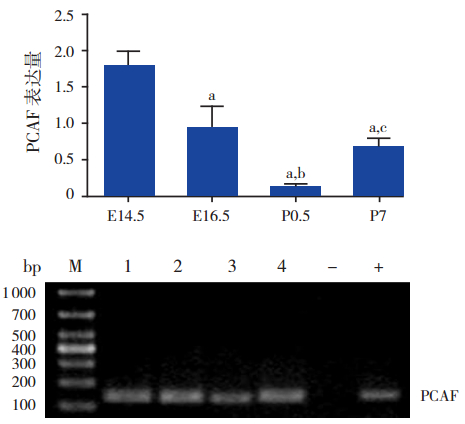 |
图 2 PCAF 抗体 ChIP 沉淀后 Mef2c 基因启动子区域 PCAF 表达量 上图为 PCAF 表达统计图;注:a 为与 E14.5 组比较,P<0.01;b 为 与 E16.5 组 比 较,P<0.01;c 为 与 P0.5 组 比较,P<0.01(n=3)。下图为琼脂糖凝胶电泳图;M:marker; 1:E14.5;2:E16.5;3:P0.5;4:P7;-:阴性对照(正常鼠 IgG 免疫沉淀后的 DNA 扩增);+:阳性对照(RNA 多聚酶Ⅱ免疫沉 淀后的 DNA 扩增)。 |
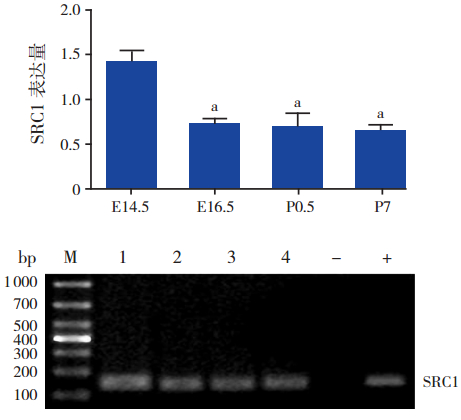 |
图 3 SRC1 抗 体 ChIP 沉 淀 后 Mef2c 基 因 启 动 子 区域 SRC1 表达量 上图为SRC1 表达统计图;注:a 为 与 E14.5 组比较,P<0.01(n=3)。下图为琼脂糖凝胶电泳图; M:marker;1:E14.5;2:E16.5;3:P0.5;4:P7;-:阴性对照 (正常鼠 IgG 免疫沉淀后的 DNA 扩增);+:阳性对照(RNA 多 聚酶Ⅱ免疫沉淀后的 DNA 扩增)。 |
ChIP-Real-Time-PCR 结 果 表 明,Mef2c 基 因 启动子区域组蛋白H3 乙酰化水平存在一定的 时序性。Mef2c 基因启动子区域 ac-H3 水平在各 时间点组比较差异有统计学意义(F=273.26, P<0.001);且在 E14.5 表达水平最高,与其他时 间点组(E16.5、P0.5、P7)相比差异均有统计学 意义(均P<0.001);而 E16.5 时 ac-H3 水平也均 高于 P0.5 和 P7 组(均P<0.01)。提示 ac-H3 随 着心脏的发育成熟表达水平逐渐降低,至出生后 其表达水平明显降低。见图 4。
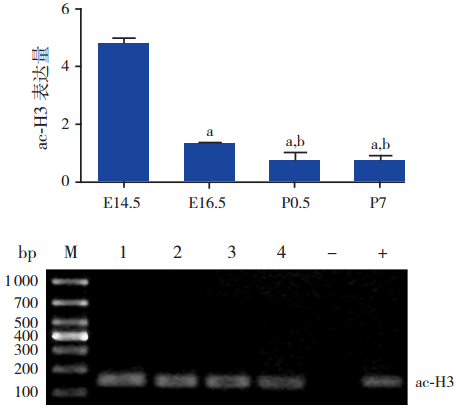 |
图 4 ac-H3 抗体 ChIP 沉淀后 Mef2c 基因启动子区 域 ac-H3 表达水平 上图为 ac-H3 表达统计图;注:a 为与 E14.5 组 比 较,P<0.01;b 为 与 E16.5 组 比 较,P<0.01(n=3)。 下图为琼脂糖凝胶电泳图;M:marker;1:E14.5;2:E16.5; 3:P0.5;4:P7;-:阴性对照(正常鼠 IgG 免疫沉淀后的 DNA 扩增);+:阳性对照(RNA 多聚酶Ⅱ免疫沉淀后的 DNA 扩增)。 |
Real-Time-PCR 结果显示,在小鼠心脏发育的 4 个不同时间点(E14.5、E16.5、P0.5、P7)均能 检测到心脏发育相关基因 Mef2c mRNA 的表达,且 差异有统计学意义(F=32.14,P<0.001)。Mef2c mRNA 表达的高峰期是在 E14.5,与其他时间点组 (E16.5、P0.5、P7)相比,差异均有统计学意义(均 P<0.01);且 E16.5 时 Mef2c mRNA 的表达水平也 高于 P7(P<0.01),其变化趋势与 Mef2c 基因启 动子区域 ac-H3 的变化趋势基本一致,即出生前 呈高表达,随着心脏发育的成熟,出生后其表达 水平明显降低。见图 5。
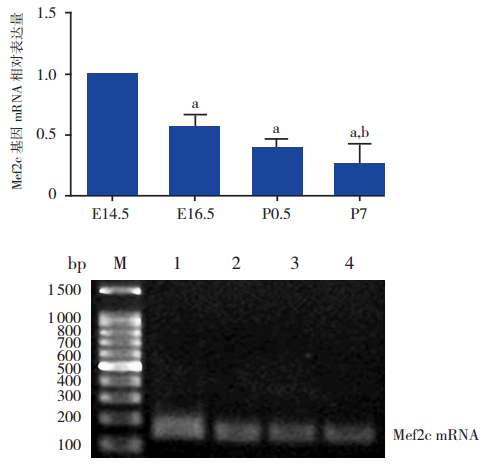 |
图 5 Real-Time-PCR 检测小鼠心脏发育不同时间点 Mef2c mRNA 的表达水平 上图为Mef2c mRNA 表达统计图; 注:a 为与E14.5 组比较,P<0.01;b 为与E16.5 组比较,P<0.01(n=3)。 下图为琼脂糖凝胶电泳图;M:marker;1:E14.5;2:E16.5; 3:P0.5;4:P7。 |
心脏发育是个复杂的过程,环境因素和遗传 因素可能均参与了这个过程。心脏核心转录因子 的顺序激活与正确表达是建造完美心脏的生物学 基础。任何微小的变化都可能引起心脏发育异常, 导致先心病发生[6]。但人类对心脏正常发育的调控 因素知之甚少。因此,进一步明确心脏发育相关 基因的时空表达规律及其调控因素具有十分深远 的意义。心脏的发育除受到遗传背景的影响,还 受到表观遗传的调控,主要包括甲基化修饰、乙 酰化修饰等。文献报道,心脏发育相关基因 Gata4 转录后的共价修饰包括乙酰化、甲基化、SUMO 化 及磷酸化等[7] 。心脏发育相关核心转录因子 Mef2c 的共价修饰是不是也受到乙酰化的修饰及其受到 哪些乙酰化酶的调控目前仍不清楚,以及在心脏 发育过程中其乙酰化调控水平是否具有不同的时 空规律目前仍具有较大争议。
小鼠胚胎心脏发育过程与人类及其相似。因 此,本研究通过选取正常小鼠心脏发育的几个关 键时间点作为研究的时间段,探讨小鼠心脏发育 过程中心脏发育相关基因 Mef2c 启动子区域的乙 酰化水平是否受到 P300、PCAF 和 SRC1 的调控以 及这些乙酰化酶的调控是否具有时序性,同时分 析 Mef2c 启动子区域组蛋白 H3 乙酰化水平变化及 Mef2c mRNA 表达水平的变化,从表观遗传的全新 角度探讨 Mef2c 基因转录后修饰中的乙酰化对心 脏发育的作用,为进一步探讨环境因素导致的心 脏发育异常以及对早期干预治疗先心病提供重要 的理论依据。小鼠胚胎心脏发育的每个阶段都需 要特定信号通路和转录因子的精确调控,目前研 究较多的心脏发育核心转录因子主要有 Nkx2.5、 Gata4、Mef2c、Tbx5 等 [8]。大量研究证实,每个转 录因子在心脏发育的不同时期及不同部位可能均 发挥不同的作用。Mef2c 表达异常可因为心脏的血 管发育缺陷导致小鼠胚胎在 E9.5 死亡[9];Gata4 基 因早期失活导致心肌发育不良和心内膜垫缺损, 晚期 Gata4 基因失活导致心脏功能下降[10],Tbx5、 Nkx2.5 和 Gata4 基因突变都能导致Ⅱ孔型房间隔缺 损,Tbx5 的异常表达还可导致 Holt-Oram 综合征, Nkx2.5 等位基因低表达出现右室双出口畸形,该 基因完全缺失则会出现流出道狭窄[11, 12, 13]。提示各 个转录因子在不同的时期及不同的部位均发挥不 同的功能。
研究表明,心脏发育相关核心转录因子除了 受到其上下游基因的调控外,表观遗传的修饰也 发挥了重要作用[14]。组蛋白乙酰化酶作为翻译后 修饰的关键酶被看作是关键基因表达的激活子[15]。 基因的转录活化状态通常与其启动子区域组蛋白 乙酰化水平息息相关,组蛋白乙酰化酶可以通过 调控相关基因启动子区域组蛋白乙酰化水平来调 控基因的时序表达。本研究发现,心脏发育相关 基因 Mef2c 在小鼠心脏发育的几个关键时间点其 组蛋白乙酰化水平均不一致,在 E14.5 时乙酰化水 平最高,随着小鼠心脏发育成熟,以后逐渐降低, 至出生时呈现低表达,出生前后 Mef2c 基因启动 子区域组蛋白 H3 的乙酰化水平具有显著差异。本 研究还证实,Mef2c 基因的 mRNA 表达水平也是 出生前呈高表达,出生后逐渐降低,与组蛋白 H3 乙酰化水平变化趋势基本一致,提示组蛋白乙酰 化修饰可能是调控 Mef2c 基因表达的一个重要因 素。这也和本课题组之前的相关报道相一致[16]。 但是组蛋白广泛存在于所有 DNA 上,对其乙酰 化修饰的酶的种类繁多,因此,并不能确定有哪 些乙酰化酶参与了 Mef2c 乙酰化的修饰。基于此 原因,根据文献报道在心脏表达的组蛋白乙酰化 酶 主 要 有 P300、PCAF、SRC1、CBP、GCN5[17], 运 用 P300、PCAF、SRC1 三 个 组 蛋 白 乙 酰 化 酶 的 ChIP 级抗体行染色质免疫共沉淀进一步明确 Mef2c 转录因子启动子区域组蛋白乙酰化修饰受 到哪些组蛋白乙酰化酶的调控,是否也具有一定 的时序性。实验结果表明组蛋白乙酰化酶 P300、 PCAF、SRC1 均参与了 Mef2c 基因的启动子区域乙 酰化水平的调控,且其调控水平也存在动态变化。 P300、PCAF、SRC1 在 E14.5 时与 Mef2c 基因启动 子区域的结合量最多,以后随着心脏的发育成熟, 其结合量也逐渐下降。出生前后乙酰化酶各个亚 型的结合水平具有统计学意义,且乙酰化酶各个 亚型结合水平的变化趋势与组蛋白 H3 的乙酰化 水平基本相一致。这提示 P300、PCAF、SRC1 三 个乙酰化酶均可能参与了心脏发育相关转录因子 Mef2c 的乙酰化调控。但是各个乙酰化酶之间是 否具有协同作用以及是否还有其他因素参与修饰 Mef2c 的表达。这仍需进一步的研究证实。
心脏的发育是一个动态的过程,因此,只有 全面掌握了各个基因在心脏发育不同时期的表达 规律及其具体调控机制,才能从真正意义上实现 对心脏发育异常的早期干预,减少先心病这一严 重的出生缺陷。同时也为临床基因治疗先心病带 来新的契机。
| [1] | van der Linde D, Konings EE, Slager MA, et al. Birth prevalence of congenital heart disease worldwide: a systematic review and meta-analysis[J]. J Am Coll Cardiol, 2011, 58(21): 2241-2247. |
| [2] | He Y, Wang J, Gu X, et al. Application of spatio-temporal image correlation technology in the diagnosis of fetal cardiac abnormalities[J]. Exp Ther Med, 2013, 5(6): 1637-1642. |
| [3] | Lockhart MM, Wirrig EE, Phelps AL, et al. Mef2c regulates transcription of the extracellular matrix protein cartilage link protein 1 in the developing murine heart[J]. PLoS One, 2013, 8(2): e57073. |
| [4] | Xin M, Olson EN, Bassel-Duby R. Mending broken hearts: cardiac development as a basis for adult heart regeneration and repair[J]. Nat Rev Mol Cell Biol, 2013, 14(8): 529-541. |
| [5] | Voronova A, Al MA, Fischer A, et al. Gli2 and MEF2C activate each other's expression and function synergistically during cardiomyogenesis in vitro[J]. Nucleic Acids Res, 2012, 40(8): 3329-3347. |
| [6] | Huang JB, Liu YL, Sun PW, et al. Molecular mechanisms of congenital heart disease[J]. Cardiovasc Pathol, 2010, 19(5): e183-e193. |
| [7] | 俞立玮, 桂永浩. Gata4转录后蛋白共价修饰[J]. 中国当代儿科杂志, 2012, 14(10): 800-803. |
| [8] | Olson EN. Gene regulatory networks in the evolution and development of the heart[J]. Science, 2006, 313(5795): 1922-1927. |
| [9] | Vong LH, Ragusa MJ, Schwarz JJ. Generation of conditional Mef2cloxP/loxP mice for temporal-and tissue-specific analyses[J]. Genesis, 2005, 43(1): 43-48. |
| [10] | Zeisberg EM, Ma Q, Juraszek AL, et al. Morphogenesis of the right ventricle requires myocardial expression of Gata4[J]. J Clin Invest, 2005, 115(6): 1522-1531. |
| [11] | Qin X, Xing Q, Ma L, et al. Genetic analysis of an enhancer of the NKX2-5 gene in ventricular septal defects[J]. Gene, 2012, 508(1): 106-109. |
| [12] | Granados-Riveron JT, Pope M, Bu'lock FA, et al. Combined mutation screening of NKX2-5, GATA4, and TBX5 in congenital heart disease: multiple heterozygosity and novel mutations[J]. Congenit Heart Dis, 2012, 7(2): 151-159. |
| [13] | Amodio V, Tevy MF, Traina C, et al. Transactivation in Drosophila of human enhancers by human transcription factors involved in congenital heart diseases[J]. Dev Dyn, 2012, 241(1): 190-199. |
| [14] | 夏慧苏, 余细勇. NKX2.5基因的表观遗传学改变与先天性心脏病的关系[J]. 实用医学杂志, 2009, 25(24): 4257-4258. |
| [15] | Sadoul K, Boyault C, Pabion M, et al. Regulation of protein turnover by acetyltransferases and deacetylases[J]. Biochimie, 2008, 90(2): 306-312. |
| [16] | 杨雪芳, 田杰, 陈国珍, 等. 小鼠胚胎心脏发育过程中组蛋白乙酰化酶亚型p300调控心脏特异转录因子的动态表达[J]. 重庆医科大学学报, 2010, 35(7): 961-965. |
| [17] | Yang XJ, Seto E. HATs and HDACs: from structure, function and regulation to novel strategies for therapy and prevention[J]. Oncogene, 2007, 26(37): 5310-5318. |
 2014, Vol. 16
2014, Vol. 16


