2. 华中科技大学同济医学院附属协和医院感染科, 湖北 武汉 430022
胆汁淤积是指胆汁流的形成和排泌障碍,可 由肝细胞或胆管上皮的胆汁分泌障碍或胆汁流的 阻断所致,其结果可导致胆汁酸等毒性物质的潴 留,引起肝细胞损伤和胆汁淤积性肝病[1],其机制 和胆汁成分的合成、分泌、解毒和转运等方面关 系密切[2]。发生在婴儿(包括新生儿)期称婴儿胆 汁淤积。引起婴儿胆汁淤积的主要原因是婴儿肝 炎综合征(infantile hepatitis syndrome,IHS),若不 及时进行有效治疗可发展为胆汁性肝硬化,最终 因肝功能衰竭或合并肺炎而死亡,严重影响婴儿 的生存质量甚至威胁生命[3, 4]。目前临床上治疗胆 汁淤积的常用药物包括熊去氧胆酸(UDCA)和皮 质激素,但其治疗疗效尚不满意[5]。中药大黄已应 用于临床治疗肝内胆汁淤积。大黄素(6-甲基-1,3,8-三羟基蒽醌)是大黄中分离出来的主要有效单体, 具有肝保护作用及抗炎、抗病毒、抑菌、免疫调节、 促进胃肠蠕动、抗氧化、清除自由基、改善微循 环等药理作用[6, 7, 8, 9, 10]。前期研究已证实大黄素具有治 疗α-异硫氰酸萘酯(alpha-naphthylisothiocyanate, ANIT)诱导的急性肝内胆汁淤积性肝损伤作用 [11]。
近期研究发现,核受体法尼醇X 受体(farnesoid X receptor,FXR)是胆汁成分代谢的中心环节,目 前被认为是治疗胆汁淤积的关键靶点[1, 12],FXR 对 胆汁酸的合成、解毒和转运,以及肝纤维化形成 等方面均有作用。ANIT 诱发肝损伤的生物化学和 病理形态学改变与人肝内胆汁淤积性肝病相似, 目前为国际公认用来制作淤胆型肝炎动物模型的 药物[13, 14],本研究采用 ANIT 建立急性淤胆型肝炎 的动物模型,并以此动物模型研究 FXR 在淤胆型 肝炎肝组织中的表达及大黄素的干预作用。 1 材料和方法 1.1 实验动物及分组
健康雄性清洁级 Sprague-Dawley(SD)大鼠 90 只,体重 200±20 g,年龄 6±1 周,购自华中 科技大学同济医学院实验动物中心。将动物随机 分成正常对照组、模型组和大黄素干预组,各组 又依据造模后不同干预时间分为 24、48、72 h 三 个亚组,每个亚组 10 只大鼠,分笼饲养,标准饲 料喂养,自由饮水,控制室温 25±2℃,在开始实 验前先适应性喂养 3 d。 1.2 药物、试剂与仪器
大黄素粉(纯度 >98%,批号:26110401)购 于西安崇信天然添加剂有限公司,ANIT 购于美国 Sigma 公司。TRIzol 溶液购自美国 Invitrogen 公司, SYBRGreen Ⅰ荧光染料购自闪晶生物基因技术公 司,逆转录酶和 RNA 酶抑制剂购自日本 Toyobo 公 司。苏木素购自美国Sigma 公司,伊红Y、无水乙醇、 盐酸、二甲苯、包埋石蜡、中性树胶均购自国药 集团药业股份有限公司。PCR 仪为美国 Stratagene 荧光定量PCR 仪(Mx3000P)。血清总胆红素(TB)、 直接胆红素(DB)、丙氨酸氨基转移酶(ALT) 和胆汁酸(TBA)均由美国雅培(Abbott)Aeroset 全自动生化分析仪检测。 1.3 药物配制
大黄素粉用羧甲基纤维素钠配成 0.4% 的悬 液,ANIT 用麻油配成1% 的溶液,均于临用前配制, 使用前摇匀。 1.4 给药方法
大黄素干预组给予大黄素 20 mg/(kg · d) 灌胃, 大黄素剂量参考文献[11] 用药剂量,模型组和正常 对照组均给予等体积羧甲基纤维素钠溶液灌胃, 以上给药方式连续 4 d。 1.5 造模方法
除正常对照组外,其他 2 组均于实验的第 5 天按文献[13, 14] 给予 1%ANIT 麻油溶液 50 mg/kg 一 次灌胃,灌胃前后 12 h 所有动物均禁食不禁水, 以保证所灌药物充分均匀地吸收,正常对照组则 只给予等体积麻油灌胃。造模 4~6 h 后大黄素干预 组继续给予大黄素 20 mg/(kg · d) 灌胃,模型组和正 常对照组则仍给予等体积羧甲基纤维素钠溶液灌 胃,直至造模后 24、48、72 h 处死相应的动物。 1.6 胆汁引流及标本采集
各组大鼠经 6% 水合氯醛 250 mg/kg 腹腔注射 麻醉后,逐层剪开腹腔,分离出胆总管,结扎胆 囊底部,在胆总管中部剪一“V”型切口,插入引 流管(用腰穿管制成),引流 1 h 胆汁,计量并收 集 1 mL。分离腹主动脉,抽取 2 mL 动脉血置促凝 管内,4 000 r/min 离心 10 min,吸出血清,-20℃ 冰箱保存待检。抽血后取部分肝组织,生理盐水 冲洗,立即放入液氮中保存待检。另取每只大鼠 的同一叶肝脏置于4% 多聚甲醛液固定 48 h,脱 水后常规石蜡切片。 1.7 病理学检查
取4% 多聚甲醛液固定的肝组织,按常规方 法脱水、石蜡包埋、4 μm 连续切片、苏木精 - 伊 红(HE)染色,每只大鼠取 6 张切片照相,显微 镜下观察肝组织病理变化。 1.8 实时荧光定量 PCR 检测肝组织 FXR mRNA表达
采用 TRIzol 提取肝组织总 RNA。以总 RNA 为模板,逆转录成 cDNA,使用高亲合力双链 DNA 结合染料 SYBR green I 在 Mx3000P 检测系统进行 实时荧光定量 PCR。FXR 引物序列(149 bp): 上 游:5'-GAGAGATGGGAATGTTGGCTG-3', 下 游:5'-CTTGGTCGTGGAGGTCACTT-3'; β-actin 引 物 序 列(237 bp): 上 游: 5'-TCCTCCCTGGAGAAGAGCTA-3',下 游: 5'-TCAGGAGGAGCAATGATCTTG-3'。扩增条件: 95 ℃变性 30 s,62 ℃退火 40 s,72 ℃延伸 30 s, 85℃再延伸 8 s,每个循环在 85℃时检测荧光强度, 共 38~40 个循环。扩增结束后,将实时定量 RTPCR 产物从 68℃缓慢而均匀地升温至 95℃,温度 每升高 0.2℃读一次荧光值,每两次读值间隔 1 s。 对PCR 扩增产物定量后分级10 倍稀释做标准曲线。 FXR mRNA 表达水平以其与 β-actin 的相对表达量 来计算。 1.9 统计学分析
采用 SPSS 17.0 统计软件对数据进行统计学分 析,计量资料以均数 ± 标准差(x±s)表示,多 组间比较采用 one-way ANOVA 分析,在有差异性 的情况下进一步采用SNK-q检验行组间两两比较, P<0.05 为差异有统计学意义。 2 结果 2.1 各组大鼠生活状态及肝组织肉眼观察情况
正常对照组大鼠有活力,毛发柔顺有光泽, 尿色清亮,肝组织表面红润光滑,实施胆汁引流 时见胆汁顺利流出;模型组大鼠缺乏活力,毛发 凌乱、失去光泽,活动及进食均减少,尿色深黄, 肝组织失去红润光滑的外表,部分见黄色结节, 24 h 时胆汁流量减少,48 h 时胆汁流中断,72 h 时胆汁流开始恢复,但仍少于正常,肠管扩张明 显,部分见中毒性鼓肠;大黄素干预组大鼠活动 及进食均较模型组明显改善,尿色较模型组变浅, 肝组织黄色结节减少,48 h 时可引流出胆汁,肠 管扩张亦减轻。 2.2 各组肝组织病理形态学表现
正常对照组在 24、48、72 h 时间点肝组织的 肝小叶结构完整,肝细胞索排列整齐,肝细胞大 小一致,染色均匀,胆管上皮细胞完整,未见中 性粒细胞浸润。模型组大鼠造模后 24 h 肝组织即 可见明显病理改变,肝小叶结构破坏,肝细胞广 泛水变性和羽毛样变性,汇管区胆管上皮细胞肿 胀,可见脱落的胆管上皮细胞及脱落缺陷区,并 见明显的中性粒细胞浸润;48 h 变化更明显,肝 细胞明显肿胀,胞浆疏松,肝细胞核大小不一致, 核内染色质聚集,核仁粗大浓染,可见多个点状、 灶状坏死区,枯否细胞增生,胆管上皮细胞增生 明显,管腔狭窄,腔内可见大量坏死脱落细胞, 部分胆管上皮细胞内及胆小管内见胆栓形成,胆 管周围有大量中性粒细胞浸润,肝细胞点状、灶 状坏死区多局限于胆管周围的肝细胞;72 h 时以 上病变均减轻,但仍可见坏死灶和中性粒细胞浸 润。大黄素干预组在各时间点肝组织病理改变均 较模型组明显减轻,中性粒细胞浸润明显减少。 见图 1。
 |
图 1各时间点各组大鼠肝组织病理形态学表现(苏木精 - 伊红染色,×400)正常对照组各时间点肝小叶结构完整,肝细 胞索排列整齐,肝细胞大小一致。模型组 24 h 肝小叶结构破坏,肝细胞广泛水变性(箭头所示),并见中性粒细胞浸润;48 h 肝细胞变性 较 24 h 更严重,见气球样变(黑色箭头所示)和灶状坏死区(红色箭头所示);72 h 肝细胞病变开始恢复,胆管上皮细胞增生(箭头所示)。 大黄素组各时间点肝细胞病变均较模型组减轻。 |
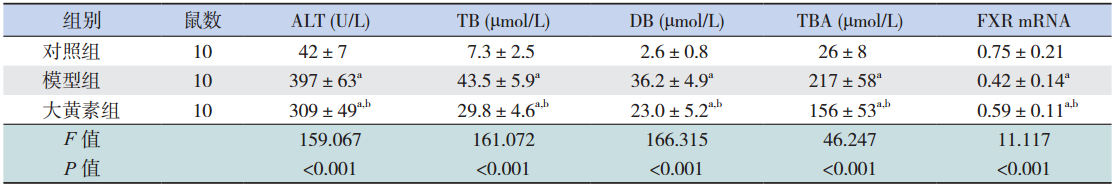
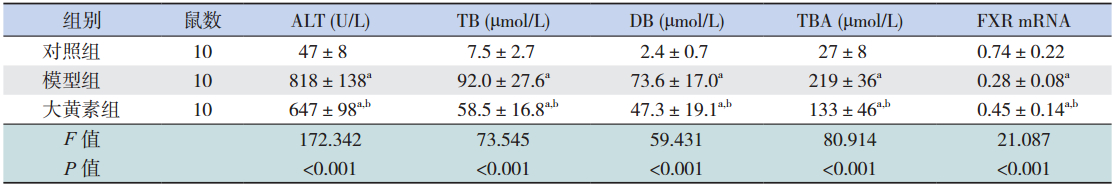
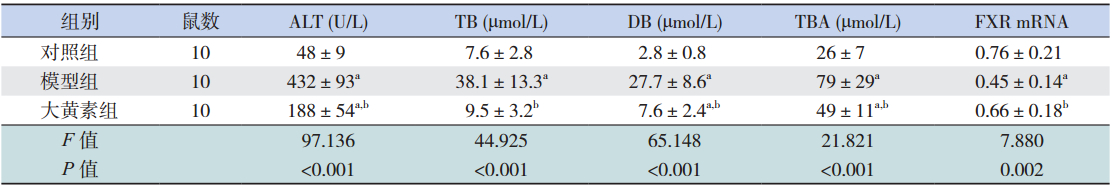
造模干预后各时间点,模型组大鼠血清 ALT、TB、DB、TBA 水平较对照组均显著增高 (均P<0.05),大黄素干预组大鼠血清ALT、 TB、DB、TBA水平均较模型组显著降低(均 P<0.05);除 72 h TB 水平外,大黄素干预组在其 他各时间点 ALT、TB、DB、TBA 水平仍高于对照 组(均P<0.05)。见表 1~3。
| 表 124 h 各组血清生化指标水平及肝组织 FXR mRNA 表达变化(x±s) |
| 表 248 h 各组血清生化指标水平及肝组织 FXR mRNA 表达变化(x±s) |
| 表 372 h 各组血清生化指标水平及肝组织 FXR mRNA 表达变化(x±s) |
造模干预后各时间点,模型组大鼠肝组 织中FXR mRNA水平较对照组显著降低(均 P<0.05),大黄素干预组大鼠肝组织中 FXR mRNA 水平较模型组显著升高(均P<0.05);除 72 h 外, 大黄素干预组在 24 h 和 48 h FXR mRNA 水平仍低 于对照组(均P<0.05)。见表 1~3。 3 讨论
胆汁淤积是一种临床综合征,常见于 IHS 等 疾病中,若不及时进行有效治疗,将导致肝硬化 等严重后果[3]。目前临床上治疗胆汁淤积的常用药 物包括 UDCA 和皮质激素[5],但其治疗疗效尚不 满意,且 UDCA 起效缓慢,较为昂贵,而皮质激 素具有免疫抑制副作用,使这两种药物的使用受 到很大限制[15]。因此,探索高效、低毒、价廉的 胆汁淤积治疗药物十分必要。
中药大黄具有增加胆红素排出肠道、减少胆 红素重吸收、促进胆汁分泌、保护肝细胞等作用, 因此,大黄已应用于临床治疗肝内胆汁淤积。但 大黄为中草药复合物,含有多种成分,其作用机 制不易阐明,因此有必要对大黄中的有效单体进 行进一步的研究以明确其作用机制,从而进一步 提高疗效、降低副作用。大黄素是大黄中分离出 来的主要有效单体,研究证实其具有肝保护作用 及抗炎、抗病毒、抑菌、免疫调节、促进胃肠蠕动、 抗氧化、清除自由基、改善微循环等药理作用[6, 7, 8, 9, 10], 为进一步探讨大黄素治疗淤胆型肝炎的作用及其 机制奠定了基础。前期研究已证实大黄素可通过 抗炎机制发挥对肝细胞的保护效应和对淤胆型肝 炎的治疗作用,这种作用主要是通过拮抗促炎细 胞因子和介质、抑制氧化应激损伤、改善肝脏微 循环、减少损伤信号、抑制中性粒细胞浸润等来 实现的[11]。本实验在此基础上进一步研究大黄素 对 FXR 的作用,以进一步探讨 FXR 在淤胆型肝炎 中的表达及大黄素的药理作用机制。ANIT 诱发动 物肝损伤的生物化学和病理形态学改变与人肝内 胆汁淤积性肝病相似[13, 14],常被用来制作淤胆型 肝炎的动物模型,而且 ANIT 在动物体内引起胆汁 淤积是可重复的,并呈剂量依赖性,从1962 年开始, 就被广泛用于诱导肝内胆汁淤积的动物模型[13], 本实验通过建立此动物模型进行研究。
FXR 是核受体超家族成员之一,因其可以被 生理水平的法尼醇激活而得名,是一种胆汁酸受 体,在肝脏、胆囊、胃肠道、肾上腺和肾脏均有 高度表达。FXR 由人的常染色体基因编码,具有 核受体的典型结构,即包括氨基末端高度保守的 DNA 结合区(DBD)、配体非依赖性转录激活功 能区(AF-1)、羧基末端配体结合区(LBD)及 配体依赖性功能区(AF-2)。FXR 的配体与 LBD 结合后,使核受体的空间构型发生改变,进而与 视黄醛衍生物受体(RXR)形成异源二聚体,直 接和特定的 DNA 反应元件结合,从而调节基因 的转录。FXR 与胆汁酸结合后调节胆汁酸代谢, 维持胆汁酸稳态。实验证明,FXR 对胆汁酸的 合成、解毒和转运,以及肝纤维化形成等方面均 有作用:FXR 能够通过小异源二聚体伴侣受体 (small heterodimer partner,SHP)抑制胆汁酸的合 成,诱导肝内胆汁酸的解毒效应,诱导小胆管胆 汁酸的排泄,增加胆汁的流动,增加胆汁中磷脂 的含量,通过 SHP 和过氧化物酶体增殖物激活受 体 γ(peroxisome proliferstor activated receptor γ, PPARγ)抑制肝纤维化的形成 [16, 17, 18] 。使用 FXR 的激动剂,如 GW4064、6-ECDCA 等可以明显降 低雌二醇诱导的胆汁淤积中肝细胞摄取胆盐,并 能恢复胆汁流动,降低血清淤胆指标。因此,核 受体 FXR 目前被认为处于胆汁淤积治疗的枢纽地 位[19],FXR 受到激动后,介导多种抑制胆汁淤积 的通路。
本实验结果发现,大黄素可降低淤胆型肝 炎的 ALT、TB、DB、TBA 水平,并可显著减轻 肝组织病理损伤,淤胆型肝炎模型组肝组织中 FXR mRNA 表达显著降低,大黄素则可促进 FXR mRNA 的表达。本研究进一步证实,大黄素的肝 保护作用,除了抗炎机制外,其对淤胆型肝炎的 治疗作用还可通过促进 FXR mRNA 表达来发挥。
本研究初步探讨了大黄素对处于胆汁淤积枢 纽地位的 FXR 的作用,在胆汁酸合成通路中, SHP 介导的抑制通路是 FXR 信号下传的关键分 子,与 FXR 呈配体关系;在胆汁酸解毒通路中, UGT2B4 接受来自于 FXR 的影响,下传 FXR 的解 毒信号;而在胆汁酸转运过程中,BSEP 激动后发 挥胆汁成分的转运作用,主要受到 FXR 的调控。 因此对处于 FXR 下游的其他胆汁淤积相关分子的 改变仍需进一步的研究。
| [1] | Wagner M, Zollner G, Trauner M. New molecular insights into the mechanisms of cholestasis[J]. J Hepatol, 2009, 51(3): 565-580. |
| [2] | Hirschfield GM, Heathcote EJ. Cholestasis and cholestatic syndromes[J]. Curr Opin Gastroenterol, 2009, 25(2): 175-179. |
| [3] | Ding Y, Zhao L, Mei H, et al. Alterations of biliary biochemical constituents and cytokines in infantile hepatitis syndrome[J]. World J Gastroenterol, 2006, 12(43): 7038-7041. |
| [4] | 唐清, 王琳琳, 单庆文, 等. 熊去氧胆酸对婴儿胆汁淤积性肝炎多药耐药蛋白3及法尼醇受体基因表达的影响和意义[J]. 中国当代儿科杂志, 2013, 15(9): 756-758. |
| [5] | Poupon R. Ursodeoxycholic acid and bile-acid mimetics as therapeutic agents for cholestatic liver diseases: an overview of their mechanisms of action[J]. Clin Res Hepatol Gastroenterol, 2012, 36(Suppl 1): S3-S12. |
| [6] | Li HL, Chen HL, Li H, et al. Regulatory effects of emodin on NF-kappaB activation and inflammatory cytokine expression in RAW 264.7 macrophages[J]. Int J Mol Med, 2005, 16(1): 41-47. |
| [7] | Koyama J, Inoue M, Morita I, et al. Correlation between reduction potentials and inhibitory effects on Epstein-Barr virus activation by emodin derivatives[J]. Cancer Lett, 2006, 241(2): 263-267. |
| [8] | Ho TY, Wu SL, Chen JC, et al. modin blocks the SARS coranavirus spike protein and angiotension-converting enzyme 2 interaction[J]. Antiviral Res, 2007, 74(2): 92-101. |
| [9] | Ghosh S, Das Sarma M, Patra A, et al. Anti-inflammatory and anticancer compounds isolated from Ventilago madraspatana Gaertn, Rubia cordifolia Linn and Lantana camara Linn[J]. J Pharm Pharmacol, 2010, 62(9): 1158-1166. |
| [10] | Zhang HQ, Zhou CH, Wu YQ. Effect of emodin on small intestinal peristalsis of mice and relevant mechanism[J]. World J Gastroenterol, 2005, 11(20): 3147-3150. |
| [11] | Ding Y, Zhao L, Mei H, et al. Exploration of Emodin to treat alpha-naphthylisothiocyanate-induced cholestatic hepatitis via anti-inflammatory pathway[J]. Eur J Pharmacol, 2008, 590(1-3): 377-386. |
| [12] | Sturm E, Wagner M, Trauner M. Nuclear receptor ligands in therapy of cholestatic liver disease[J]. Front Biosci, 2009, 14: 4299-4325. |
| [13] | Goldfarb S, Singer EJ, Popper H. Experimental cholangitis due to alpha-naphthylisothiocyanate(ANIT)[J]. Am J Pathol, 1962, 40: 685-698. |
| [14] | Hillstrom J, Duane WC, Eckfeldt JH, et al. Lack of benefit of ursodeoxycholic acid in drug-induced cholestasis in the rat[J]. Proc Soc Exp Biol Med, 1992, 200(1): 122-126. |
| [15] | Carey EJ, Lindor KD. Current pharmacotherapy for cholestatic liver disease[J]. Expert Opin Pharmacother, 2012, 13(17): 2473-2484. |
| [16] | Wang YD, Chen WD, Moore DD, et al. FXR: a metabolic regulator and cell protector[J]. Cell Res, 2008, 18(11): 1087-1095. |
| [17] | Fiorucci S, Mencarelli A, Distrutti E, et al. Targetting farnesoid-X-receptor: from medicinal chemistry to disease treatment[J]. Curr Med Chem, 2010, 17(2): 139-159. |
| [18] | Zhang Y, Edwards PA. FXR signaling in metabolic disease[J]. FEBS Lett, 2008, 582(1): 10-18. |
| [19] | Zollner G, Trauner M. Nuclear receptors as therapeutic targets in cholestatic liver diseases[J]. Br J Pharmacol, 2009, 156(1): 7-27. |
 2014, Vol. 16
2014, Vol. 16