2. 中国人民解放军白求恩国际和平医院儿科, 河北 石家庄 050082
早产儿脑发育不成熟,生后大脑仍将经历重 要的成熟过程,早产加上各种围生期因素,使得 早产儿存在脑发育迟滞的可能[1]。尤其是胎龄不 足 33 周,出生体重 <1 500 g 的极低出生体重(very low birth weight,VLBW)早产儿,≤ 50% 的 VLBW 早产儿在儿童期存在严重的认知或行为缺陷、学 习障碍[2]。临床迫切需要一种无创、准确的检测方 法来早期评估早产儿脑发育。胼胝体是连接两侧 大脑半球最大的白质纤维束[3],在半球之间传递运 动、感觉和认知信息[4],其生长情况可以代表复杂 的脑神经结构发育的总体情况[5]。对于胼胝体与 早产儿神经运动发育的关系已引起临床工作者的 关注。目前国外已有关于新生儿胼胝体的研究报 道[6, 7, 8],且有新近研究对比早产儿与同龄足月儿胼 胝体于核磁共振成像(magnetic resonance imaging, MRI)正中矢状位的面积,结果显示早产儿组要小 于足月儿组[3]。国内尚无关于同龄早产儿及足月儿 胼胝体面积的对比研究,本研究应用高场 MRI 测 量足月儿与发育至同龄的 VLBW 早产儿胼胝体的 面积及其分区面积,比较二者间发育的差异,旨 在评价早产等病理因素对胼胝体发育的影响,期 望为临床早期发现日后可能出现神经运动发育异 常的早产儿提供依据,并尽早采取干预措施改善 早产儿脑发育,提高生存质量。 1 资料与方法 1.1 研究对象
选取 2011 年 10 月至 2012 年 10 月于沧州市 人民医院产科出生并于新生儿重症监护室(neonatal intensive care unit,NICU)治疗的新生儿 84 例为 研究对象,其中早产儿 60 例,足月儿 24 例。纳 入条件:(1)早产儿胎龄为 30~32 周且出生体 重 <1 500 g,足月儿胎龄为 39 周;(2)均为适 于胎龄儿;(3)外观无先天异常及中枢神经系 统异常;(4)母亲平素身体健康、月经周期规 律、记忆末次月经日期准确。随访 60 例早产儿, 有 30 例被成功随访,于纠正胎龄 39 周时采集颅 脑 MRI 图像,剔除不清晰图像 2 例,剩余 28 例早 产儿颅脑 MRI 图像均未显示有明显的软化灶及其 他损伤,纳入本研究,其中男 15 例,女 13 例, 平均胎龄 31.1±0.8 周,出生体重 1 378±58 g;收 集足月儿组出生 24 h 之内的颅脑 MRI 图像,剔除 不清晰图像 1 例和未达测量要求断面的 2 例,剩 余 21 例足月儿颅脑 MRI 图像纳入本研究,其中男 13 例,女 8 例,平均胎龄 39.3±0.2 周,出生体重 3 290±286 g。以上研究均经新生儿家长知情同意。 1.2 仪器与方法
采用飞利浦公司 Philips Intera Achieva 3.0T 超 高场强磁共振扫描仪,8 通道相控阵头部线圈, 所有受试新生儿均行 T1WI、T2WI 和 DWI 扫描。 扫描参数如下:SE-T1WI 序 列:TR=128 ms, TE=23 ms,常规进行矢状位和轴位扫描,扫描时间 19 s;DRIVE-CLEAR-T2WI 序 列:TR=3 000 ms, TE=80 ms,常规进行轴位扫描,扫描时间 99 s;层 厚 3 mm,层间距 1 mm,FOV 220 mm×220 mm, NEX 2。DWI 采用回波平面成像:TR=2 150 ms, TE=56 ms,梯度磁场从 X、Y、Z 轴 3 个方向上施 加,b 值 =1 000 s/mm2 ,FOV 220 mm×220 mm,矩 阵 512×512,层厚 3 mm,层间距 1 mm,NEX 2, 扫描时间 14 s。扫描前用海绵垫固定新生儿头部, 置柔软耳塞于双侧外耳道,待新生儿熟睡后进行 MRI 扫描,体位为仰卧位,头先进。在检查过程 中严格控制吸收剂量值在 3 W/kg 以下。将符合研 究要求的 49 例图像上传至飞利浦图像处理工作站 系统,选取 T1WI 上胼胝体正中矢状面进行研究, 以 bmp 格式输出图像并导入到 PhotoPad by ZAGG 1.4 软件中,由两名熟悉新生儿核磁共振诊断的 影像学医师对图像中的胼胝体和大脑感兴趣区域 (region of interest,ROI)进行勾画(图 1 ),每 位医师于不同时间分别勾画两次,对所有勾画图 像的测量结果进行组间及组内重复性检验,取两 次有效测量值的平均值。
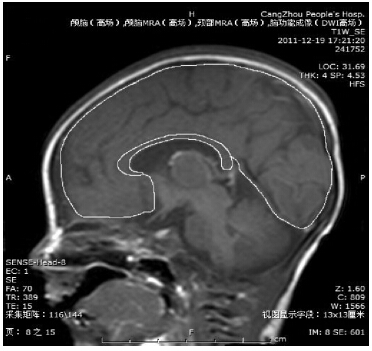 |
图 1 沿胼胝体及大脑边缘勾画后的 MRI 图像 |
将对胼胝体和大脑进行勾画过的图像导入到 MATLAB R2010a 软件中,采用基于数字图像处理 的图像面积计算方法来计算胼胝体和大脑面积, 面积计算公式如下:SROI=S×p/(m×n),其中 SROI 为需要测量的图像ROI 的面积,p 为图像 ROI 的像素点个数,m 和 n 分别为以像素点为单位 的图像长度和宽度,m×n 即为图像整个像素点的 个数,S 为图像的实际面积。 1.4 胼胝体分区
根据文献[9] 对胼胝体的分区方法,Hofer 等[10]在文献[9] 的基础上参照弥散张量成像术(diffusion tensor imaging,DTI)[11] 做 了 调 整,Thompson 等[3] 又在文献[10] 的基础上再次利用 DTI 技术对胼胝体 的分区进行了调整,本研究采用文献[3] 的分区方 法,将胼胝体正中矢状面按其长轴分为 6 个部分。 具体分割方法如下:按胼胝体前后联合线(长轴) 的 1/6、1/3、1/2、2/3 和 4/5 作五条垂直线,将胼 胝体分为膝部、前体部、前中体部、后中体部、 峡部和压部,见图 2 。
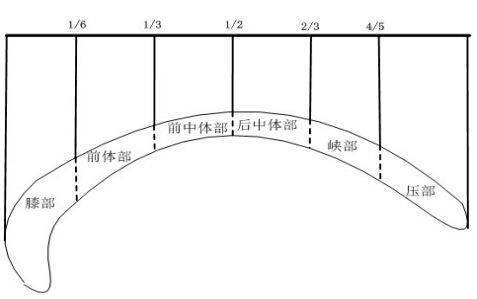 |
图 2 基于文献[3] 分割方法进行的胼胝体分区 |
为了消除不同个体之间大脑面积差异的潜在影响,需要对胼胝体面积进行校正工作。本研究 采用协方差法[3] 来对胼胝体面积进行校正,即以 大脑正中矢状位的面积作为协变量,其中校正公 式 为:cCC=mCC-g×(mMSA-aveMSA),cCC 为 校正后的胼胝体面积,mCC 为实际测量的胼胝体 面积,g 为实际测量的胼胝体面积与大脑面积之间 的回归线梯度(斜率),mMSA 为实际测量的大脑 面积,aveMSA 为所有实际测量得到的大脑面积的 平均值。6 个分区面积亦用同法校正。 1.6 统计学分析
应用 SPSS 13.0、Microsoft Excel 2007 和 MATLAB R2010a 对数据进行统计学分析和处理,所有测得 的数据均值均以均数±标准差(x±s)来表示, 组间和组内重复性检验采用配对样本t检验;足月 儿与同龄早产儿之间胼胝体面积及其 6 个分区面 积差异的比较采用独立样本t检验。P<0.05 为差 异有统计学意义。 2 结果 2.1 组间与组内重复性检验
采用配对样本t检验进行组间与组内重复性检 验,结果显示两位影像学医师勾画图像的测量结果 间,以及每位医师在不同时间两次勾画图像的测 量结果之间差异均无统计学意义(均P>0.05)。 2.2 胼胝体及分区面积测量值
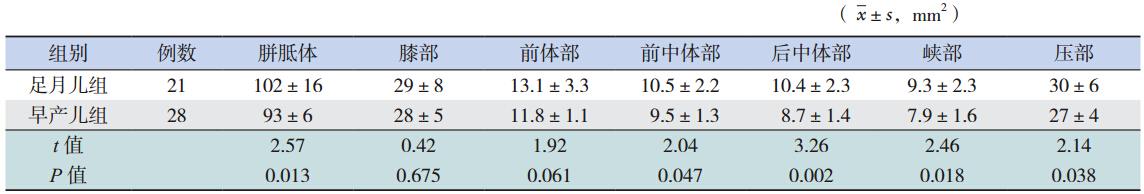
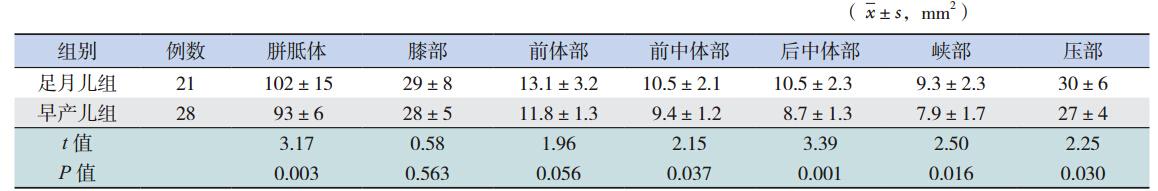
包括校正前的实际测量值(表 1)和经大脑 面积校正后的数值(表 2),可见相对于足月儿 来说,早产儿组校正前后的整个胼胝体、前中体 部、后中体部、峡部和压部的面积均是减少的, 两组间差异有统计学意义(均P<0.05),膝部和 前体部的面积在两组间差异均无统计学意义(均 P>0.05)。
| 表 1经大脑面积校正前的两组胼胝体及其分区正中矢状位面积比较 |
| 表 2经大脑面积校正后的两组胼胝体及其分区正中矢状位面积比较 |
胼胝体是由联系两侧端脑的联合纤维构成的 横行纤维束,是左右两侧大脑半球的重要连接通 路,起信息交流的作用。如果胼胝体发生病变或 发育异常,临床上会出现较为严重的症状及体征, 例如神经运动发育障碍、认知障碍、视觉障碍 等[12, 13, 14]。早期运用影像学技术检测胼胝体的生长 发育情况,可以帮助评估大脑的发育情况,对临 床工作有重要意义。
妊娠 18 至 20 周,胼胝体的各个部分均已基 本形成,但在其后的 3 个月胼胝体仍会继续生长, 直至生后 2 岁[3]。本研究选取了胎龄不足 33 周的 VLBW 早产儿进行随访,因其正处于胼胝体发育 的敏感时期,在远期随访观察中更容易发生神经 运动发育的异常。将其胼胝体与同龄足月儿组进 行对照比较,观察面积有无统计学差异。结果显 示两组胼胝体的面积大小是有统计学差异的,早 产儿组胼胝体面积要小于同龄足月儿组,目前尚 无研究显示胼胝体本身纤维的发育与胎龄有关, 但有研究结果显示随胎龄的增加,胼胝体的轴突 纤维直径逐渐增大[15],且胎龄愈小,胼胝体生长 愈慢[16, 17],直至青春期和成人期[6, 18]。
在进行两组比较时,对其胼胝体予以分区 形成 6 个分区的对照组,分析 6 个分区面积有无 统计学差异。分割胼胝体进行分区时未划分嘴部 进行研究,这是因为新生儿胼胝体的嘴部非常 小,变化度高,且不易辨识。胼胝体膝部、体 部、峡部及压部的发育情况可以提供洞察大脑发 育的时间过程[19],各个部分正常成熟的过程可以 指示皮层区域的发育过程[20, 21],所以本研究采用 Thompson 等[3] 的分区方法,计算了 39 周足月儿组 和随访的早产儿组发育至 39 周时的胼胝体膝部、 前体部、前中体部、后中体部、峡部和压部的面积。 比较两组胼胝体各个分区面积的差异,结果显示 随访的早产儿组 6 个分区中前中体部、后中体部、 峡部和压部的面积,即胼胝体的后 2/3 面积小于 与其比较的同龄足月儿组,此结论与 Thompson 等[3] 的研究结论类似。本研究选取的早产儿组与 Thompson 等[3] 选取的早产儿组相比有差异,本研 究中早产儿组胎龄为 31.1±0.8 周,出生体重为 1 378±58 g,未采集到 <30 周的早产儿,Thompson 等[3] 的研究资料中早产儿的胎龄为 27.6±1.7 周, 出生体重为 996±216 g。原因在于入住我院 NICU 胎龄 <30 周的早产儿生后需要应用生命支持设 备维持生命体征平稳,MRI 检查室无相应的屏 蔽设施,故无法采集当日颅脑 MRI 图像。虽与 Thompson 等[3] 的研究对象纳入标准不同,但研究 结论与其类似,分析原因可能与胎龄愈小、出生 体重愈低的早产儿,其胼胝体后部区域的发育更 容易受到病理因素的影响有关。
由结论可推测早产儿胼胝体的后 2/3 部分是 容易受到影响的区域。这是由于胼胝体的发育是 从前向后发育的,即从膝部向压部发育所致。在 胼胝体形成期间,如果大脑受到损伤,胼胝体的 前部(包括膝后部和体前部)通常已经形成,而 后部(包括体后部、压部和嘴部)尚缺失。有些 研究随访早产儿发育到儿童期和成人期,发现相 对晚发育的胼胝体后部区域更容易受到“早产” 因素的影响而发生病变[18, 22, 23]。胼胝体是脑内最大 的联合纤维,其膝部纤维向内前方弯曲,与两侧 额叶前部相连,体部纤维连接两侧额叶的运动前 区、中央前回、颞叶和顶叶,压部纤维向后弯曲, 连接两侧枕叶。对应于本研究中胼胝体的 6 个分 区来说,受影响最严重的区域是那些连接运动、 躯体感觉、颞叶、顶叶后部和枕叶区域之间的大 脑半球,涉及运动协调、感觉处理、听力、语言 和视觉。
本研究比较足月儿与发育至同龄的 VLBW 早 产儿在胼胝体及其分区面积上存在的差异,从而 了解 VLBW 早产儿宫外胼胝体的发育情况,以期 为早期评价和改善脑部发育提供参考。结果显示在发育至与足月儿同龄的早产儿中,整个胼胝体、 前中体部、后中体部、峡部和压部的面积减少, 提示早产儿胼胝体后部区域的发育可能更容易受 到病理因素的影响,如早产。
本研究纳入的研究对象尚少,因此该研究结 果还只是初步结论,研究尚处于初步阶段,今后 还需扩大样本量,从而进一步证实研究结果。且 在今后的工作中,需要对这一研究队列进行前瞻 性的随访研究,以便获得胼胝体异常发育与不良 神经结局的相关性,从而为预测远期神经发育不 良提供影像学标记物。
| [1] | 刘芳, 刘皎然, 杜志方, 等. 早产儿胼胝体生长率与运动发育迟滞关系的研究[J]. 中国当代儿科杂志, 2008, 10(6): 701-704. |
| [2] | Perenyi A, Amodio J, Katz JS, et al. Clinical utility of corpus callosum measurements in head sonograms of preterm infants: a cohort study[J]. BMJ Open, 2013, 3(4): e002499. |
| [3] | Thompson DK, Inder TE, Faggian N, et al. Characterization of the corpus callosum in very preterm and full-term infants utilizing MRI[J]. Neuroimage, 2011, 55(2): 479-490. |
| [4] | Amaniti EM, Hasenpusch-Theil K, Li Z, et al. Gli3 is required in Emx1+ progenitors for the development of the corpus callosum[J]. Dev Biol, 2013, 376(2): 113-124. |
| [5] | Anderson NG, Laurent I, Woodward LJ, et al. Detection of impaired growth of the corpus callosum in premature infants[J]. Pediatrics, 2006, 118(3): 951-960. |
| [6] | Narberhaus A, Segarra D, Caldu X, et al. Gestational age at preterm birth in relation to corpus callosum and general cognitive outcome in adolescents[J]. J Child Neurol, 2007, 22(6): 761-765. |
| [7] | Thompson DK, Inder TE, Faggian N, et al. Corpus callosum alterations in very preterm infants: perinatal correlates and 2 year neurodevelopmental outcomes[J]. Neuroimage, 2012, 59(4): 3571-3581. |
| [8] | Hasegawa T, Yamada K, Morimoto M, et al. Development of corpus callosum in preterm infants is affected by the prematurity: in vivo assessment of diffusion tensor imaging at term-equivalent age[J]. Pediatr Res, 2011, 69(3): 249-254. |
| [9] | Witelson SF. Hand and sex differences in the isthmus and genu of the human corpus callosum: a postmortem morphological study[J]. Brain, 1989, 112(3): 799-835. |
| [10] | Hofer S, Frahm J. Topography of the human corpus callosum revisited-comprehensive fiber tractography using diffusion tensor magnetic resonance imaging[J]. Neuroimage, 2006, 32(3): 989-994. |
| [11] | Chao YP, Cho KH, Yeh CH, et al. Probabilistic topography of humancorpus callosum using cytoarchitectural parcellation and high angular resolution diffusion imaging tractography[J]. Hum Brain Mapp, 2009, 30(10): 3172-3187. |
| [12] | Chaim TM, Duran FLS, Uchida RR, et al. Volumetric reduction of the corpus callosum in Alzheimer's disease in vivo as assessed with voxel-based morphometry[J]. Psychiatry Res, 2007, 154(1): 59-68. |
| [13] | Paul LK, Brown WS, Adolphs R, et al. Agenesis of the corpus callosum: genetic, developmental and functional aspects of connectivity[J]. Nat Rev Neurosci, 2007, 8(4): 287-299. |
| [14] | Mesaros S, Rocca MA, Riccitelli G, et al. Corpus callosum damage and cognitive dysfunction in benign MS[J]. Hum Brain Mapp, 2009, 30(8): 2656-2666. |
| [15] | Lebel C, Caverhill-Godkewitsch S, Beaulieu C. Age-related regional variations of the corpus callosum identified by diffusion tensor tractography[J]. Neuroimage, 2010, 52(1): 20-31. |
| [16] | Anderson NG, Laurent I, Cook N, et al. Growth rate of corpus callosum in very premature infants[J]. AJNR Am J Neuroradiol, 2005, 26(10): 2685-2690. |
| [17] | Anjari M, Srinivasan L, Allsop JM, et al. Diffusion tensor imaging with tract-based spatial statistics reveals local white matter abnormalities in preterm infants[J]. Neuroimage, 2007, 35(3): 1021-1027. |
| [18] | Lawrence EJ, Allen GM, Walshe M, et al. The corpus callosum and empathy in adults with a history of preterm birth[J]. J Int Neuropsychol Soc, 2010, 16(4): 716-720. |
| [19] | Keshavan MS, Diwadkar VA, DeBellis M, et al. Development of the corpus callosum in childhood, adolescence and early adulthood[J]. Life Sci, 2002, 70(16): 1909-1922. |
| [20] | Innocenti GM. Some new trends in the study of the corpus callosum[J]. Behav Brain Res, 1994, 64(1-2): 1-8. |
| [21] | Keshavan MS, Diwadkar VA, Harenski K, et al. Abnormalities of the corpus callosum in first episode, treatment naive schizophrenia[J]. J Neurol Neurosurg Psychiatry, 2002, 72(6): 757-760. |
| [22] | Nosarti C, Rushe TM, Woodruff PWR, et al. Corpus callosum size and very preterm birth: relationship to neuropsychological outcome[J]. Brain, 2004, 127(9): 2080-2089. |
| [23] | Stewart AL, Rifkin L, Amess PN, et al. Brain structure and neurocognitive and behavioural function in adolescents who were born very preterm[J]. Lancet, 1999, 353(9165): 1653-1657. |
 2014, Vol. 16
2014, Vol. 16