2. 那坡县人民医院儿科, 广西 那坡 533900
尿苷二磷酸葡萄糖醛酸转移酶 1A1(UGT1A1) 是胆红素代谢关键酶,是人体内唯一催化胆红 素结合反应的酶[1],该酶由 UGT1A1 基因编码。 UGT1A1 基因定位于染色体 2q37,包括 5 个外显 子(外显子 1~5),编码区长 1 602 bp,启动子区 域紧靠第 1 外显子转录起始点上游,包括 TATA 盒序列。该基因突变导致酶活性降低或消失,影 响胆红素的结合反应,使胆红素积聚而引起新生 儿高胆红素血症(简称高胆)[2]。近年来国内外研 究主要集中在 UGT1A1 基因启动子 TATA 盒与第 1 外显子区域,对具体种族的 UGT1A1 启动子 TATA 盒及编码区的整体分析较少。黑衣壮族是壮族的 一个分支,广西那坡县是黑衣壮族聚居地,此地 新生儿高胆发病率较高。本研究检测了那坡县黑 衣壮族 100 例高胆患儿及 100 例无高胆新生儿的 UGT1A1 基因启动子 TATA 盒及所有外显子基因序 列,以了解黑衣壮族高胆新生儿 UGT1A1 基因突 变分布情况,探讨 UGT1A1 基因突变与黑衣壮族 不明原因的新生儿高胆之间的关系,现报道如下。 1 资料与方法 1.1 研究对象及分组
纳入标准:广西三代纯系黑衣壮族足月新生 儿,日龄 2~14 d,出生体重 2.5~4.0 kg,并经医院 伦理委员会批准,患儿家属签署知情同意书。
高胆组(病例组):随机选取 100 例 2011 年 6 月至 2013 年 5 月入住那坡县人民医院新生儿科 的高胆新生儿,日龄总胆红素值达到或超过“考 虑光疗”或“光疗”值,参见新生儿黄疸干预推 荐方案[3],以间接胆红素增高为主。
对照组:随机选取 100 例同期在那坡县人民 医院产科出生的健康新生儿,在医院观察 3~5 d 出 院后随访至 2 周,无黄疸或胆红素水平未达“考 虑光疗”值。
排除标准:先天性畸形、G-6-PD 缺乏、低出 生体重儿、小于胎龄儿、围生期缺氧窒息、巨大儿、 败血症儿、头颅血肿、红细胞增多症、ABO 或 Rh 血型不合所致溶血病、低血糖、母亲妊娠期间合 并其他疾病(妊高征、贫血、感染、糖尿病)者 予以排除。 1.2 DNA 提取
采集新生儿外周血 2 mL 以 EDTA 抗凝,用血 液基因组小量提取试剂盒(康为世纪公司)提取 基因组 DNA,-20℃保存。 1.2.1 引物设计
参考文献[4, 5]设计 UGT1A1 基 因启动子TATA盒及5 个外显子共7 对引物,见表 1。
| 表 1UGT1A1 基因扩增及测序引物 |
PCR反应体系(总体积50 µL):2×Taq MasterMix(康为世纪公司) 25 µL,上下游引物 各 1 µL,模 板 3 µL,去离子水补充至50 µL。 PCR 反 应 程 序:TATA 盒 +Exon1 N1:95 ℃ 预 变 性 5 min,95℃变性 1 min,60℃退火 1 min,72℃ 延伸 1 min,循环 35 次,最后 72 ℃延伸 5 min, 4℃延时。其余片段:94℃预变性 2 min,94℃变 性 15 s,退火 30 s(退火温度:Exon1 N2 和 Exon5 N2 为 62 ℃,Exon2 和 Exon3 为 56 ℃,Exon4 为 58℃,Exon5 N1 为 60℃),68℃延伸 30 s,循环 30 次,68℃终延伸 5 min,4℃延时。 1.4 琼脂糖凝胶电泳
以 DM2000DNA Marker 作为分子量标准物, 取反应产物 5 µL 在用溴乙锭染色的 2%琼脂糖凝 胶上电泳,生物电泳图像分析系统观察 DNA 电泳 条带并摄影。 1.5 PCR 产物测序
将合格的反应产物进行正向测序(上海生 工生物工程技术服务有限公司),测序结果与基 因文库中的UGT1A1 基因序列进行对照,应用 chromas 软件分析测序结果,根据各基因碱基波形 判断基因突变位点,发现突变位点即进行反向测 序。 1.6 统计学分析
用 SPSS 16.0 统计软件进行数据分析,基因 型频率、等位基因频率的比较采用卡方检验或者 Fisher 确切概率法。基因多态性对新生儿高胆影响 的优势比(odds ratio,OR)和 95%可信区间(CI) 用二分类变量 logistic 回归分析,P<0.05 为差异有 统计学意义。 2 结果 2.1 琼脂糖凝胶电泳结果
PCR 产物均呈单一条带,片段大小与目的片 段相符(图 1 )。
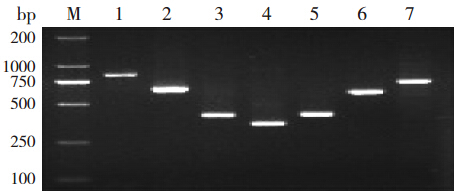 |
图 1 琼脂糖凝胶电泳检测结果 M:DNA 分子量标准物;1~7:7 对引物对应的扩增产物片段。 |
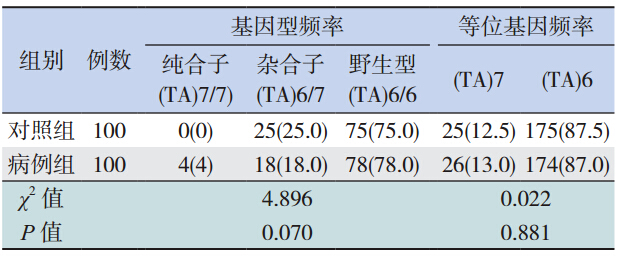
启动子区:病例组中检测到 A(TA)7TAA(简 称(TA)7)纯合突变 4 例,A(TA)6/7TAA(简 称(TA)6/7)杂合突变 18 例,突变频率为 22.0%(22/100);对照组中检测到(TA)6/7 杂合突变 25 例,未检测到(TA)7 纯合突变,突变频率为 25.0%(25/100)。见图 2。
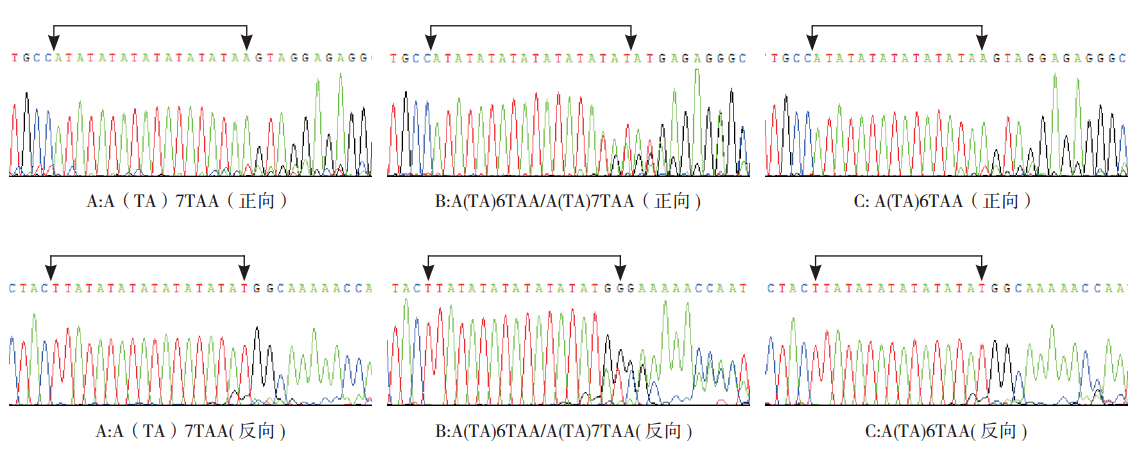 |
图 2 UGT1A1 启动子区基因突变检测 TATA 盒测序图 A 为纯合突变,B 为杂合突变,C 为野生型,箭头所指区域为 TATA 盒。 |
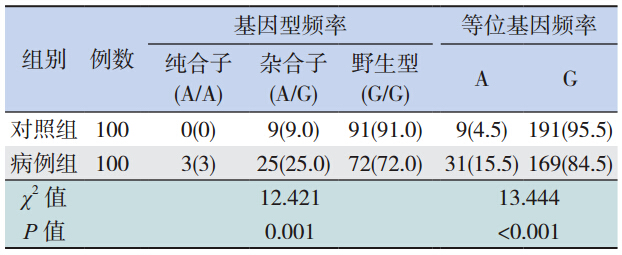
第 1 外显子区:病例组中检测到 G71R 纯合 子 3 例,杂合子 25 例,突变频率为 28.0%(28/100); 对照组中检测到G71R杂合子9 例,未检测到 G71R 纯合子,突变频率为 9.0%(9/100)。见图 3。
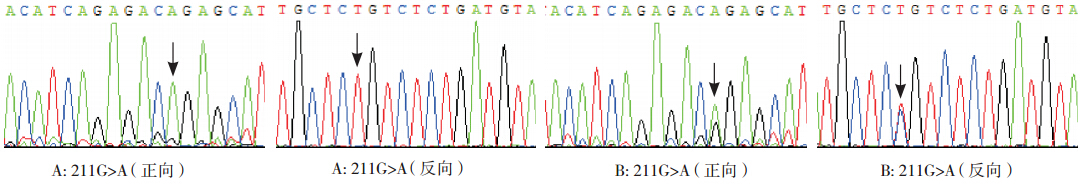 |
图 3 UGT1A1 G71R(211G>A)位点测序图 A 为纯合突变,B 为杂合突变,箭头所示为突变碱基。 |
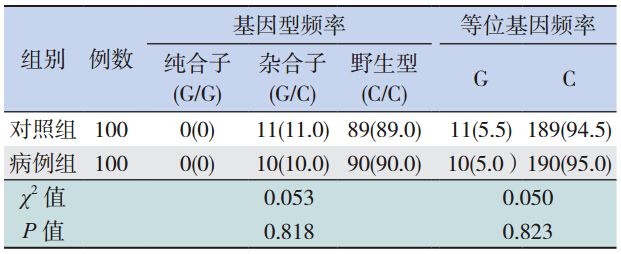
第5 外显子区:病例组和对照组各检测到 1491C>T( rs199539868)杂合体 1 例;对照组检 测到 1352 C>T(rs114982090)杂合体 1 例,病例 组没有检测到 ; 1941C>G(rs1042640)杂合体与 2042C>G(rs8330)杂合体协同出现,病例组检测 到 10 例,对照组检测到 11 例,通过检索 PAH 突 变数据库及查阅文献,发现这 4 个 SNP 位点为国 内首次报道,见图 4。
 |
图 3 UGT1A1 基因第 5 外显子区的 4 个 SNP 位点测序图 A 为 rs199539868 位点杂合突变,B 为 rs114982090位点杂合突变,C 为 rs1042640 位点杂合突变,D 为 rs8330 位点杂合突变,箭头所示为突变碱基。 |
第 2~4 外显子区没有检测到任何突变类型。 2.3 两组 UGT1A1 基因各突变位点的基因型分布
及等位基因频率分析 病例组和对照组 UGT1A1 G71R 的基因型分布 差异有统计学意义(χ2=12.421,P=0.001);病例 组的 G71R 等位基因频率显著高于对照组,差异亦 有统计学意义(χ2=13.444,P<0.001);病例组与 对照组 UGT1A1 TATA 盒、rs1042640、rs8330 的基 因型分布及等位基因频率比较,差异均无统计学 意义(P>0.05),rs199539868、rs114982090 突变 例数太少,未进行统计学分析,见表 2~4。
| 表 2两组 UGT1A1 G71R 基因型分布及等位基因频率的比较 [ 例(%)] |
| 表 3两组 UGT1A1 TATA 盒基因型分布及等位基因频率的比较 [ 例(%)] |
| 表 4两组 UGT1A1 rs1042640/rs8330 位点基因型分布及等位基因频率的比较 [ 例(%)] |
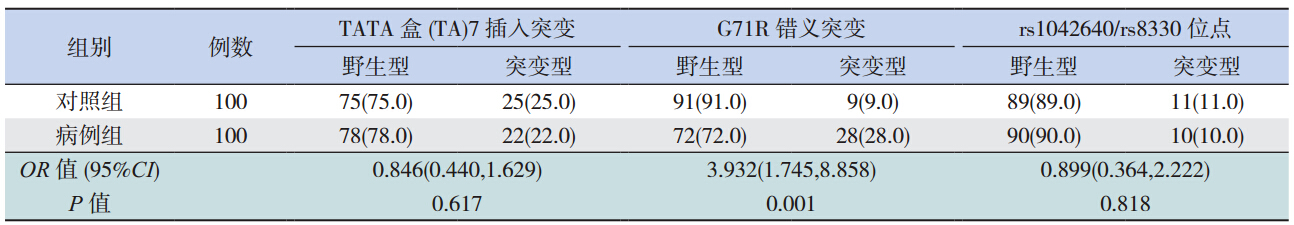
Logistic 回归分析显示,UGT1A1 G71R 突变是 广西黑衣壮族新生儿高胆发生的危险因素,启动 子 TATA 盒插入突变、rs1042640、rs8330 则与之 无相关性,见表 5。
| 表 5UGT1A1 不同位点基因突变对广西黑衣壮族新生儿高胆发生的影响 [ 例(%)] |
新生儿高胆病因复杂,近年来的研究显示 UGT1A1 基因突变与之密切相关。UGT1A1 基因突 变方式包括插入突变、缺失突变、错义突变、无 义突变、同义突变等,全世界已发现的 UGT1A1 突变类型已有100 余种,如启动子TATA盒插 入 突 变,第 1 外 显 子 G211A(G71R)、C686A (P229Q)、第 2 外显子 C872T(A291V)、第 3 外显子 A1070G(Q357R)、第 4 外显子 C1099G (R367G)、C1091T(P364L)、 第 5 外 显 子 T1456G(Y486D)错义突变等[6, 7, 8]。突变类型存在 人种和地域差异,欧美、非洲多为启动子 TATA 盒突变,其中(TA)7 突变最多[6];亚洲多为编 码区突变,其中以 G71R 最为多见[9]。本研究人 群中仅检测到(TA)7 插入突变、G71R 错义突 变及第 5 外显子中 4 个 SNP 位点(rs199539868, rs114982090,rs1042640,rs8330),第 2~4 外 显 子中均未检测到突变,提示广西黑衣壮族人群可 能不存在除上述几种突变类型以外的其他突变类 型或者其他突变类型在人群中突变率很低。
G71R 基因突变为 UGT1A1 基因第 1 外显子存 在 211G>A 突变,使突变点编码的甘氨酸变为精氨 酸,导致 UGT1A1 的葡萄糖醛酸化的能力降低[2]。 该突变是本研究病例组中最常见突变,突变频率 为 28.0%,高于北印度(0%)[10],低于我国深圳 (47.2%)及北方地区(45.3%)[11, 12],亦低于广西 来 宾 地 区(37.4%)[13]。1998 年 Akaba 等[9] 报道 G71R 突变与日本、韩国、中国新生儿高胆的发生 发展有密切联系,而与白种人和非洲人的发病无 相关性。本研究中病例组 G71R 等位基因频率与对 照组差异有统计学意义,提示 G71R 基因突变与广 西黑衣壮族新生儿高胆的发生相关,这与亚洲地 区以及本课题组前期研究相符[14]。结合 logistic 回 归分析,可认为 UGT1A1 G71R 基因突变是广西黑 衣壮族新生儿高胆的危险因素,但是在不同地区、 不同种族的突变频率可能不同。
TATA 盒(TA)n 多样性突变已发现有(TA)5, (TA)7,(TA)8 三种类型,(TA)7 突变即正 常的 A(TA)6TAA 突变为 A(TA)7TAA,在本 研究病例组中其突变频率居第 2(22.0%),但携 带(TA)7 纯合突变的个体仅占 4.0%,明显低于 非洲的突尼斯人(17.8%)、欧洲的法国人(17%) 和希腊人(18.6%)[15]。病例组和对照组(TA) 7 等位基因频率分别为 0.13 和 0.125,低于白种人 (0.36~0.4)及非洲人(0.48),而与日本人(0.15) 相近[16]。1995 年 Bosma 等[17] 报 道 UGT1A1 启 动 子 TATA 盒插入 / 缺失突变可导致 UGT1 表达减少, 使酶活性降低,成为 Crigler-Najjar Ⅱ综合征(CN-Ⅱ)和、Gilbert 综合征(GS)等的发病因素之一。 也有 Meta 分析报道启动子突变与大部分亚洲地区 新生儿高胆无直接相关性[18]。本研究中,病例组 与对照组(TA)7 的等位基因频率比较差异无统 计学意义,表明该基因突变与广西黑衣壮族新生 儿高胆无相关性,结合 logistic 回归分析,可认为 UGT1A1 TATA 盒(TA)7 插入突变不是广西黑衣 壮族新生儿高胆的危险因素,进一步验证了同一 位点基因变异情况及其与新生儿高胆的关系在不 同种族、不同地区中存在差异,这可能是环境和 遗传因素共同作用的结果。
第5外显子中检测到的4个SNP位点: rs199539868、rs114982090、rs1042640 及 rs8330 在本研究人群中的突变频率分别为 0.01、0.005、 0.105、0.105,它们在 NCBI 的 SNP 数据库里面的 最小等位基因频率(MAF)分别为 0.0005、0.0009、 0.1777、0.2404。国外对这几个 SNP 位点与新生 儿高胆关系的报道很少,Chen 等[19] 报道过 39 个 SNP 位点,仅 rs887829 与胆红素水平有关。在国内, 这几个 SNP 位点则是首次报道。本研究中,SNP 位点(rs1042640/rs8330)在病例组的基因型分布及等位基因频率与对照组比较差异均无统计学意 义,提示 rs1042640 及 rs8330 与本研究人群高胆的 发生无相关性,推测是因为 rs1042640 与 rs8330 位 点位于第 5 外显子 3'-UTR 区,为非编码区,可能 不是功能 SNP 或者与功能 SNP 没有连锁关系,因 而对 mRNA 稳定性无影响,或只是微效效应,所 以与该病不相关。rs199539868 为同义突变,不引 起氨基酸的改变,而 rs114982090 位点虽然为错义 突变(1352C>T),导致氨基酸序列改变(Pro=>Leu), 但只在对照组中发现 1 例,它们对于酶的表达影 响及是否有病理意义有待进一步研究。
本研究探讨了黑衣壮族高胆新生儿 UGT1A1 基因的启动子及所有外显子的突变分布情况及所 检测到的突变类型与新生儿高胆的关系,对今后 进行突变功能研究及基因诊断有一定的意义,但 本研究的患者数量有限,今后应扩大研究病人数 量,进一步探讨新生儿高胆的基因型与临床表型 的相关性。
| [1] | Tukey RH, Strassburg CP. Human UDP-glucuronosyltransferases: metabolism, expression, and disease [J]. Annu Rev Pharmacol Toxicol, 2000, 40(1): 581-616. |
| [2] | Kaplan M, Hammerman C, Maisels MJ. Bilirubin genetics for the nongeneticist: hereditary defects of neonatal bilirubin conjugation [J]. Pediatrics, 2003, 111(4): 886-893. |
| [3] | 叶鸿瑁, 魏克伦. 全国新生儿黄疸与感染学术研讨会纪要 (附新生儿黄疸干预推荐方案) [J]. 中华儿科杂志, 2001, 39(3): 184-185. |
| [4] | 陈群蓉, 孙顺昌, 彭运生,等. UGT1A1 基因启动子区 A (TA) nTAA 多态性分析及其与血清胆红素关系 [J]. 诊断学理论与实践, 2012,11(2): 149-152. |
| [5] | 沈健, 吴建新, 李定国. 1 例中国 Gilbert 综合征家系 UGT1A1 基因遗传分析 [J]. 胃肠病学, 2007, 12(7): 392-396. |
| [6] | Beutler E, Gelbart T, Demina A. Racial variability in the UDP-glucuronosyltransferase 1 (UGT1A1) promoter: A balanced polymorphism for regulation of bilirubin metabolism? [J]. Proc Natl Acad, 1998, 95(14): 8170-8174. |
| [7] | Sun G, Wu MY, Cao J, et al. Cord blood bilirubin level in relation to bilirubin UDP-glucuronosyltransferase gene missense allele in Chinese neonates [J]. Acta Paediatr, 2007, 96(11): 1622-1625. |
| [8] | Maruo Y, Sato H, Yamano T, et al. Gilbert syndrome caused by a homozygousmissense mutation (Tyr486Asp) of bilirubinUDP-glucuronosyltransferase gene [J]. J Pediatr, 1998, 132(6): 1045-1047. |
| [9] | Akaba K, Kimura T, Sasaki A, et al. Neonatal hyperbilirubinemia and mutation of the bilirubin uridine diphosphate‐glucuronosyltransferase gene: a common missense mutation among Japanese, Koreans and Chinese [J]. IUBMB Life, 1998, 46(1): 21-26. |
| [10] | Agrawal SK, Kumar P, Rathi R, et al. UGT1A1 gene polymorphisms in North Indian neonates presenting with unconjugated hyperbilirubinemia [J]. Pediatr Res, 2009, 65(6): 675-680. |
| [11] | 孙玲玲, 陈运生, 余珍珠,等. 新生儿高未结合胆红素血症遗传因素的研究 [J]. 中国当代儿科杂志, 2012, 14(4): 256-259. |
| [12] | 姜敏, 王亚娟, 罗洁,等. 北方地区新生儿高胆红素血症患儿 UGT1A1 和 OATP2 基因突变的研究[J]. 中国新生儿科杂志, 2012, 27(6): 369-372. |
| [13] | 钟勇, 蒋晓梅, 冯于玲,等. UGT1A1 基因多态性与不同民族间新生儿高胆红素血症的关系 [J]. 临床儿科杂志, 2013, 31(4): 324-327. |
| [14] | 高宗燕, 钟丹妮, 刘义,等. 胆红素-尿苷二磷酸葡萄糖醛酸基转移酶 G71R 基因型对广西地区新生儿黄疸程度的影响[J]. 中华儿科杂志, 2010, 48(9): 646-649. |
| [15] | Nikolac N, Simundic AM, Jurcic Z, et al. Rare TA repeats in promoter TATA box of the UDP glucuronosyltranferase (UGT1A1) gene in Croatian subjects [J]. Clin Chem Lab Med, 2008, 46(2): 174-178. |
| [16] | 郭栋, 庞良芳, 周宏灏. 尿苷二磷酸葡萄糖醛酸基转移酶基因多态性的研究进展 [J]. 生理科学进展, 2010, 41(002): 107-111. |
| [17] | Bosma PJ, Chowdhury JR, Bakker C, et al. The genetic basis of the reduced expression of bilirubin UDP-glucuronosyltransferase 1 in Gilbert's syndrome [J]. N Engl J Med, 1995, 333(18): 1171-1175. |
| [18] | 杨琳, 丁俊杰, 周文浩. UGT1A1 基因多态性与新生儿黄疸遗传关联性的 Meta 分析 [J]. 中国循证儿科杂志, 2010, 5(5): 335-348. |
| [19] | Chen G, Ramos E, Adeyemo A, et al. UGT1A1 is a major locus influencing bilirubin levels in African Americans [J]. Eur J Hum Genet, 2012, 20(4): 463-468. |
 2014, Vol. 16
2014, Vol. 16