2. 华中科技大学同济医学院附属协和医院干细胞中心, 湖北 武汉 430022;
3. 厦门市翔安区同民医院, 福建 厦门 361101
BCR/ABL 融 合 基 因 由t(9;22)(q34; q11)产生,是慢性粒细胞性白血病(CML)的特 定诊断,但也可在急性淋巴细胞性白血病(ALL) 和急性髓细胞性白血病(AML) 中表达[1]。EVI1 (ecotropic viral integration site)基因定位于染色 体 3q26,编码一个相对分子质量 14.5 万锌指转录 因子,此转录因子是一个位点特异的 DNA 结合蛋 白,参与 RNA 的转录调节。在白血病的发病中, EVI1 是一个重要的转录因子[2]。尽管曾有文献报 道 EVI1 和 BCR/ABL 共表达的 CML、AML 病例[3, 4], 但这种特异共表达的基因信号的生物学和临床重 要性还不清楚。本研究报道并比较分析 EVI1 和 BCR/ABL 基因共表达以及仅有 BCR/ABL 基因阳性 表达患儿的临床和实验室特征,以期为白血病的 临床工作提供资料。 1 资料与方法 1.1 研究对象
病例来源于2009年1月至2013年8月华中 科技大学同济医学院附属协和医院儿科血液病病 区初诊的白血病患儿12 例,包括EVI1 和BCR/ ABL 共表达患儿 4 例,BCR/ABL 基因表达阳性而 EVI1 表达阴性患儿 8 例。随访时间截止至 2013 年 8 月 30 日,中位随访时间为 12.5 个月(1~39 月)。 1.2 临床资料
收集患儿的临床资料,包括初诊外周血白细 胞计数、血红蛋白,血小板计数。ALL 患儿按照 中国儿童白血病协作组 -08 方案治疗[5],并加用络 氨酸激酶抑制剂伊马替尼。CML 患儿采用伊马替 尼治疗。伊马替尼剂量为每日 260~340 mg/(m2· d), 根据白细胞计数调整剂量。 1.3 EVI1 基因及 BCR/ABL 基因的检测
治疗前取肝素抗凝的骨髓液 2 mL,分离单 个核细胞,提取 RNA 。采用 RT-PCR 法检测包括 EVI1 基因和BCR/ABL 基因在内的29 种融合基因[6]。 1.4 流式细胞术免疫表型分析
每管中加入EDTA 抗凝的骨髓及4 色直接 标记荧光抗体。所用单克隆抗体包括草履虫叶绿 素蛋白(Percp)标记的 CD45 和异硫氰酸荧光素 (FITC)、藻红蛋白(PE)或别藻青蛋白(APC) 标 记 的 CD2、CD3、CD4、CD5、CD7、CD8、 CD10、CDllb、CD13、CD14、CD15、CD19、 CD20、CD22、CD33、CD34、CD38、CD56、 CD64、CD71、CD117、CD123、MPO、cCD79a、 HLA-DR、cCD3 和胞膜或胞内同型对照 IgG 等,均 购自美国 BD 公司。用 FACS CaliburTM 流式细胞仪 (BD 公 司)CellQuest 和 PAINT-A-GATE 软 件 获 取 并分析 10 000 个细胞 / 管,通过 CD45/SSC 设门, 分析计算各型白血病相关抗原的阳性率。 1.5 细胞遗传学检查
采取骨髓细胞标本,24 h 短期培养后制片, 收集有丝分裂中期细胞,热变性姬姆萨 R 显带, 应用 LeicaQ500 染色体自动分析仪,染色体核型分 析根据ISCN《人类细胞遗传学国际命名体制(ISCN) 1995》描述核型[7]。 1.6 荧光原位杂交
BCR/ABL 双色额外信号探针由北京金菩嘉公 司提供。荧光原位杂交(FISH)方法操作均按试 剂盒提供的说明进行。FISH 结果的判断标准为: 绿色信号为 BCR,红色信号为 ABL,融合信号呈 现黄色,为 BCR/ABL 融合基因。具有 BCR/ABL 融合基因的细胞呈现 1 个红色信号、1 个绿色信号 和 2 个黄色信号,正常细胞呈现 2 个分离的绿色 信号和 2 个分离的红色信号。 1.7 预后评价
CML 患 儿 血 液 学 完 全 缓 解(complete remission,CR):(1)临床症状、体征消失,脾 脏肿大消退;(2)外周血白细胞计数 <10×109/L, 分类无中幼粒、早幼粒或原始细胞;(3)血小板 计数正常并 <450×109/L,Hb>100 g/L;(4)骨髓 象正常[8]。ALL 患儿按国内儿童急性白血病疗效标 准评估[9]。总生存期(overall survival,OS):从诊 断日期到死亡或最后随访的时间。无事故生存期 (event-free survival,EFS):从诊断日期到第 1 次 事故或最后随访的日期,其中的事故评估包括以 下:在第一次完全缓解(CR)期内死亡或者发生 第二肿瘤;未达缓解(早期死亡或白血病耐药)、 白血病复发。 1.8 统计学分析
应用 SPSS 19.0 统计分析软件,计量资料用均 数 ± 标准差(x±s)表示,组间比较采用t检验; 计数资料以率(%)表示,组间比较采用 Fisher 确 切概率法。P<0.05 为差异有统计学意义。 2 结果 2.1 BCR/ABL 与 EVI1 基因共表达患儿的临床特征
12例患儿均检测到BCR/ABL 融合基因阳 性。病例 1~3 为 BCR/ABL 和 EVI1 基因均表达阳 性CML 患儿,包括男2 例,女1 例。其中初诊 时 CML 慢性期 2 例,CML 加速期 1 例。初诊时 为 CML 慢性期的 1 例患儿服用伊马替尼 1 个月左 右自行停药,在 12 个月后复查为 CML 加速期, 后继续使用伊马替尼治疗。病例4 为BCR/ABL 和 EVI1 基因均表达阳性 ALL 患儿。病例 5~12 为 BCR/ABL 融合基因表达阳性,而 EVI1 基因表达阴 性 CML 患儿,其中加速期 1 例,慢性期 7 例,包 括男 5 例,女 3 例。EVI1 基因在 CML 患儿的阳性 表达率为 27%(3/11)。
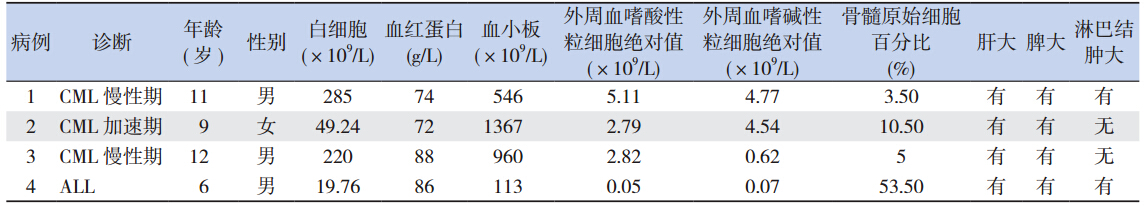
4 例 BCR/ABL 与 EVI1 共表达的患儿中,3 例 CML 患儿白细胞计数均增高,中度贫血,血小板 计数增高,外周血嗜酸性粒细胞和嗜碱性粒细胞 绝对值均增高;1 例 ALL 患儿白细胞计数增高, 中度贫血,血小板计数正常。4 例患儿初诊时均有 肝脾肿大,肝功能异常 1 例,凝血功能异常 3 例, 均无睾丸白细胞和中枢神经系统白血病(表 1)。
| 表 1EVI1 和 BCR/ABL 基因共表达患儿的临床特征 |
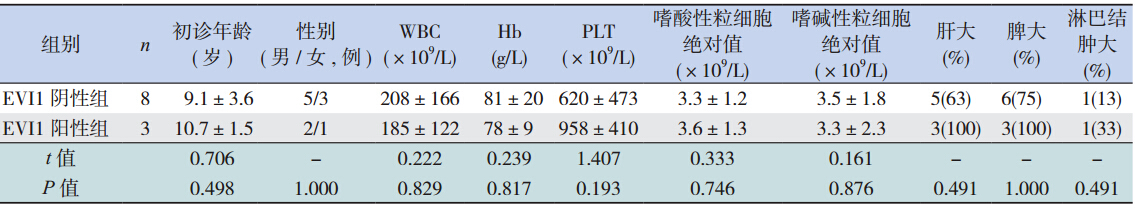
3 例 EVI1 与 BCR/ABL 基因共表达的 CML 患 儿与 8 例仅 BCR/ABL 基因表达阳性而 EVI1 基因 表达阴性的 CML 患儿临床特征相比:初诊时年龄、 性别、外周血白细胞计数、血红蛋白含量、血小 板计数、嗜酸性粒细胞绝对值、嗜碱性粒细胞绝 对值、肝肿大、脾肿大和淋巴结肿大的发生率差 异均无统计学意义(P>0.05)(表 2)。
| 表 2EVI1 和 BCR/ABL 基因共表达与仅 BCR/ABL 基因表达阳性 CML 患儿临床特征比较 |
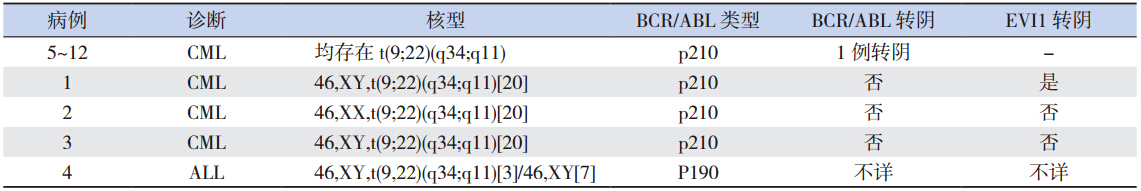
12 例白血病患儿初诊时均有 BCR/ABL 融合基 因表达阳性。核型分析均检测到t(9;22)(q34; q11)。初诊时共检测到 3 例 CML 患儿存在 EVI1 基因和 BCR/ABL 融合基因共表达。
截止到随访日期 2013 年 8 月,3 例 EVI1 基因 表达阳性 CML 患儿中 2 例 BCR/ABL 基因和 EVI1 基因未转阴,而 1 例患儿治疗 18 个月后 EVI1 基 因 转 阴,BCR/ABL 基 因 仍 未 转 阴。1 例 ALL 患 儿诱导治疗后未达缓解,放弃治疗,故没有进行 EVI1 和 BCR/ABL 基因的监测(表 3)。
| 表 3BCR/ABL 基因表达阳性而 EVI1 表达阳性或阴性 CML 患儿的实验室特征 |
免疫表型分析示 EVI1 与 BCR/ABL 共表达的患儿都高表达 CD33、CD38,另外 CD13、HLADR 都有不同程度的表达,ALL 为普通型 B-ALL,伴 髓系抗原表达。 2.3 BCR/ABL 与 EVI1 基因共表达患儿的预后
3 例 EVI1 基因表达阳性 CML 患儿有 2 例在 治疗 1 个月和 3 个月后达到血液学 CR,CR 率为 67%(2/3)。病例 4 泼尼松试验敏感,诱导治疗 未达到缓解,放弃治疗失访。其余 3 例 EVI1 和 BCR/ABL 基因共表达患儿均存活,OS 分别为 20、 13、14 个月,EFS 分别为 0、13、14 个月。3 例患 儿均无复发。
8 例 EVI1 基因表达阴性 CML 患儿中 4 例在 治疗 1 个月或 3 个月后达到血液学 CR,CR 率为 50%(4/8)。CR 率与 EVI1 基因表达阳性组 CR 率相比,差异无统计学意义(P=1.000)。4 例 CR 患儿复发 1 例,失访 1 例。另 4 例患儿未能达到 血液学 CR,其中失访 1 例,仍存活 1 例,死亡 2 例。 OS 为 12.50(1~39) 个 月,EFS 为 11.70(0~39) 个月。 3 讨论
t(9;22)(q34;q11)易位使 22 号染色体 上的 BCR 基因与 9 号染色体的 ABL1 基因易位形 成 BCR/ABL1 融合基因,其融合蛋白即组成新的 活化络氨酸激酶,可以活化多种信号通路,导致 白血病发生[10, 11]。BCR/ABL 是 CML 患儿诊断的细 胞遗传学指标,但并不是预后指标。在鼠模型上 BCR/ABL 融合基因可诱导产生 CML 样疾病,但是 与疾病的进展不相关,因为在该疾病的三个阶段 均可有其表达[12]。BCR/ABL 可以诱导鼠模型产生 骨髓增生性疾病,但要进展为 CML 急变期还需要 其他基因变异[13]。
动物试验证实 BCR/ABL 与 EVI1 可协同作用 于白血病的发生[14, 15, 16]。本组资料有 4 例患儿存在 BCR/ABL 和 EVI1 共表达,但患儿是在初诊时即检 测了包括 EVI1 和 BCR/ABL 在内的融合基因,而 对初诊时无 EVI1 和 / 或 BCR/ABL 融合基因的病例, 未再进一步监测。而 Stein 等[17] 报道 inv(3q)是 费城染色体的继发改变,而极少数病例费城染色 体却是继发改变。究竟 EVI1 和 BCR/ABL 在白血 病的发生和发展中,哪一个是始动因素? 2 个基 因是怎样相互作用的?故临床上对初诊时无 EVI1 和 BCR/ABL 基因表达的患儿仍需动态监测其表达。
本研究报道 4 例 EVI1 和 BCR/ABL 共表达的 患儿,其共同的临床特征包括:贫血、外周血白 细胞计数增高、肝脾肿大。同时,本研究也将 3 例 EVI1 和 BCR/ABL 共 表 达 的 CML 患 儿 与 8 例 BCR/ABL 表 达 阳 性 而 EVI1 基 因 阴 性 的 CML 患 儿临床特征进行初步比较,未发现有明显不同。 EVI1 基因表达对白血病患儿临床表现有无影响, 还需扩大样本例数进一步明确。
EVI1 和 BCR/ABL 共表达的 CML 对伊马替尼 抵抗[3]。Shimada 等[18] 报道 1 例初诊时即有染色体 异常t(3;12)(q26;p13)的 CML 患儿,进展 为急变期,对各种治疗抵抗,包括络氨酸激酶抑 制剂和干细胞移植。截止到随访日期,本资料中 EVI1 和 BCR/ABL 共表达的的 4 例白血病患者,除 1 例未达缓解,放弃治疗失访外,其余 3 例患儿均 存活,OS 分别为 20、13、14 个月,EFS 分别为 0、 13、14 个月。2 例 CML 患儿用络氨酸激酶抑制剂 治疗有效,均达到血液学 CR,近期预后可,还在 进一步随访以评估远期预后。
另外,络氨酸激酶抑制剂治疗 CML 失败的部 分原因是出现 BCR/ABL 的点突变,可降低药物靶 向活性,并产生另外的细胞遗传学异常,可降低 对 BCR/ABL 信号的依赖。Paquette 等[19] 研究发现 对络氨酸激酶抑制剂抵抗的 BCR/ABL 融合基因经 常与 EVI1 变异共同存在。对急变期的 CML 患者, 使用络氨酸激酶抑制剂后 EVI1 基因的变异率明显 增加,络氨酸激酶抑制剂暴露与 EVI1 变异之间的 关系可能部分源于络氨酸激酶抑制剂对 c-ABL 激 酶的抑制。细胞 DNA 受损后 c-ABL 从胞浆易位到 核,诱导细胞周期停止,启动 DNA 修复[20]。伊马 替尼等络氨酸激酶抑制剂可抑制c-ABL 激酶活性, 抑制双链 DNA 修复,从而使基因易位的可能性增 加。因此,临床上对于 BCR/ABL 融合基因表达阳 性患者,治疗中可常规监测 EVI1 基因的表达。这 同时也提供了研究伊马替尼耐药机制的思路,对 伊马替尼耐药的患者,是否可以联合使用络氨酸 激酶抑制剂和靶向治疗 EVI1 基因的药物,以提高 此类患者的治疗效果,可作为进一步研究的方向。
在大多数情况下,白血病细胞学检测往往落后于基因检测,即基因检测阳性时,细胞学检测 可能还是阴性。但本研究中病例1 未达血液学缓解, EVI1 基因在病程 18 个月转阴,提示 EVI1 表达改 变与临床缓解不同步,其原因尚未见文献报道。 是否 EVI1 基因异常表达是白血病发生中的一过性 的基因事件,还需实验来探讨 EVI1 基因的生物学 本质。
目前 3q26 重排是研究明确的可导致 EVI1 过 表达的机制,如 t(3;3)(q21;q26),inv(3), t(3,21)等[2]。但常规方法也可能检测不到隐 匿的 3q26 重排,正常核型也可有 EVI1 高表达。 本组资料染色体分析发现 4 例患儿都存在t(9; 22),但都未检测到 3q 等其他染色体重排。遗憾 的是,此类病例稀少,起初临床上并没有认识到, 所以没有做 FISH 验证有无 3q26 重排。
本研究还首次报道 1 例 EVI1 和 BCR/ABL 共 表达的 ALL。儿童 BCR/ABL1(+)ALL 化疗的复 发率很高,一直属于难治性 ALL[21]。而 EVI1 基因 在 ALL 中的表达报道也很少[22]。这 1 例 ALL 患儿, 按方案给予诱导缓解治疗,并口服伊马替尼。泼 尼松试验敏感,但第一疗程未达缓解即放弃治疗。 本研究发现其临床特征无明显特异性,免疫分型 为普通型 B-ALL,伴髓系抗原表达。这种病例以 前未见报道,原因可能是其发生率低,而且临床 医生对此关注少。
总之,在白血病的发生和发展中 EVI1 和 BCR/ ABL 基因究竟怎样相互作用,临床加强基因动态监 测,将为研究白血病的诊治提供充足的依据。
| [1] | Nacheva EP, Grace CD, Brazma D, et al. Does BCR/ABL1 positive acute myeloid leukaemia exist?[J]. Br J Haematol, 2013, 161(4): 541-550. |
| [2] | 姜敏, 吴介洪, 金润铭. EVI1基因在白血病中的研究进展[J].国际儿科学杂志, 2013, 40(4): 398-401. |
| [3] | Toydemir R, Rowe L, Hibbard M, et al. Cytogenetic and molecular characterization of double inversion 3 associated with a cryptic BCR-ABL1 rearrangement and additional genetic changes[J]. Cancer Genet Cytogenet, 2010, 201(2): 81-87. |
| [4] | Yagyu S, Morimoto A, Kakazu N, et al. Late appearance of a Philadelphia chromosome in a patient with therapy-related acute myeloid leukemia and high expression of EVI1[J]. Cancer Genet Cytogenet, 2008, 180(2): 115-120. |
| [5] | 王方.儿童急性淋巴细胞白血病治疗效果及预后影响因素的研究[D]. 华中科技大学学位论文, 2012. |
| [6] | Pallisgaard N, Hokland P, Riishoj DC, et al. Multiplex reverse transcription-polymerase chain reaction for simultaneous screening of 29 translocations and chromosomal aberrations in acute leukemia[J]. Blood, 1998, 92(2): 574-588. |
| [7] | Mitelman F. ISCN 1995: An Intemational System for Human Cytogenetic Nomenclature (1995)[M]. Karger Medical and Scientific Publishers, 1995. |
| [8] | 黄绍良,周敦华.小儿血液病临床手册[M].第3版. 北京:人民卫生出版社, 2010: 409. |
| [9] | 顾龙君.儿童急性淋巴细胞白血病诊疗建议(第三次修订草案)[J].中华儿科杂志, 2006, 44(5): 392-395. |
| [10] | Rosenzweig SA. Acquired resistance to drugs targeting receptor tyrosine kinases[J]. Biochem Pharmacol, 2012, 83(8): 1041-1048. |
| [11] | Laurent E, Talpaz M, Kantarjian H, et al.The BCR gene Philadelphia chromosome-positive leukemogenesis[J]. Cancer Res, 2001, 61(6): 2343-2355. |
| [12] | Gorre ME, Mohammed M, Ellwood K, et al. Clinical resistance to STI-571 cancer therapy caused by BCR-ABL gene mutation or amplification[J]. Science, 2001, 293(5531): 876-880. |
| [13] | Swerdlow SH, Campo E, Harris NL, et al. WHO Classification of Tumors of Haematopoietic and Lymphoid Tissues[M]. Lyon, France: IARC, 2008. |
| [14] | Cuenco GM, Nicifora G, Ren R. Human AML1/MDS1/EVI1 fusion protein induces an acute myelogenous leukemia (AML) in mice: a model for human AML[J]. Proc Natl Acad Sci USA, 2000, 97(4):1760-1765. |
| [15] | Cuenco GM, Ren R. Cooperation of BCR-ABL and AML/MDS1/EVI1 in blocking myeloid differentiation and rapid induction of an acute myelogenous leukemia[J]. Oncogene, 2001, 20(57): 8236-8248. |
| [16] | Su E, Han X, Jiang G. The transforming growth factor beta 1/SMAD signaling pathway involved in human chronic myeloid leukemia[J]. Tumori, 2010, 96(5): 659-666. |
| [17] | Stein S, Ott MG, Schultze-Strasser S, et al. Genomic instability and myelodysplasia with monosomy 7 consequent to EVI1 activation after gene therapy for chronic granulomatous disease[J].Nature Med, 2010, 16(2): 198-204. |
| [18] | Shimada K, Tomita A, Minami Y, et al. CML cells expressing the TEL/MDS1/EVI1 fusion are resistant to imatinib-induced apoptosis through inhibition of BAD, but are resensitized with ABT-737[J]. Exp Hematol, 2012, 40(9): 724-737. |
| [19] | Paquette RL, Nicoll J, Chalukya M, et al. Frequent EVI1 translocations in myeloid blast crisis CML that evolves through tyrosine kinase inhibitors[J]. Cancer Genet, 2011, 204(7): 392-397. |
| [20] | Chen G, Yuan SS, Liu W, et al. Radiation-induced assembly of Rad51 and Rad52 recombination complex required ATM and c-Abl[J]. J Biol Chem, 1999, 274(18): 12748-12752. |
| [21] | 左英熹, 张乐萍, 陆爱东, 等. 具有不同融合基因的B系急性淋巴细胞白血病患儿的临床特征分析[J]. 中国当代儿科杂志, 2010, 12(3): 172-176. |
| [22] | Konantz M, Andre MC, Ebinger M, et al. EVI-1 modulates leukemogenic potential and apoptosis sensitivity in human acute lymphoblastic leukemia[J]. Leukemia, 2013, 27(1): 56-65. |
 2014, Vol. 16
2014, Vol. 16