随着儿童急性淋巴细胞白血病(ALL)治疗 的发展,微小残留病(MRD)监测已在儿童 ALL 的治疗中起到不可替代的重要作用。流式细胞术 因其可覆盖 90%~95% 甚至超过 95% 的患者[1, 2, 3, 4], 而在儿童 B-ALL 的 MRD 监测中得到了广泛的应 用。目前诱导化疗结束时 MRD 的水平已公认为儿 童 ALL 的独立预后因素[5, 6, 7, 8, 9, 10],大部分研究认为应以 0.1% 作为判断预后的界值[8, 11, 12, 13, 14],但是有研究发现 具有不同遗传学异常的 B-ALL 患儿各组间诱导化 疗结束时 MRD 水平有所不同,MRD 的预后判断 阈值可能受到遗传学分组的影响,现有的多个研 究所得出的结论也不尽相同[15, 16, 17, 18],并且国内尚没 有大规模的病例报道。本研究通过总结我中心自 2004 年以来 9 年间的所有初治 B-ALL 患儿应用流 式细胞术监测的 MRD 结果,以期发现具有不同遗 传学异常各组的 MRD 特点并有助于完善 MRD 的 预后判断。 1 资料与方法 1.1 研究对象
选取2004年2月至2013年4月于我院住院 的初治 B-ALL 患儿 289 例为研究对象。所有患儿 均符合以下诊断标准:(1)发病时骨髓涂片示 原始 + 幼稚淋巴细胞≥ 30%;(2)免疫表型中 CD19、CD79a、CD22 至少两个阳性,且不满足急 性双系列或双表型白血病的诊断标准。剔除其中 诱导化疗结束时未进行 MRD 定量监测的 18 例, 共有 271 例(93.8%)进入本研究,其中男 156 例 (57.6%),女 115 例(42.4%),诊断时年龄从 14 d 至16 岁,中位年龄5 岁,其中<1 岁3 例(1.1%), 1~10 岁 213 例(78.6%),>10 岁 55 例(20.3%)。 1.2 MRD 监测
取肝素或 EDTA 抗凝骨髓 2~3 mL,2009 年 之前采用四色流式细胞仪,以CD34、CD10、 CD45、CD19 及 CD45、CD22、CD20、CD19 这 两组四色荧光标记抗体组合进行监测,2009 年 引进了八色流式细胞仪后,则以 CD34、CD10、 CD45、CD19、CD123、CD58、CD38、CD20 八 色荧光标记抗体组合进行监测。在部分病例中, 根据监测需要,加入发病时异常表达的抗体对残 留的白血病细胞进行进一步的确认。敏感度达到 0.01% 水平。
监测时间:(1)诱导化疗第 15 天,从 2010 年起开始监测,将所有患儿随机分为 2 组,其中 一组于第 8 天行骨髓形态学监测,另一组于第 15 天行骨髓形态学和 MRD 监测。(2)诱导化疗结 束时,且外周血白细胞计数回升至 1×109/L,一般 为化疗第 28~35 天。 1.3 遗传学检查 1.3.1 融合基因
治疗前取 EDTA 抗凝骨髓 3~ 4 mL,采用逆转录聚合酶链反应方法进行白血病 融合基因检测,检测的靶基因有:TEL-AML1、 E2A-PBX1、BCR-ABL、MLL 基因重排所形成的 融合基因(主要为MLL-AF1、MLL-AF4、MLLAF9、MLL-AF10)。 1.3.2 染 色 体
治疗前取肝素抗凝骨髓5~ 6 mL,采用 G 带技术显带,描述核型。 1.4 危险度分组标准
高危组依据(符合以下任意 1 条即列入高危 组):(1)年龄 <1 岁;(2)诊断时外周血白细 胞计数 >100×109 /L;(3)存在 BCR-ABL 融合基 因或者染色体核型为t(9;22);(4)存在 MLLAF4 融合基因或染色体核型为t(4;11);(5)染 色体核型为亚二倍体(<45 条);(6)诊断时已 发生中枢神经系统白血病或者睾丸白血病者。
标危组依据(同时具备以下 4 条即列入标危 组):(1)年龄 1~10 岁;(2)诊断时外周血白 细胞计数 <50×109/L;(3)肝脾肿大,肋下小于 5 cm;(4)必须不具备高危组任何 1 项危险因素。
中危组依据:不具备高危组及标危组条件者。 1.5 诱导化疗方案
不同危险度分组均采用相同的诱导化疗方案。 仅在诱导化疗过程中,根据患儿的危险度分组调 整蒽环类化疗药物的剂量及化疗间隔。对于存在 BCR-ABL 融合基因的患儿,如经济条件允许,第 10 天起,予口服格列卫靶向治疗。具体诱导化疗 方案见表 1。
| 表 1诱导化疗方案 |
采用 SPSS 20.0 统计软件对数据进行统计学分 析。计数资料采用百分率(%)表示,具有不同遗 传学背景的两组间率的比较采用 Mann-Whitney U 检验。P<0.05 为差异有统计学意义。 2 结果 2.1 遗传学异常分析
271 名患儿中,超二倍体(染色体 >50 条) 53 例(19.6%);亚二倍体(染色体 <45 条)3 例 (1.1%);TEL-AML1 融合基因阳性 50 例(18.4%); E2A-PBX1 融 合 基 因 阳 性 17 例(6.3%);BCRABL 融合基因阳性 11 例(4.1%),其中共有 8 例 口服格列卫;MLL 相关融合基因阳性 4 例(1.5%); 133 例(49.1%)未检出上述任何一种遗传学异常。 由于检测出 MLL 相关融合基因及亚二倍体的例数 过少,以下分析中未对其单独进行分析。 2.2 诱导化疗第 15 天 MRD 与诊断时遗传学异常 的关系
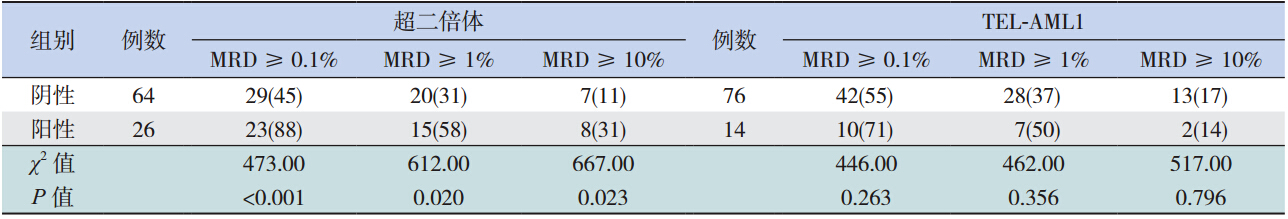
在 271 例患儿中,共有 90 例进行了诱导化疗 第 15 天 MRD 监测,其中超二倍体患儿 26 例,在 MRD 的 3 个检测界值上(分别 MRD ≥ 0.1%、1%、 10%)的检出比例均明显高于非超二倍体患儿(均 P<0.05),甚至有 31% 的超二倍体患儿 MRD 水平 ≥ 10%;TEL-AML1 融合基因阳性患儿 14 例,在 MRD 的 3 个检测界值上的检出比例与 TEL-AML1 融合基因阴性患儿比较,差异均无统计学意义(均 P>0.05)(表 2)。E2A-PBX1融合基因阳性和 BCR-ABL 融合基因阳性患儿各 3 例,因为例数过 少,所以未行统计学比较分析。
| 表 2诱导化疗第 15 天 MRD 与诊断时遗传学异常的关系 [例(%)] |
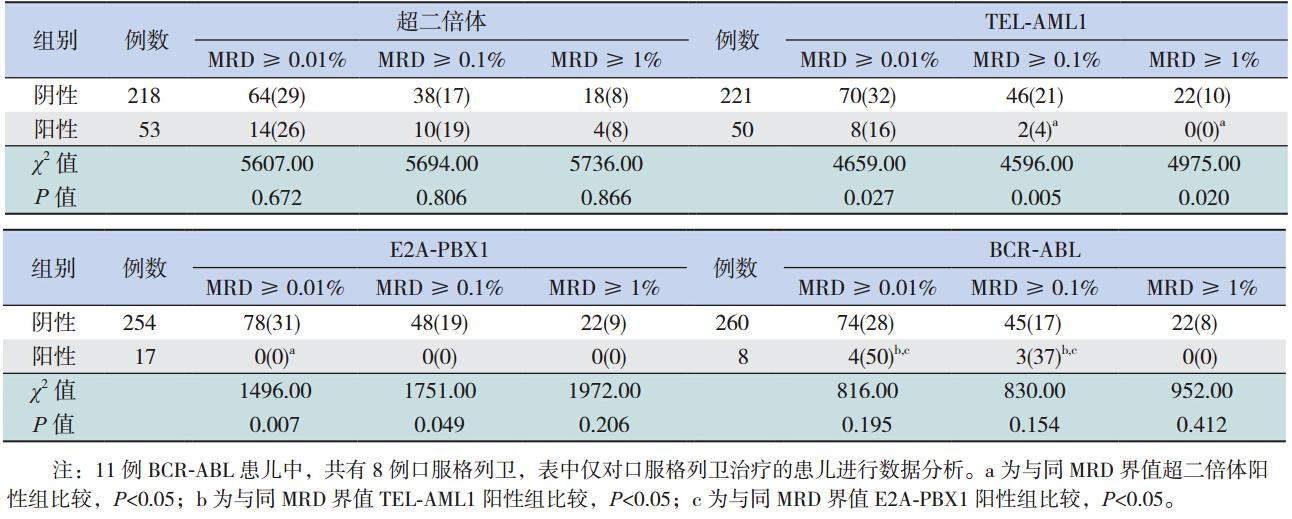
271例患儿在诱导化疗结束时均进行了 MRD 监测,超二倍体患儿与非超二倍体和 BCRABL 阳性患儿在 MRD 的 3 个检测界值上(分别 MRD ≥ 0.01%、0.1%、1%)的检出比例差异均无 统计学意义(均P>0.05)。除在 MRD ≥ 0.01% 的 检测水平外,超二倍体患儿在其余 2 个 MRD 检测 界值上的检出比例均高于 TEL-AML1 阳性患儿(均 P<0.05);且仅在 MRD ≥ 0.01% 的检测水平上 高于 E2A-PBX1 阳性患儿(P<0.05)。TEL-AML1 阴性患儿在 MRD 的 3 个检测界值上的检出比例 均高于 TEL-AML1 阳性患儿(均P<0.05)。E2APBX1 阴性患儿在 MRD ≥ 0.01% 和 MRD ≥ 0.1% 水平上的检出比例均高于 E2A-PBX1 阳性患儿(均 P<0.05)。BCR-ABL 阳性与阴性患儿在 MRD 的 3 个检测界值上的检出比例差异均无统计学意义(均 P>0.05);除在 MRD ≥ 1% 的检测水平外,BCRABL 阳性患儿在其余 2 个 MRD 检测界值上的检出 比例均高于 TEL-AML1 阳性和 E2A-PBX1 阳性患 儿(均P<0.05)。见表 3。
| 表 3诱导化疗结束时 MRD 与诊断时遗传学异常的关系 [ 例(%)] |
遗传学异常在儿童 ALL 中是很强的预后因素, TEL-AML1 融合基因阳性是预后较好的类型[19], 对于此组患儿而言,诱导化疗结束时其 MRD 水 平较 TEL-AML1 阴性组、超二倍体阳性组和 BCRABL 阳性组低是与本研究预计结果相符的,也与 其他的一些相关研究相符合[20, 21],但是其诱导化疗 第 15 天的 MRD 水平比 TEL-AML1 阴性患儿略高, 虽然差异无统计学意义,但与本研究预计的 TELAML1 阳性组有较好的早期治疗反应不同,目前尚 无相关文献报道。由于在诱导化疗第 15 天以后本 研究仅应用左旋门冬酰胺酶和糖皮质激素化疗, 且有文献报道具有 TEL-AML1 融合基因的 ALL 患 儿对左旋门冬酰胺酶(L-asp)较敏感[22],因此考 虑出现这种诱导化疗 15 d MRD 偏高但诱导化疗结 束时 MRD 水平较低的特点可能与 TEL-AML1 阳性 ALL 患儿对左旋门冬酰胺酶较敏感有关。
对于普遍认为预后较好的超二倍体[23](染色 体数目大于 50 条)组而言,其 15 天 MRD 水平显 著高于非超二倍体组的 MRD 水平,甚至有近 1/3 的患儿 MRD 水平达到或超过 10%,且诱导化疗 结束时 MRD 水平也较 TEL-AML1 阳性组和 E2APBX1 阳性组高,这与 Borowitz 等[20] 的大规模研究 中所得出的具有 4 号或 10 号染色体三体的超二倍 体患儿在诱导化疗结束时 MRD 水平偏高的结果相 似,这提示了尽管超二倍体组总体预后较好,但 其诱导化疗期间肿瘤细胞清除速度却是偏慢的; 同时,也提示对于超二倍体组而言,其用于预后 判断的诱导化疗时的 MRD 水平可能高于非超二倍 体组患儿。
在 儿 童 ALL 中,E2A-PBX1融合基因阳性 被认为是预后中等的类型[24],而在本研究中, E2A-PBX1 阳性组在诱导化疗结束时MRD 均小 于0.01%,其诱导化疗结束时MRD 水平明显低 于 E2A-PBX1 融合基因阴性的患儿,甚至较 TELAML1 阳性组低,这一结果与 Kager 等[25] 的研究结 果相似,考虑可能是因为本研究所采用的 CODPL 诱导化疗方案包含了环磷酰胺和剂量相对较大的 蒽环类化疗药。
BCR-ABL 融合基因阳性是公认的预后不良 的标志[26],在本研究中诱导化疗结束时该组的 MRD 在 0.01% 及 0.1% 水 平 阳 性 率 较 TEL-AML1 和 E2A-PBX1 阳性组均偏高,并且有超过 1/3 的患 儿 MRD ≥ 0.1%,这 与 Borowitz 等[20] 及 CoustanSmith 等[21] 的研究结果相似。而与 Borowitz 等[20] 的研究相比(BCR-ABL 阳性患儿 MRD>0.1% 的占 到 89%),本研究中 BCR-ABL 阳性患儿的 MRD 水平明显较低,原因可能为 Borowitz 等[20] 的研究 中所采用的诱导化疗方案不包含 CTX 化疗及格列 卫靶向治疗,这种差异提示对于 BCR-ABL 融合基 因阳性的患儿,诱导化疗中应用 CTX 化疗及格列卫靶向治疗是有利于早期肿瘤细胞的清除的。本 研究发现 BCR-ABL 阳性组患儿诱导化疗结束时的 MRD 水平明显高于 E2A-PBX1 及 TEL-AML1 阳性 组,但与 BCR-ABL 阴性及超二倍体组间的差异不 存在统计学意义,可能与本研究方案中加入了格 列卫有关,而且提示 MRD 在诱导化疗结束时的水 平可能不是独立的预后因素,可能受到遗传学分 组的影响,其结果有待于大规模前瞻性临床研究 证实。
| [1] | Campana D, Coustan-Smith E. Minimal residual disease studies by flow cytometry in acute leukemia[J]. Acta Haematol, 2004, 112(1-2): 8-15. |
| [2] | Popov AM, Verzhbitskaia T, Tsaur GA, et al. Minimal residual disease monitoring by flow cytometry in children with acute lymphoblastic leukemia[J]. Klin Lab Diagn, 2010, 69(8): 36-41. |
| [3] | Campana D, Neale GA, Coustan-Smith E, et al. Detection of minimal residual disease in acute lymphoblastic leukemia: the St Jude experience[J]. Leukemia, 2001, 15(2): 278-279. |
| [4] | Coustan-Smith E, Campana D. Immunologic minimal residual disease detection in acute lymphoblastic leukemia: a comparative approach to molecular testing[J]. Best Pract Res Clin Haematol, 2010, 23(3): 347-358. |
| [5] | Borowitz MJ, Devidas M, Hunger SP, et al. Clinical significance of minimal residual disease in childhood acute lymphoblastic leukemia and its relationship to other prognostic factors: a Children's Oncology Group study[J]. Blood, 2008, 111(12): 5477-5485. |
| [6] | Escherich G, Horstmann MA, Zimmermann M, et al. Cooperative study group for childhood acute lymphoblastic leukaemia (COALL): long-term results of trials 82,85,89,92 and 97[J]. Leukemia, 2010, 24(2): 298-308. |
| [7] | Bartram CR, Schrauder A, Kohler R, et al. Acute lymphoblastic leukemia in children: treatment planning via minimal residual disease assessment[J]. Dtsch Arztebl Int, 2012, 109(40): 652-658. |
| [8] | Meleshko AN, Savva NN, Fedasenka UU, et al. Prognostic value of MRD-dynamics in childhood acute lymphoblastic leukemia treated according to the MB-2002/2008 protocols[J]. Leuk Res, 2011, 35(10): 1312-1320. |
| [9] | Van der Velden VH, Corral L, Valsecchi MG, et al. Prognostic significance of minimal residual disease in infants with acute lymphoblastic leukemia treated within the Interfant-99 protocol[J]. Leukemia, 2009, 23(6): 1073-1079. |
| [10] | Eckert C, von Stackelberg A, Seeger K, et al. Minimal residual disease after induction is the strongest predictor of prognosis in intermediate risk relapsed acute lymphoblastic leukaemia-Long-term results of trial ALL-REZ BFM P95/96[J]. Eur J Cancer, 2013, 49(6): 1346-1355. |
| [11] | Zhou J, Goldwasser MA, Li A, et al. Quantitative analysis of minimal residual disease predicts relapse in children with B-lineage acute lymphoblastic leukemia in DFCI ALL Consortium Protocol 95-01[J]. Blood, 2007, 110(5): 1607-1611. |
| [12] | 郭豆豆, 赵文理, 张艳兰, 等. 多参数流式细胞术动态监测儿童B系急性淋巴细胞白血病微量残留病的临床意义[J]. 中国实验血液学杂志, 2012(6): 1346-1351. |
| [13] | 徐晓军, 汤永民, 宋华, 等. 儿童急性淋巴细胞性白血病微小残留病监测的预后意义[J]. 中华儿科杂志, 2010, 48(3): 180-185. |
| [14] | 叶启东, 顾龙君, 汤静燕, 等. MRD监测对儿童B系急性淋巴细胞性白血病疗效评估的意义[J]. 中国当代儿科杂志, 2008, 10(3): 333-336. |
| [15] | Campana D. Molecular determinants of treatment response in acute lymphoblastic leukemia[J]. Hematology Am Soc Hematol Educ Program, 2008, 2008(1): 366-373. |
| [16] | Mosad E, Hamed HB, Bakry RM, et al. Persistence of TEL-AML1 fusion gene as minimal residual disease has no additive prognostic value in CD 10 positive B-acute lymphoblastic leukemia: a FISH study[J]. J Hematol Oncol, 2008, 1(6):1-17. |
| [17] | Gao C, Zhao XX, Li WJ, et al. Clinical features, early treatment responses, and outcomes of pediatric acute lymphoblastic leukemia in China with or without specific fusion transcripts: a single institutional study of 1,004 patients[J]. Am J Hematol, 2012, 87(11): 1022-1027. |
| [18] | Mullighan CG, Su X, Zhang J, et al. Deletion of IKZF1 and prognosis in acute lymphoblastic leukemia[J]. N Engl J Med, 2009, 360(5): 470-480. |
| [19] | Moorman AV. The clinical relevance of chromosomal and genomic abnormalities in B-cell precursor acute lymphoblastic leukaemia[J]. Blood Rev, 2012, 26(3): 123-135. |
| [20] | Borowitz MJ, Pullen DJ, Shuster JJ, et al. Minimal residual disease detection in childhood precursor-B-cell acute lymphoblastic leukemia: relation to other risk factors. A Children's Oncology Group study[J]. Leukemia, 2003, 17(8): 1566-1572. |
| [21] | Coustan-Smith E, Sancho J, Hancock ML, et al. Clinical importance of minimal residual disease in childhood acute lymphoblastic leukemia[J]. Blood, 2000, 96(8): 2691-2696. |
| [22] | Ramakers-van Woerden NL, Pieters R, Loonen AH, et al. TEL/AML1 gene fusion is related to in vitro drug sensitivity for L-asparaginase in childhood acute lymphoblastic leukemia[J]. Blood, 2000, 96(3): 1094-1099. |
| [23] | Kajsa P, Erik F, Henrik L, et al. Genetic landscape of high hyperdiploid childhood acute lymphoblastic leukemia[J]. Proc Natl Acad Sci USA, 2010, 107(50): 21719-21724. |
| [24] | Moorman AV, Ensor HM, Richards SM, et al. Prognostic effect of chromosomal abnormalities in childhood B-cell precursor acute lymphoblastic leukaemia: results from the UK Medical Research Council ALL97/99 randomised trial[J]. Lancet Oncol, 2010, 11(5): 429-438. |
| [25] | Kager L, Lion T, Attarbaschi A, et al. Incidence and outcome of TCF3-PBX1-positive acute lymphoblastic leukemia in Austrian children[J]. Haematologica, 2007, 92(11): 1561-1564. |
| [26] | Moorman AV. The clinical relevance of chromosomal and genomic abnormalities in B-cell precursor acute lymphoblastic leukaemia[J]. Blood Rev, 2012, 26(3): 123-135. |
 2014, Vol. 16
2014, Vol. 16