急 性 淋 巴 细 胞 白 血 病(acute lymphocytic leukemia,ALL)是儿童最常见的肿瘤性疾病,其 治疗的关键在于杀伤肿瘤细胞并使患儿始终处于 缓解状态。6-巯基嘌呤(6-mercaptopurine,6-MP) 作为维持治疗阶段的主要化疗药物,对 ALL 治 疗 至 关 重 要。 巯 嘌 呤 甲 基 转 移 酶(thiopurine methyltransferase,TPMT)是 6-MP 等巯嘌呤类药物 的重要分解代谢酶,其单核苷酸基因多态性(single nucleotide polymorphisms,SNP) 可 能 使 该 酶 活 性 降低,继而造成活性代谢产物 6-硫鸟嘌呤核苷酸 (6-thioguanine nucleotides,6-TGNs)浓度升高,药 物毒性增加,最终导致 6-MP 用药存在明显的个体 差异[1]。就遗传药理学观点而言,ALL 患儿使用 6-MP 前检测 TPMT 基因型可能有利于调整用药剂 量,实现个体化治疗,但临床上关于 TPMT 基因 多态性是否影响个体 6-MP 耐受性尚存争议。本研 究旨在关注 ALL 患儿维持治疗阶段服用 6-MP 后的 不良反应发生情况,探讨中国汉族人群常见的两 个多态性位点(TPMT*3C、*1S)基因型 [2] 与患儿6-MP 耐受性的关系,以进一步提高 ALL 患儿 6-MP 治疗的安全性。 1 资料与方法 1.1 研究对象及维持治疗方案
选取2006年1月至2012年12月在我院血液 科确诊的 ALL 汉族患儿 46 例为研究对象,其中男 30 例,女 16 例,确诊年龄 5.0±2.8 岁,均严格 按照全国协作组方案[3] 或广州地区儿童 ALL 2002 化疗协作网方案(改良 ALLIC-BFM-2002 方案) [4] 进行治疗并达到以下要求:(1)病历中至少有 3 次有效临床资料;(2)患儿连续口服 6-MP 一个 月以上。全国协作组治疗方案具体为:每晚睡前 以 75 mg/m2 剂量顿服6-MP,每周以 20 mg/m2剂 量肌肉注射甲氨蝶呤,以上连用 3 次后改为长春 新碱 + 地塞米松用 1 周,反复序贯用药至加强治 疗及髓外白血病预防性治疗时停止;改良 ALLICBFM-2002 方案具体为:每晚以 50 mg/m2剂量空腹 口服 6-MP,每周以 20 mg/m2剂量口服甲氨蝶呤。 根据患儿临床危险度分型,以上两种方案中如有 需进行鞘内注射的药物(甲氨蝶呤、地塞米松), 则给药剂量及次数有所差异,化疗总疗程需2~3 年。 1.2 观察指标及评价标准
采用回顾性分析,遇维持治疗结束、复发或 失访时停止。详细记录每位患儿的一般资料(姓名、 性别、出生日期、ALL 临床危险度分型[3, 4])及每 次入院治疗前的体重、临床症状或体征、实验室 检查结果、6-MP 停用天数及剂量增减情况等作为 不良反应评估的依据。所有患儿均需除外输注血 制品 2 个月内的血常规检查记录;药物不良反应 分级采用美国国立癌症研究所第 3 版常规毒性判 定标准(NCI CTC 3.0):0 级为未出现药物不良反 应,1~2 级为轻度,3~4 级为重度[5, 6]。对最高级 别毒副反应及评价指标进行统计。 1.3 TPMTcDNA 制备
经监护人知情同意,于初治及输血前抽取 患 儿 骨 髓 液 1.5 mL,EDTA 抗 凝 并 低 温 保 存。 按 QIAamp®RNA Blood Mini Kit 试 剂 盒( 德 国QIAGEN 公司)说明书操作步骤提取总RNA 30 μL,-80 ℃ 冰 箱 保 存。 取 10 μL 总 RNA,采 用 Reverse Transcriptase XL 逆转录试剂盒(大连 TaKaRa 公司)获取 cDNA,分光光度计检测浓度。 1.4 PCR 扩增
PCR扩增使用的引物沿用本课题组以往 实验所设计的引物序列[2],TPMT 扩 增 分 两 步 进 行,第 一 轮 为 PCR 扩 增(PCR-1): 上 游 5'-GAGAAGTGGCGGAGGTGGAA-3',下 游 5'-GGAGGCTGAGGCAGGAGAATC-3',片段长 度 为 1 362 bp。 第 二 轮 为 巢 式 PCR 扩 增(PCR-2),2段扩增片段分别涵盖TPMT*1S、 *3C 突 变位点,每对引物中的1 条5' 端加入GC 夹, 使用 WinMelt TM 2.0 软件行溶解曲线分析以提 高突变检测分辨率;TPMT*3C(A719G): 上 游 5'-TGTTCTTTCTTATGATCCAA-3',下 游 5'-GC 夹-ATTACATTTTCAGGCTTTAG-3',片段长度 308 bp;TPMT* 1S:上游 5'-GC 夹-AGGACAAATATTGGCAAA-3',下 游 5'-GGAACATAAAATGGTGGA-3',片段长度 222 bp。PCR-1和2分别选用Ex taq 和 taq(大连 TaKaRa 公司),反应体系按说明 书配置,扩增在梯度 PCR 仪(德国 Biometra 公司) 上进行。 1.5 DGGE 筛查及 DNA 测序
采用 DCodeTM 突变检测电泳系统(美国 BioRad 公司)对巢式 DNA 片段行变性梯度凝胶电泳(denaturing gradient gel electrophoresis,DGGE)分离, 变性梯度范围 30%~60%。上样液为巢式 PCR 产物 及载样液(二甲苯青 FF+ 溴酚蓝,意大利 BBI 公司) 各 25 μL,缓冲液为 1×TAE,60 V 电压下电泳 6 h 后染色拍照并使用Image Lab™3.0 软件分析图像, 筛选异常电泳条带样本送 Invitrogen 公司测序。 1.6 统计学分析
采用 SPSS 17.0 统计软件对实验数据进行统 计学分析,基因频率采用百分率(%)表示, TPMT* 1S 各基因型与 6-MP 不良反应发生率比较及 在各临床危险度分型中的分布比较均采用行 × 列 表资料X2检验。P<0.05 为差异有统计学意义。 2 结果 2.1 临床治疗情况
46 例患儿中,至 2012 年 6 月共完成全疗程化 疗 37 例(80%),包括标危 20 例,中危 13 例, 高危 4 例;复发 7 例(15%),包括标危 2 例,高 危 5 例;失访 2 例(4%),分别发生在维持治疗 的第 183 天和第 247 天。ALL 维持治疗阶段,平 均每例患儿 6-MP 累计治疗时间为 747.2 d(163 ~ 985 d),其中 10 例(22%)因 6-MP 所致的严重 不良反应暂时停药,平均停药总天数为 7.9 d(2~ 22 d),每次停药后经 5.3 d(2~14 d)行升白细胞、 抗感染及保肝等治疗后可继续使用 6-MP 化疗。 2.2 6-MP 所致不良反应发生情况
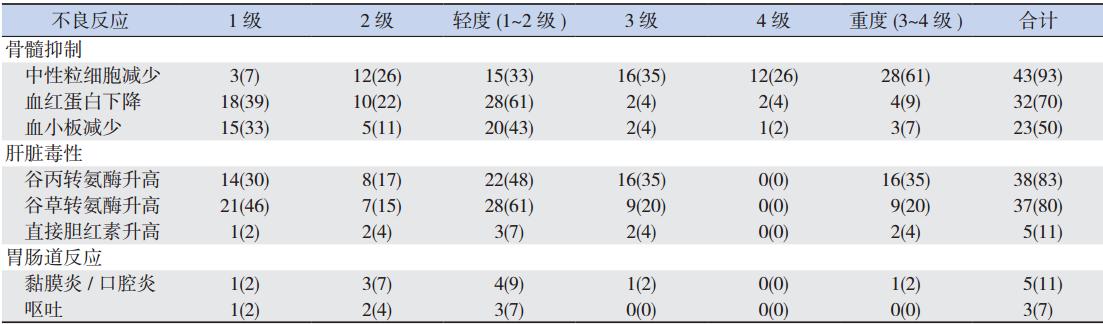
仅 3 例患儿(7%)对 6-MP 完全耐受,余 43 例患儿(93%)出现的不良反应主要包括:骨髓抑 制(中性粒细胞减少、血小板减少、血红蛋白降 低)、肝脏毒性(转氨酶升高、直接胆红素升高) 及胃肠道反应(黏膜炎 / 口腔炎、呕吐)。结果发 现中性粒细胞减少(93%)、血红蛋白降低(70%)、 血小板减少(50%)、谷丙转氨酶和谷草转氨酶升 高(分别为 83% 和 80%)是较为常见的不良反应, 其中,中性粒细胞减少(61%)在重度不良反应中 多见,余均以轻度不良反应为主,见表 1。
| 表1 46 例 ALL 患儿使用 6-MP 致不良反应分级情况 [n=46,例(%)] |
经巢式PCR扩增后的特异性DNA片段经 DGGE 电泳后均成功检测到异常条带,结合测序结 果,TPMT*3C(A719G,Try240Cys) 各 基 因 型 在 ALL 患儿中的分布频率为:AA 型 44 例(96%), AG 型 1 例(2%),GG 型 1 例(2%),G 位点等 位基因频率为 3%;TPMT*1S(T474C,Ile158Ile) 各基因型在 ALL 患儿中的分布频率为:TT 型 37 例(80%),TC 型 7 例(15%),CC 型 2 例(4%), C 位点等位基因频率为 12%(图1 ~2)。与标危组 相比,TPMT*1S 各基因型在中、高危组中的分布 差异均无统计学意义(分别X2=1.317、2.890,均 P>0.05)。
 |
图 1 TPMT*3C(A719G)与 TPMT*1S(T474C)DGGE 电泳图 1~2、6~8:AA 基因型;3:GG 基因型; 4~5:AG 基因型;9~10、13~14、16:TT 基因型;11:TC 基因型;12、15:CC 基因型。 |
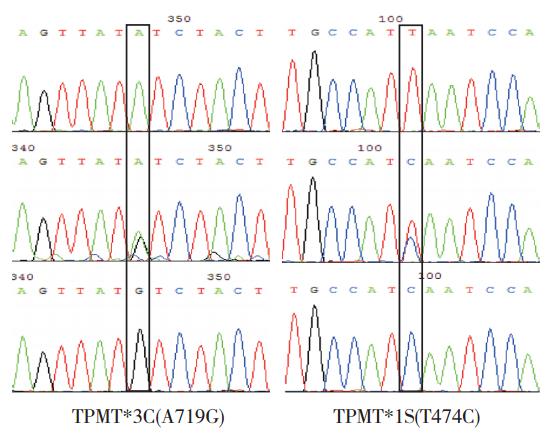 |
图 2 TPMT*3C(A719G) 与 TPMT*1S(T474C) 测序结果图 左图从上到下依次为: AA 基因型、AG 基因型 和 GG 基因型;右图从上到下依次为:TT 基因型、TC 基因型和 CC 基因型。方框代表突变型等位基因。 |
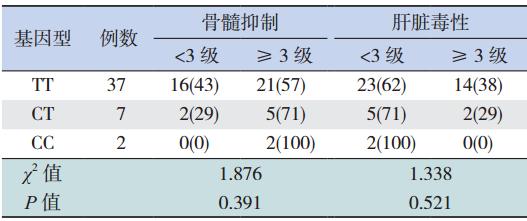
ALL 维持治疗期间,2 例(100%)TPMT*3C 突变基因型(AG+GG)患儿在化疗过程中均发生 以中性粒细胞减少为主的重度骨髓抑制,其中 1 例纯合突变者还出现重度肝脏毒性,经多次中断 化疗后调整 6-MP 用量至原剂量 1/3,维持化疗, 所有不良反应转为轻度。对最高级别评价指标进 行统计,无 TPMT*3C 突变患儿中,分别有 27 例 (61%)和 15 例(34%)出现重度骨髓抑制和肝 脏毒性,且不良反应在维持治疗期间均可发生, 与6-MP 使用无剂量相关性。此外,TPMT*1S 各基 因型与 6-MP 所致的重度骨髓抑制及肝脏毒性无明 显相关性(均P>0.05)(表 2)。出现胃肠道反应 的患儿例数较少且大部分为轻度,故未作分析。
| 表 2 ALL 患儿 TPMT*1S 基因型与 6-MP 所致不良反应 的关系 [n=46,例(%)] |
6-MP 是最早用于抗肿瘤治疗的嘌呤核苷类似 物,广泛用于儿童 ALL 在内的各种肿瘤疾病治疗。 该药治疗窗狭窄,治疗浓度和中毒浓度接近,对 靶细胞的选择性杀伤能力较弱,因此极易发生患 儿的不耐受现象。本研究回顾性分析了 46 例 ALL 患儿维持治疗期间的不良反应发生情况,结果显 示,除 2 例 ALL 患儿失访外,完成全疗程化疗及复发者分别为 37 例和 7 例,6-MP 所致不良反应 主要表现为骨髓抑制、肝脏毒性以及胃肠道反应, 仅极少部分患儿(7%)对6-MP 完全耐受。国外报道, ALL 维持治疗期间 85% 患儿至少曾经发生一次肝 脏毒性,这与本研究结果一致[6]。
回顾性分析发现,ALL 维持治疗阶段平均每 例患儿 6-MP 累计治疗时间 747.2 d(163~985 d), 此期间不良反应常见,但仅 22% 患儿中断 6-MP 化疗。国外报道 ALL 维持化疗 10 周以内有 24.2% 患儿中断 6-MP 化疗,但停药总时间(24.5 d)明 显长于本研究结果(7.9 d)[6],分析推测这种差异 可能因为化疗方案及人群体质特征不同而造成, 同时也和临床用药习惯有关。NCI CTC 3.0 作为化 疗药物不良反应常用的评价标准,广泛用于临床 肿瘤药物治疗的安全性监测[5, 6]。本研究中,中性 粒细胞减少(61%)以重度不良反应为主,可能导 致用药后的严重不良后果,或对生命构成潜在威 胁,故必要时应注意调整药物的使用剂量,积极 干预治疗甚至于中断化疗。
代谢酶基因多态性与药物安全性和疗效有关, 课题组前期已对部分 ALL 化疗药物毒副作用与基 因多态性的关系进行探讨并取得了一定成果[7]。 TPMT 不仅是巯嘌呤类药物的代谢关键酶,也是已 被确定具有基因多态性的最具特征性酶之一,其 基因型及等位基因频率分布具有种族差异性[8]。目 前已被命名的 TPMT 突变基因型共 30 多种(TPMT* 1S ~ *34) [9],本课题组在前期研究中发现中国汉族 儿童 TPMT 基因编码区仅存在 TPMT*3C 和 *1S 两 个 SNPs,其在健康儿童中的等位基因频率分别为 1.4%(3/222)和 22.5%(50/222) [2]。研究发现, 巯嘌呤类药物的活性代谢产物 6-TGNs 不仅是其发 挥治疗作用的重要因素,也可能是引起药物不良 反应而造成治疗中断或失败的主要原因[10] 。TPMT SNPs 是个体对巯嘌呤类药物耐受程度差异性的遗传基础,与 6-TGNs 浓度有关,可能成为研究该类 药物治疗个体化的关键。 有研究指出,TPMT 低活性患者服用常规剂量 的6-MP 后,不良反应发生率及治疗中断可能性升 高[1, 6, 10]。另一些研究却认为,TPMT 野生型不能减 少不良反应的发生[11],同时,出现不良反应的患 者中,仅极少部分存在 TPMT 基因突变[12],即对 部分患者而言,6-MP 不耐受与 TPMT 基因型或酶 活性可能无关。这种情况可能与个体合并感染、 同时服用多种药物及肝肾功能差异等影响药物代 谢的因素有关,因此在实际用药过程中还需综合 肝功能、白细胞或中性粒细胞计数等检查结果及 时调整 6-MP 的用药剂量。
本研究已筛查到的 2 例 TPMT*3C 基因型患儿 均出现严重不良反应,其中 1 例纯和突变患儿出 现明显的 6-MP 剂量相关性不耐受,考虑与该基因 型有关。本研究与国内谢茜等[13] 研究结果不同, 其原因可能与不良反应的观察时间长短有关,由 于 TPMT*3C 等位基因频率较低(3%),尚需要扩 大样本量进一步研究。TPMT*1S 为同义突变,近 年来认为编码区内的同义突变可导致密码子翻译 效率改变而影响蛋白质表达,因此也具有一定的 研究意义。马晓莉等[14] 认为,该基因型在人群中 的分布极高,但与 6-MP 的耐受性无关。本研究结 果未显示 TPMT*1S 各基因型与 6-MP 不良反应发生 有相关性,但鉴于 SNP 对药物代谢的影响可能同 时与等位基因的表达丰度有关,有关该基因型对 巯嘌呤药物的作用还有待进一步研究证实。
6-MP 药代动力学及药效动力学存在个体差 异,尽管许多化疗方案均提及需要根据外周血 WBC 计数及分类调整 6-MP 剂量,但这显然不是 确定药物用量的最佳方式。目前与 TPMT 基因多 态性相关的白血病药物治疗个体化研究一直受到 高度关注,而在用药前是否应该进行基因型或酶 活性的检测仍存在争议。最近研究发现,6-MP 等 巯嘌呤类药物在体内的代谢过程复杂,TPMT 野生 基因型患儿服用 6-MP 后出现的不良反应可能还受 巯嘌呤类药物代谢及叶酸代谢过程中的多个关键 酶影响[15] ,故 TPMT 基因多态性与 ALL 患儿 6-MP 耐受性的关系还有待多中心的协同研究,为 6-MP 的临床个体化用药提供可靠的实验依据。
| [1] | Hedeland RL, Hvidt K, Nersting J, et al. DNA incorporation of 6-thioguanine nucleotides during maintenance therapy of childhood acute lymphoblastic leukaemia and non-Hodgkin lymphoma[J]. Cancer Chemother Pharmacol, 2010, 66(3): 485-491. |
| [2] | 谢偲,岳丽杰,陈小文,等. 汉族TPMT基因全蛋白编码区SNP检测与分析[J]. 临床检验杂志, 2013, 31(9): 683-686. |
| [3] | 中华医学会儿科学会血液组, 中华儿科杂志编辑委员会. 儿童急性淋巴细胞白血病诊疗建议(第三次修订草案)[J]. 中华儿科杂志, 2006, 44(5): 392-395. |
| [4] | Luo XO, Ke ZY, Guan XQ, et al. The comparison of outcome and cost of three protocols for childhood non-high risk acute lymphoblastic leukemiain China[J]. Pediatr Blood Cancer, 2008, 51(2): 204-209. |
| [5] | Dorababu P, Nagesh N, Linga VG, et al. Epistatic interactions between thiopurine methyltransferase(TPMT) and inosine triphosphate pyrophosphatase (ITPA)[J]. Eur J Clin Pharmacol, 2012, 68(4): 379-387. |
| [6] | Adam de Beaumais T, Fakhoury M, Medard Y, et al. Determinants of mercaptopurine toxicity in paediatric acute lymphoblastic leukemia maintenance therapy[J]. Br J Clin Pharmacol, 2011, 71(4): 575-584. |
| [7] | 郑苗苗, 岳丽杰, 陈小文, 等. 急性淋巴细胞白血病患儿MTHFR基因多态性与大剂量甲氨蝶呤毒副反应的关系[J]. 中国当代儿科杂志, 2013, 15(3): 201-206. |
| [8] | Umamaheswaran G, Krishna Kumar D, Kayathiri D, et al. Inter and intra-ethnic differences in the distribution of the molecular variants of TPMT, UGT1A1 and MDR1 genes in the South Indian population[J]. Mol Biol Rep, 2012, 39(5): 6343-6351. |
| [9] | Appell ML, Berg J, Duley J, et al. Nomenclature for alleles of the thiopurine methyltransferase gene[J]. Pharmacogenet Genomics, 2013, 23(4): 242-248. |
| [10] | Hanai H, Iida T, Takeuchi K, et al. Thiopurine maintenance therapy for ulcerative colitis: the clinical significance of monitoring 6-thioguanine nucleotide[J]. Inflamm Bowel Dis, 2010, 16(8): 1376-1381. |
| [11] | Chisick L, Oleschuk C, Bernstein CN. The utility of thiopurine methyltransferase enzyme testing in inflammatory bowel disease[J]. Can J Gastroenterol, 2013, 27(1): 39-43. |
| [12] | Takatsu N, Matsui T, Murakami Y, et al. Adverse reactions to azathioprine cannot be predicted by thiopurine S-methyltransferase genotype in Japanese patients with inflammatory bowel disease[J]. J Gastroenterol Hepatol, 2009, 24(7): 1258-1264. |
| [13] | 谢茜, 肖剑文, 宪莹, 等. 巯嘌呤治疗儿童急性淋巴细胞白血病相关毒副作用及其与TPMT基因多态性关系的研究[J]. 重庆医科大学学报, 2011, 36(7): 777-781. |
| [14] | 马晓莉, 李伟京, 郑杰, 等. 严重不耐受巯嘌呤的急性淋巴细胞白血病患儿TPMT基因序列分析[J]. 中国实验血液学杂志, 2012, 20(4): 876-880. |
| [15] | Dorababu P, Naushad SM, Linga VG, et al. Genetic variants of thiopurine and folate metabolic pathways determine 6-MP-mediated hematological toxicity in childhood ALL[J]. Pharmacogenomics, 2012, 13(9): 1001-1008. |
 2014, Vol. 16
2014, Vol. 16