大部分支气管哮喘(哮喘)患儿经过规范吸 入糖皮质激素均能得到理想控制[1],但合并反复 呼 吸 道 感 染(recurrent respiratory tract infections, RRTIs)的哮喘患儿容易因为急性呼吸道感染而诱 发或加重哮喘症状,从而使哮喘长期停留在部分 控制或未控制状态。因此,哮喘合并 RRTIs 的患 儿除了进行规范化的哮喘治疗外,有效防治 RRTIs 也是哮喘治疗成功与否的关键之一。
RRTIs 是儿科一种常见的临床现象 [2],研究表 明反复呼吸道感染与人 β-防御素-1(hBD-1)、 免疫球蛋白水平有关[3, 4, 5, 6]。细菌溶解产物是 8 种细 菌的冻干溶解物,目前国内外研究证实其对 RRTIs 是有疗效的,但用药方案疗程仍未统一[7],而且 研究期限多数为 6 个月[8],对于 RRTIs 患儿观察 时间较短。本研究采用随机、双盲法将 2011 年 1~12 月在我院收治的 62 例哮喘合并 RRTIs 患儿分 成 2 组,在进行规范吸入糖皮质激素治疗的同时 给予细菌溶解产物或安慰剂后,观察两组患儿临 床疗效和治疗 6 个月后、12 个月后 hBD-1、IgA、 IgG、IgM 水平及可能出现的不良反应,探讨细菌 溶解产物治疗哮喘合并 RRTIs 的有效性、安全性 及其可能的原因。 1 资料与方法 1.1 研究对象及纳入排除标准
选取 2011 年 1~12 月在广州市越秀区儿童医 院呼吸科住院及门诊就诊的哮喘合并 RRTIs 患儿 为研究对象。
纳入标准:(1)年龄 1~12 岁。(2)所有 患儿均符合哮喘诊断标准[1] 且处于哮喘非急性 发作期,规范吸入糖皮质激素治疗至少 3 个月。 (3)符合 RRTIs 诊断标准[9] ,具体如下:RRTIs 指 1 年以内发生上、下呼吸道感染的次数频繁, 超出正常范围,其中,①反复上呼吸道感染次数 两次感染间隔时间至少 7 d 以上;②若上呼吸道感 染次数不够,可以将上、下呼吸道感染次数相加, 反之则不能。但若反复感染是以下呼吸道为主, 则应定义为反复下呼吸道感染;③确定次数须连 续观察 1 年;④反复肺炎指 1 年反复患肺炎≥ 2 次, 肺炎须由肺部体征和影像学证实,两次肺炎诊断 期间肺炎体征和影像学改变应完全消失。
排除标准:(1)对细菌溶解产物成分过敏者; (2)检测前 3 个月内接受过输血或免疫调节剂治 疗者;(3)正接受皮质激素或其他免疫抑制剂治 疗者;(4)患急性发热性疾病者;(5)不能整 粒吞服细菌溶解产物胶囊者。 1.2 实验分组
本研究采取随机、双盲、安慰剂对照试验。 药物由 1 名不参加临床观察的药师专职负责管理, 由该药师将细菌溶解产物(瑞士欧姆制药有限公司 OM PHARMA,进口药品注册证号:S20100063, 规格 3.5 mg/ 粒)及安慰剂分别按 6 盒一组予以电 脑随机编号。入选病例通过电脑随机编号后给予 相应编号的药物治疗。细菌溶解产物及安慰剂外 观、颜色及味道一致,参与临床观察的医师及患 儿均不知道所属治疗组别。入选病例试验观察期 间均继续进行规范的吸入糖皮质激素治疗。
入选总病例数 62 例,细菌溶解产物及安慰剂 组各 31 例。其中细菌溶解产物组男 11 例,女 20 例,年龄 4.5±0.7 岁;安慰剂组男 12 例,女 19 例, 年龄 4.5±0.6 岁。分别给予细菌溶解产物或安慰 剂治疗,药物用法参考 Gutierrez-Tarango 等 [10] 研究, 具体如下:试验开始后第 1~3 个月,第 7~9 个月, 每月前 10 d 服用,均为每日早晨空腹整粒胶囊吞 服,每日 1 次,其余时间停用。随访观察时间为 12 个月,试验开始后第 1~3 个月每 2 周复诊 1 次, 第4~6个月每4周复诊1次,第7~9个月每2周 复诊 1 次,第 10~12 个月每 4 周复诊 1 次。每次 复诊医生均要通过医院电脑信息系统查询试验期 间患儿因急性呼吸道感染而门诊就诊或住院的情 况;患儿家长需日常记录可能出现的不良反应并 在复诊时交复诊医生。本研究获医院伦理委员会 批准并获得家长书面知情同意。 1.3 血清制备
治疗前、治疗 6 个月、治疗 12 个月后均空 腹采集静脉血 5 mL,肝素抗凝,2 500 r/min 离心 5 min,分离出血清,置于 -20℃冰箱保存。 1.4 血清中各指标浓度测定
应用酶联免疫吸附法检测血清中hBD-1 浓度, 试剂盒选用美国 ADL 公司的 hBD-1 酶联免疫分析 试剂盒。应用免疫比浊法测定血清 IgA、IgG、IgM浓度,试剂盒选用上海复星长征医学科学有限公 司的 IgA、IgG、IgM 测定试剂盒。应用酶速率法 测定尿素(UREA)浓度,试剂盒选用北京科美生 物技术有限公司的 UREA 测定试剂盒。应用速率 法测定丙氨酸氨基转移酶(ALT)浓度,试剂盒选 用上海复星长征医学科学有限公司的 ALT 测定试 剂盒。 1.5 统计学分析
采用 SPSS 17.0 统计软件对数据进行统计学分 析,计量资料用均数±标准差(x±s)表示,两 样本均数比较应用t检验,多组样本均数比较应用 方差分析(F检 验 ),P<0.05 为差异有统计学意义。 2 结果 2.1 两组哮喘合并 RRTIs 患儿治疗前后呼吸道感 染次数比较
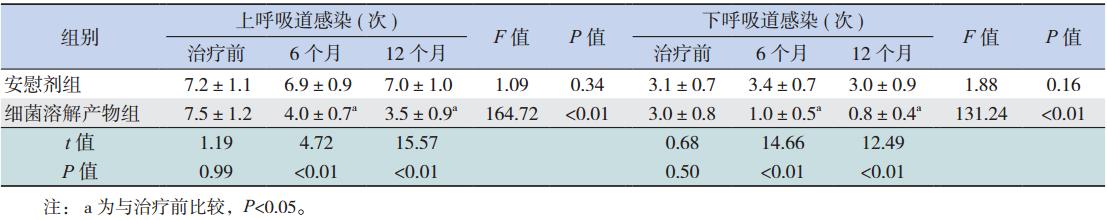
治疗前两组间呼吸道感染次数比较差异无统 计学意义(P>0.05)。治疗 6 个月和治疗 12 个月 后,与安慰剂组比较,细菌溶解产物组患儿的呼 吸道感染次数均减少(均P<0.05)。与治疗前比较, 细菌溶解产物组在治疗 6 个月和治疗 12 个月后呼 吸道感染次数均减少(均P<0.05);与治疗 6 个 月后比较,细菌溶解产物组在治疗 12 个月后呼吸 道感染次数差异无统计学意义(P>0.05)。而安慰 剂组在治疗前后呼吸道感染次数比较差异无统计 学意义(P>0.05)。见表 1。
| 表1 两组哮喘合并 RRTIs 患儿治疗 12 个月前后呼吸道感染次数比较 (n=31,x±s) |
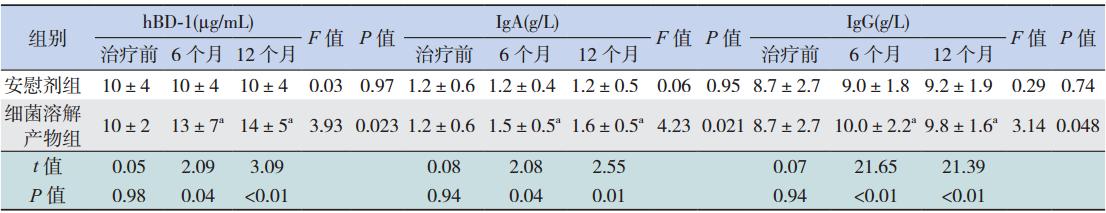
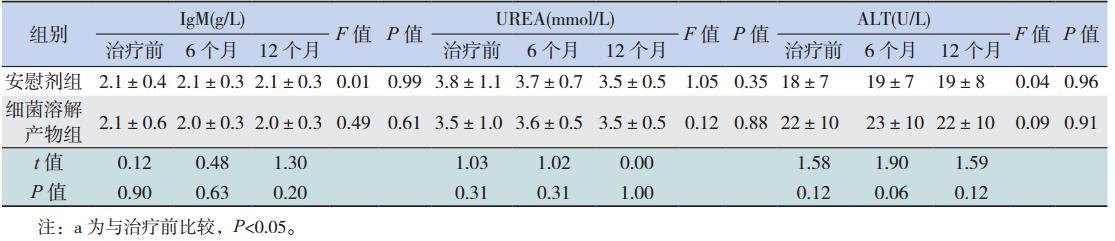
标浓度比较 两组患儿治疗前hBD-1、IgA、IgG、IgM、 UREA 和 ALT 浓度基础值比较差异均无统计学意 义(均P>0.05)。与安慰剂组比较,细菌溶解产 物组在治疗 6 个月和 12 个月后 hBD-1、IgA、IgG 浓度均有升高(均P<0.05),而 IgM、UREA 和 ALT 浓度差异均无统计学意义(均P>0.05)。 与治疗前比较,细菌溶解产物组在治疗6 个月和12 个月后hBD-1、IgA、IgG 浓度均升高 (均P<0.05);与治疗 6 个月后比较,细菌溶解 产物组在治疗12 个月后hBD-1、IgA、IgG 浓度 差异均无统计学意义(均P>0.05)。而细菌溶解 产物组 IgM、UREA 和 ALT 浓度及安慰剂组血清 各指标浓度在治疗前后差异均无统计学意义(均 P>0.05)。见表 2。
| 表 2 两组哮喘合并 RRTIs 治疗前后血清各指标浓度比较 (n=31,x±s) |
共有 3 例患儿出现临床不良反应事件,其中 细菌溶解产物组 2 例,腹痛 1 例,便秘 1 例;安 慰剂组 1 例,表现为腹痛。不良反应程度均较轻, 不需特殊处理,无 1 例患儿因不良反应而退出。 3 讨论
哮喘是儿童常见的慢性呼吸道疾病之一,儿 童又是 RRTIs 的高发人群,目前研究显示感染能 诱发或加重哮喘的发生和发展[11, 12, 13],RRTIs 与哮 喘病情的严重程度也密切相关[14, 15]。使用免疫调节 剂能否调节哮喘合并RRTIs 患儿的机体免疫功能, 从而预防 RRTIs 的发生,是目前临床上值得探讨 的问题。国外系统回顾分析研究显示,细菌溶解 产物能有效减少儿童 RRTIs 的次数[16]。本研究的 结果也显示,哮喘合并 RRTIs 患儿口服细菌溶解 产物能使治疗后 6 个月及 12 个月与治疗前比较, 呼吸道感染次数明显减少。
有关细菌溶解产物防治儿童 RRTIs 的作用机 制目前尚未完全明确。hBD-1 是机体的一类重要的 固有免疫分子,其不但在固有免疫中发挥着重要 的作用,在获得性免疫方面也可通过对树突状细 胞和 T 细胞的趋化发挥着更为重要的作用[17, 18]。 目前细菌溶解产物的药理学特性显示可以启动固 有免疫和提高获得性免疫应答[7]。本研究结果也显 示,服用细菌溶解产物后的 6 个月及 12 个月 hBD-1、IgA、IgG 浓度均升高,提示哮喘合并 RRTIs 患 儿的机体免疫功能有所提升,这或许是该类患儿 RRTIs 次数减少的机制之一。
国外也有使用细菌溶解产物不同于本研究疗 程的方案来辅助治疗儿童喘息的研究[19],每月连 服 10 d,仅连用 3 个月,观察 1 年后显示呼吸道 感染次数减少。本研究显示,药物治疗 12 个月后 hBD-1、IgA、IgG 和 IgM 浓度以及临床疗效与治疗 6 个月后比较差异均无统计学意义,是否说明 1 年 内无需服用 6 个月就可以达到减少呼吸道感染次 数的目的,今后将进一步研究细菌溶解产物使体 内 hBD-1、IgA、IgG 浓度升高维持的时间。
本研究结果显示,细菌溶解产物组不良反应发生率与安慰剂组比较无明显差异,用药前后患 儿肝功能、肾功能等生化指标均无明显变化。
综上所述,儿童哮喘合并 RRTIs 患儿在规律 吸入糖皮质激素的基础上,使用细菌溶解产物可 提高hBD-1、IgA、IgG 水平,从而提升机体免疫功能, 减少呼吸道感染的次数,具有有效性和安全性。
| [1] | Bhattacharyya M, Ghosh MK. Hemophagoctic lymphohistiocytosis-recent concept[J]. J Assoc Physicians India, 2008, 56: 453-457. |
| [2] | 闫丽娟, 王昭. 噬血细胞综合征继发凝血功能障碍的认识与研究[J]. 临床和实验医学杂志, 2012, 11(2): 142-143. |
| [3] | 肖莉, 宪莹, 戴碧涛, 等. HLH-2004方案治疗83例EB病毒相关噬血淋巴组织细胞增生症患儿疗效分析[J]. 中华血液学杂志, 2011, 32(10): 668-672. |
| [4] | 王华, 高文瑾, 刘安生, 等. 儿童噬血细胞综合征54例临床及预后因素分析[J]. 中国小儿血液与肿瘤杂志, 2013, 18(1): 31-34. |
| [5] | Tseng YT, Sheng WH, Lin BH, et al. Causes, clinical symptoms,and outcomes of infectious disease associated with hemophagocytic lymphohistiocytosis in Taiwanese adults[J]. Microbiol Immunol Infect, 2011, 44(3): 191-197. |
| [6] | Karapinar B, Yilmaz D, Balkan C. An unusual cause of multiple organ dysfunction syndrome in the pediatric intensive care unit : hemophagocytic lymphohistiocytosis[J]. Pediatr Crit Care Med, 2009, 10(3): 285-290. |
| [7] | 中华医学会儿科学分会血液学组. 噬血细胞性淋巴组织细胞增生症诊疗建议[J]. 中华儿科杂志, 2012, 50(11): 821-825. |
| [8] | 汤静燕, 李志光. 儿童肿瘤诊断与治疗学[M]. 北京: 人民军医出版社, 2011: 282-289. |
| [9] | Ansuini V, Donato R, Esposito S. Debate around infection-dependent hemophayocytic syndrome in paediatrics[J]. BMC Infection Diseases, 2013, 16(1): 13-15. |
| [10] | 孙雪辉, 郑文浩, 张文, 等. 自身免疫病合并噬血细胞综合征临床分析[J]. 中华内科杂志, 2010, 49(10): 836-840. |
| [11] | 王旖旎, 王昭, 吴林. 多中心72例噬血细胞综合征诊疗分析[J]. 中华血液学杂志, 2009, 30(12): 793-798. |
| [12] | 郭子雄, 钟敏泉, 翟琼香, 等. 小儿噬血细胞综合征合并多脏器功能不全临床特征研究[J].中华临床医师杂志, 2011, 5(8): 2374-2377. |
| [13] | Zhuang JL, Jiang QW, Xu Y, et al. Recombinant activated factor Ⅶ in hemophagocytic lymphohistiocytosis with disseminated intravascular coagulation[J]. Chin Med J(Engl), 2011, 124(19): 3189-3191. |
| [14] | Yamamoto M, Hori T, Hatakeyama N, et al. Use of recombinant thrombomodulin in disseminated intravascular cogulation complicated hemophagocytic lymphohistiocytosis[J]. Indian J Pediatr, 2014, 81(3): 288-291. |
| [15] | Janka GE. Hemophagocytic lymphohistiocytosis[J]. Blood Rev, 2007, 21(5): 245-253. |
| [16] | 李小琳, 刘玉玲, 付四毛. 儿童噬血细胞综合征32例临床分析[J]. 中国小儿急救医学, 2012, 9(1): 38-40. |
 2014, Vol. 16
2014, Vol. 16