虽然迷走神经刺激术、外科手术不断深入, 新型抗癫癎药不断问世并应用于临床,仍然有 20% ~30%癫癎患者的发作难以控制 [1],发展成难 治性癫癎。生酮饮食(ketogenic diet,KD)是一种 高脂肪、低碳水化合物和限制蛋白质的饮食,它 被发现对难治性癫癎病人有效[2]。经典的 KD 是脂 肪和蛋白质、碳水化合物比例为 4 : 1。该方法用于 治疗难治性癫癎已超过 90 年的历史,是治疗难治 性癫癎的有效方法之一。虽然 KD 抗癫癎的机制至 今还不完全明确,但是其有效性和安全性已得到了公认。 视频脑电图(V-EEG)是癫癎最有效的辅 助诊断工具,结合多种诱发方法,至少可在 80% 的癫癎患者中发现异常的过度放电[3],治疗前后脑 电图变化有助于判断 KD 治疗的效果。目前,国内 研究多集中于 KD 治疗对临床发作的疗效及不良反 应的评估,而对 KD 添加治疗对难治性癫癎患儿脑 电图及认知功能的影响研究较少,本研究旨在确 认 KD 治疗的临床疗效并观察对患儿脑电图及认知 功能的影响。 1 资料与方法 1.1 研究对象
2012 年 8 月至 2013 年 8 月在郑州大学第三附 属医院(河南省妇幼保健院)儿童康复科接受 KD (广州金酮公司提供健酮系列产品)添加治疗的 难治性癫癎患者。入组标准:(1)符合药物难治 性癫癎的诊断标准(ILAE 2010):先后正规使用 两种以上的一线抗癫癎药,单药或联合,且所用 抗癫癎药均已达到最大耐受剂量,疗程适当而疗 效不佳者;(2)年龄:6 个月至 6 岁;(3)发作 频繁(平均 1 月发作≥ 4 次);(4)既往(最近 12 周以内)未接受过 KD 治疗;(5)家属要求或 同意 KD 治疗并签署知情同意书。排除标准:患有 严重消化、心血管、呼吸、泌尿系统疾病、肝脏 疾病或代谢性疾病,不适合 KD 治疗者;剧烈呕吐; 发热或感染性疾病活动期;先天性免疫缺陷病及 有 KD 治疗禁忌证者。
经筛选共 20 名患儿陆续入组,并接受随访。 其中男 14 例,女 6 例,年龄 7~61 个月,中位年 龄 42.5 个月。KD 治疗前病程 7~60 个月,中位数 是 11.5 个月。癫癎发作类型包括痉挛、阵挛、强 直、强直阵挛、肌阵挛、典型失神和部分性发作 等。所有患儿均进行头颅影像学检查,无异常 7 例, 异常者 13 例,其中巨脑回畸形 1 例,灰质异位 1 例, 脑发育不良 6 例,颅内囊肿 1 例,皮层及皮层下 软化灶 4 例。20 例患儿经 Gesell 发育量表检查有 19 例精神运动发育迟缓。 1.2 KD 治疗
入院后 KD 治疗团队(由营养师、临床医生 及护士组成)对入组患儿家属进行 KD 治疗相关培 训,并完善相关检查:血、尿、粪三大常规;肝、 肾、心功能、血脂;心电图;24 h V-EEG;泌尿 系彩超;尿气相色谱质谱分析;Gesell 发育量表检 查。KD 治疗的前 3 个月,对原有抗癫癎药物的种 类和用量不作调整。适合 KD 治疗患儿均住院观察 7~10 d,KD 配制由营养师按照经典 KD 方案,脂 肪和蛋白质、碳水化合物比例为 4 : 1,热卡约为根 据患儿年龄及理想体重所需总热量的 80%,活动 量大的患儿可适当增加热卡。采取禁食 24~48 h, 监测血酮、血糖(每 6 h 由护士采患儿指尖血,用 血酮、血糖试纸测量 1 次),当血糖低于 2.1 mmol/L 时给予橙汁,当血酮达到 3 mmol/L 时可提前结束禁 食,开始 KD 治疗。KD 治疗期间记录癫癎发作类型、 发作次数及不良反应。血酮值稳定(3~4 mmo/L) 后出院。患儿家属记录癫癎日记,每天监测尿酮, 每周监测血酮 1 次,定时随访,并于 KD 治疗后 3、6、9 个月于我院复诊,复查肝肾功能、血脂、 24 h V-EEG、Gesell 发育量表检查。所有患儿均坚 持 KD 治疗不少于 3 个月。 1.3 疗效评估
(1)比较 KD 治疗前及 KD 治疗后 3、6、9 个月癫癎临床发作频率,参照 Engel 分级[4]:I 级 (完全控制):无发作;II 级(显著有效):发 作减少≥ 90% 但 <100%;III 级(有效):发作 减少≥ 50% 但 <90%;IV 级(无效):发作减少 <50%。总有效率为(完全控制 + 显著有效 + 有效) 除以病例总数乘以 100%。
(2)比较 KD 治疗前及 KD 治疗后 3、6、9 个月 24 h V-EEG 癫癎样波减少的程度,共 4 个等 级。a 级(完全控制):无癫癎样波;b 级(显著 有效):癫癎样波减少≥ 75%;c 级(有效):癫 癎样波减少≥ 50%;d 级(无效):癫癎样波减少 <50%。总有效率为(完全控制 + 显著有效 + 有效) 除以病例总数乘以 100%。
(3)进行认知功能的评定。比较 KD 治疗前 及治疗后 3、6、9 个月 Gesell 发育量表:总发育 商及适应性、大运动、精细动作、语言、个人 -社交五大能区发育商)。总发育商共 6 个等级: >85、76~85、55~75、40~54、25~39、< 25。 等 级 不变为认知功能无变化;提高一个等级为认知功 能改善;提高两个等级为显著改善;降低一个等 级为加重。分别对五大能区发育商 KD 治疗前、 KD 治疗后 3、6、9 个月两两比较,观察 KD 治疗主要改善能区。 1.4 统计学分析
数据采用 SPSS 17.0 统计软件进行统计学分 析。计数资料以例数(%)表示,计量资料以均数 ± 标准差(x±s)表示,多组间计量资料的比较 采用单因素方差分析,以 LSD-t法进行组间两两比 较,P<0.05 为差异有统计学意义。 2 结果
2.1 临床疗效
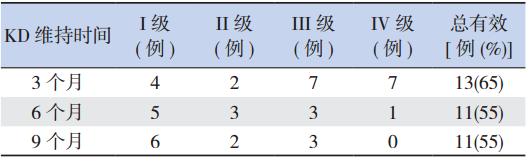
20 例 KD 添加治疗的难治性癫癎患儿中,KD 治疗维持 3、6、9 个月者分别为 20 例(100%)、 12 例(60%)、11 例(55%);KD 治疗后 3~6 个 月内 4 例临床无效停止(其中 2 人 EEG 改善), 3 例拒食停止治疗(其中 2 例临床有效),1 例死 亡。KD 治疗后 6~9 个月内 1 例无效,停止治疗。 KD治疗后不同时间癫癎患儿临床疗效情况见表1。
| 表1 KD 维持不同时间癫癎患儿临床疗效情况 (n=20) |
本研究 KD 治疗有效共 13 人,均于 KD 添加 治疗 4 周内起效,1 周内起效显著。KD 治疗 1、2、 3、4 周累积起效者分别为 6 例、10 例、12 例、13 例; 发作累积缓解率为 46%、77%、92%、100%。完 全控制发作者共 6 例,4 例于 KD 治疗 3 个月内发 作完全停止,其中 1 周内者 1 例。 2.3 KD 治疗不良反应
消化系统不良反应 6 例(恶心呕吐 1 例,腹 泻 2 例,便秘 3 例),上呼吸道感染 1 例,低血 糖 1 例,拒食 2 例。不良反应均较轻微,为一过性, 给予对症处理后缓解。 2.4 血生化指标的变化
血甘油三脂、胆固醇在 KD 治疗 3、6、9 个 月时较入组前有所增高,但均维持在正常范围, 无高脂血症发生。1 例出现低血糖,仅表现在开始 生酮饮食 1 周内。 2.5 24 h V-EEG 监测结果
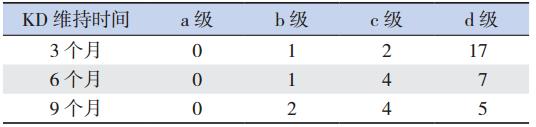
20 例癫癎患儿中,EEG 监测显示无一例癫癎 样波减少达 a 级(完全控制),EEG 改善共 8 人, 总有效率 40%。KD 治疗 3 个月时 3 例 EEG 改善, 其中1例b级,2例c级;KD治疗后3~6个月内 2例EEG改善(1例达b级,1例达c级),但临 床无效而停止 KD 治疗。KD 维持治疗 6 个月的 12 例患儿中,5例EEG改善,其中1例b级,4例c 级;KD 维持治疗 9 个月的 11 例患儿中 6 例有效, 其中2例b级,4例c级。见表2。
| 表 2 KD 维持不同时间对患儿 EEG 结果的影响 (例) |
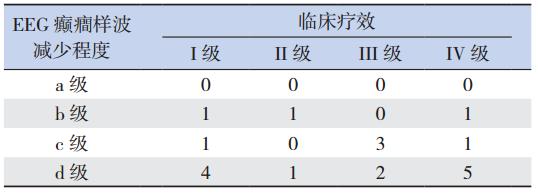
本研究整个治疗过程中,20 例患儿 EEG 癫癎 样波减少程度 b 级者共 3 例,其中临床疗效达 I 级、 II 级、IV 级者各 1 例;癫癎样波减少程度 c 级者 共 5 例,其中临床疗效达 I 级、II 级、III 级、IV 级者分别为 1 例、0 例、3 例、1 例;KD 治疗后 EEG 改善与临床疗效的关系见表 3。
| 表 3 KD 治疗后 EEG 改善与临床疗效的关系 (例) |
Gesell 发育量表评定总发育商比较结果:KD 治疗后提高一个等级共 6 人;无变化 14 人;加重 0 人。五大能区中精细动作、语言、个人 - 社交发 育商 KD 治疗前、KD 治疗后 3、6、9 个月多组间 比较差异无统计学意义(F值分别为 2.012、2.325、 1.832,均P>0.05);大运动、适应性能区发育商 KD 治疗前、KD 治疗后 3、6、9 个月多组间比较 差异有统计学意义(P<0.05),其中 KD 治疗后 9 个月大运动能区发育商显著高于 KD 治疗前及 KD 治疗 3 个月(P<0.05),适应性能区发育商亦显著 高于 KD 治疗前(P<0.05),见表 4。
| 表 4 KD 治疗前后大运动和适应性能区发育商的比较 (x±s) |
KD 疗法的有效性及安全性无论是在随机试 验、回顾总结还是前瞻研究都已得到证实,Neal 等[5] 随机对照试验支持 KD 在儿童难治性癫癎的有效 性,在该研究中 KD 治疗组中有 28 人发作减少超 过 50%,而对照组仅 4 人,KD 组中有 5 人发作减 少超过 90% 而对照组无一人。Keene[6] 对10篇KD 治疗的难治性癫癎患儿的文献资料进行分析,发 现患儿 KD 治疗维持 3 个月、6 个月、12 个月者 分别为 79.9%、60.6%、35.0%;分析共 26 项研究 927 例 KD 治疗的癫癎患者,发现治疗 6 个月后达 I 级和 II 级疗效者分别占 15.6%、33.0%。Freeman 等[7] 报道前瞻性观察 150 例病人 KD 治疗的效果, 1 年时,57% 病人仍然坚持治疗,7%(11 例)无 发作,27%(41 例)发作减少90% 以上,50%(75 例) 病人发作减少超过 50%。Sinha 等[8] 对 1925~1998 年的KD 治疗的文献进行Meta 分析,结果显示 癫癎发作减少≥ 90%者占总例数的 37%,另外 有 30%的患儿癫癎发作减少 50% ~90%。张秀萍 等[9] 对 23 例难治性癫癎患者 KD 添加治疗的研究 发现,16 例患者的发作得到了有效控制,总有效 率为 69.6%,发作完全缓解者占总例数的 9%,发 作减少 >90%的占 13%,发作减少 50% ~90%的 占 48%。卢忠英等[10] 研究 83 例难治性癫癎患儿 KD 维持治疗 3、6 个月者分别为 70.7%、57.1%。 本研究发现患儿 KD 治疗 3、6、9 个月总有效率分 别为 65%、55%、55%,基本与上述文献报道相接 近,完全控制发作分别为 20%、25%、30%,维持 治疗率分别为 100%、60%、55%,完全控制发作 率及维持治疗率较上述国内外文献报道稍高,可 能与本次研究样本量小、入组患儿病情重、患儿 家属依从性相对较好有关。
KD 治疗的疗效是逐渐出现的,多数需数天至 数周[11]。本研究中 KD 治疗起效时间最早 1 周内, 最迟 4 周内,结果与姬辛娜等[12] 研究报道 KD 起 效时间最早第 1 天,最迟第 15 天有出入,可能与 入组患儿病情轻重、入组患儿年龄段不同等有关, 但两次研究均证实 KD 治疗 1 周内起效显著。
KD 是模拟人体饥饿状态,从根本上改变了饮 食结构,患儿家长在关注疗效的同时,也担忧其 不良反应。文献报道在禁食及启动阶段,不良反 应多为胃肠道反应、感染率增加、嗜睡、便秘、 拒食等,长期不良反应多为高脂血症、肾结石、 氮质血症等,通过早期干预,多可缓解。操德智 等[13] 报道 KD 治疗不良反应最多见的为消化系统 症状,而高脂血症很少,这与研究对象年龄小、 胃肠道适应能力差有关。Suo 等[14] 研究报道 KD 添 加治疗儿童难治性癫癎常见不良反应包括拒食、 胃肠道功能紊乱、低蛋白血症等,通常第 1 周内 KD 开始出现的不良反应有呕吐、腹泻、便秘、胃 肠道功能紊乱。本研究中 KD 治疗的主要不良反应 为消化系统反应、感染、低血糖、拒食,与上述 文献报道短期内不良反应基本相符[13, 14],无长期 不良反应发生,可能与本研究入组患儿年龄小, 观察时间不长有关。本研究中 KD 治疗不良反应通 过早期干预都有效缓解。虽本研究中患儿血甘油 三酯及胆固醇基本都维持在正常范围,但血生化 指标仍需严密检测,以便能及时对症处理。综上 所述,本研究也证实了难治性癫癎儿童 KD 治疗安 全有效。
V-EEG可对患儿进行脑电图记录的同时录像, 能够长程地监测患者清醒期及自然睡眠周期状态 的脑电活动,捕捉发作期的脑电图同时可以从视 频中观测到临床发作表现。多项研究表明 KD 的 良好的电生理效应引起 EEG 的改善,其在脑部的 疗效与抗癫癎药相似,即便在临床疗效很差的患 者这种电生理效应也是存在的[15, 16, 17]。本研究中临床有效的与无效的患儿 EEG 癫癎样波都有减少现 象,与上述研究结果相符,临床有效患儿 EEG 改 善率为 46%(6/13),临床无效患儿 EEG 改善率 为 29%(2/7),EEG 总改善率为 40%(8/20), 临床有效者 EEG 改善率明显高于临床无效者,可 见临床疗效与 EEG 改善有一定相关性,可以作 为预测 KD 疗效的指标。Remahl 等[18] 研究比较 23 名癫癎患儿 KD 治疗前后 24 h EEG 数据,其中 65.2%(15/23)患儿 EEG 背景节律正常,发作间 期癫癎放电频率明显减少,本研究 EEG 改善率与 上述研究不符,可能与本研究入组病例发作类型 及设计比较指标的选择有关。
国外研究报道,KD 治疗的癫癎儿童机敏性和 认知功能都得到了提高,并矫正了癫癎儿童的异 常行为[19, 20]。Lambrechts 等[21] 对每一个被评估的 KD 治疗患儿进行了认知功能测试,研究结果显示 虽对认知功能改善程度太小没有达到统计学意义, 但大多数患儿在认知功能方面都有改善。本研究 初步尝试用 Gesell 发育量表评定认知功能,结果 总发育商提高一个等级共 6 人,总发育商改善明 显的患儿临床效果较好;五大能区发育商中,只 有大运动能区和适应性能区在 KD 治疗 9 个月时与 KD 治疗前和 KD 治疗 3 个月时差异有统计学意义, 这表明 KD 治疗短期内对认知功能影响主要在大运 动及适应性能区,整体上对认知功能影响不大, KD 治疗时间越长对认知功能影响越明显,也可能 与癫癎发作控制有一定关系。
本研究中 1 例患儿死亡,该患儿 KD 治疗 7 d 后出院,出院时癫癎发作无明显变化,一般情况可, 无咳嗽,出院 2 d 后出现咳嗽、咳痰,家属给予口 服自备中药(具体不详)治疗,数日后咳嗽加重, 伴较重喘息,未至医院治疗。该患儿死亡直接原 因考虑痰阻塞呼吸道,导致窒息死亡,与 KD 治疗 没有直接关系。
总之,KD 治疗儿童难治性癫癎安全有效,起 效迅速,不良反应少;EEG 改善与临床疗效有一 定相关性;对患儿认知功能有一定程度改善,并 随着 KD 治疗时间越长认知功能改善越明显,但本 研究存在观察例数少,随访时间短的缺陷。
| [1] | Kwan P, Brodie MJ. Definition of refractory epilepsy: defining the indefinable?[J]. Lancet Neurol, 2010, 9(1): 27-29. |
| [2] | Kossof EH, Zupec-Kania BA, Rho JM. Ketogenic diets: an update for child neurologists[J]. Child Neurol, 2009, 24(8): 979-988. |
| [3] | 刘晓燕. 临床脑电图学[M]. 北京:人民卫生出版社, 2006: 21-216. |
| [4] | Engel J Jr. Surgery for seizures[J]. N Engl J Med, 1996, 334(10): 647-652. |
| [5] | Neal EG, Chaffe H, Schwartz RH, et al. The ketogenic diet for the treatment of childhood epilepsy: a randomised controlled trial[J]. Lancet Neurol, 2008,7(6): 500-506. |
| [6] | Keene DL. A systematic review of the use of the ketogenic diet in childhood epilepsy[J]. Pediatr Neurol, 2006, 35(1): 1-5. |
| [7] | Freeman JM, Vining EP, Pillas DJ, et al. The efficacy of the ketogenic diet:a prospective evaluation of intervention in 150 children[J]. Pediatrics, 1998, 102(6): 1358-1363. |
| [8] | Sinha SR, Kossoff EH. The ketogenic diet[J]. Neurologist, 2005, 11(3): 161-170. |
| [9] | 张秀萍, 刘玉玺, 崔爱琴. 生酮饮食治疗难治性癫癎患者的临床观察[J].山西医药杂志, 2012, 41(9): 949-951. |
| [10] | 卢忠英, 郁莉斐,龚晓妍,等.儿童难治性癫癎生酮饮食治疗依从性与安全性分析[J].中国实用儿科杂志, 2013, 28(5): 378-381. |
| [11] | 廖建湘, 路新国, 操德智, 等. 生酮饮食疗法在癫癎治疗中的应用[J].中国当代儿科杂志, 2007, 5(9): 517-520. |
| [12] | 姬辛娜, 秦炯, 熊晖, 等. 生酮饮食治疗儿童难治性癫癎的前瞻性研究[J].实用儿科临床杂志, 2009, 24(11): 859-861. |
| [13] | 操德智, 路新国, 廖建湘, 等. 生酮饮食治疗难治性癫癎的初步观察[J].实用儿科临床杂志, 2007, 22(4): 288-330. |
| [14] | Suo C, Liao J, Lu X, et al. Efficacy and safety of the ketogenic diet in Chinese children[J]. Seizure, 2013, 22(3): 174-178. |
| [15] | Kessler SK, Gallagher PR, Shellhaas RA, et al. Early EEG improvement after ketogenic diet initiation[J]. Epilepsy Res, 2011, 94(1-2): 94-101. |
| [16] | Cantello R, Varrasi C, Tarletti R, et al. Ketogenic diet: electrophysiological effects on the normal human cortex[J]. Epilepsia, 2007, 48(9): 1756-1763. |
| [17] | Freeman JM, Vining EP, Kossoff EH, et al. SN: A blinded, crossover study of the efficacy of the ketogenic diet[J]. Epilepsia, 2009, 50(2): 322-325. |
| [18] | Remahl S, Dahlin MG, Amark PE. Influence of the ketogenic diet on 24-hour electroencephalogram in children with epilepsy[J]. Pediatr Neurol, 2008, 38(1): 38-43. |
| [19] | Nordli DR Jr, Kuroda MM, Carroll J, et al. Experience with the ketogenic diet in infants[J]. Pediatrics, 2001, 108(1): 129-133. |
| [20] | Pulsifer MB, Gordon JM, Brandt J, et al. Effects of ketogenic diet on development and behavior: preliminary report of a prospective study[J]. Dev Med Child Neurol, 2001, 43(5): 301-306. |
| [21] | Lambrechts DA, Bovens MJ, de la Parra NM, et al. Ketogenic diet effects on cognition, mood, and psychosocial adjustment in children[J]. Acta Neurol Scand, 2013, 127(2): 103-108. |
 2014, Vol. 16
2014, Vol. 16