新生儿坏死性小肠结肠炎(neonatal necrotizing enterocolitis,NEC)是新生儿期常见的严重胃肠道 疾病,多见于极低出生体重儿和早产儿,新生儿 重症监护病房(neonatal intensive care unit,NICU) 内胎龄小于33 周的早产儿NEC 的发病率为5.1%[1], 病死率为 15%~30%[2]。目前对于 NEC 的内科治疗 多是予禁食、胃肠减压、抗感染及支持治疗等, 尚缺乏有效的药物治疗,这也是 NEC 病死率高的 原因之一。白介素-11(interleukin-11,IL-11)与 细胞的生长、分化及凋亡有关,具有刺激造血、 抗细胞凋亡、抗炎和保护黏膜上皮等功能。以往 相关研究发现,应用 IL-11 能减轻多种原因造成 的肠道损伤,促进肠道再生修复[3, 4, 5, 6]。另外,在肠 道发生炎症性疾病时,IL-11 可下调促炎细胞因 子 如 TNF-α、IL-1β 和 IFN-γ的表达[7]。而重 组人白介素-11(recombinant human interleukin-11, rhIL-11)与天然 IL-11 在体内外的生物学活性无差 异。目前尚未见有关将 IL-11 应用于 NEC 防治的 报道。为此,本研究复制 NEC 的体外模型,采用 MTT 比色法、流式细胞术观察 rhIL-11 对脂多糖 (lipopolysaccharide,LPS)致新生大鼠空肠上皮细 胞系-6(intestinal epithelial cell-6,IEC-6)损伤是 否具有保护作用,为 NEC 防治提供新的思路。 1 材料与方法 1.1 实验材料
IEC-6细胞为美国标准生物品收藏中心 (ATCC)产品;高糖型 DMEM 购自北京钮因华信 科技发展有限公司;胎牛血清购自北京元亨圣马 生物技术研究所;胰蛋白酶(Mediatech 公司); 脂多糖、四甲基偶氮唑蓝(MTT)、二甲基亚砜 (DMSO)为 Sigma 公司产品;rhIL-11 由北京双鹭 药业股份有限公司提供;细胞凋亡检测试剂盒购 自北京宝赛公司;自动酶联检测仪(Bio-Rad 公司); FACS 流式细胞仪(美国 Becton-Dickinson 公司)。 1.2 细胞培养
IEC-6 细胞接种于含 10% 胎牛血清的高糖型 DMEM 内,并加入含 100 U/mL 的青霉素和链霉素, 置于 37℃、5%CO2培育箱中进行传代培养,取对 数生长期的细胞进行实验。 1.3 NEC 体外模型建立方法
参考文献[8, 9],并在文献基础上进行改进,予 LPS 处理 IEC-6 细胞建立 NEC 体外模型,LPS 的 最佳作用时间及最佳作用浓度通过预实验选取。 1.4 实验分组
LPS 处理组:待细胞贴壁后加入LPS 建立 NEC体外模型,但不施加rhIL-11;IL-11 治 疗 组:加入 LPS 建立模型后,再加入 100 ng/mL rhIL-11 [10];空白对照组:含等量细胞及培养液,不加入 LPS 及 rhIL-11,予等量生理盐水替代。 1.5 MTT 法检测 IEC-6 细胞增殖活力
收集对数生长期的细胞,调整细胞浓度为 5~8×104/mL;将 200 μL 的细胞悬液接种于 96 孔 板中,待细胞贴壁后,LPS 处理组和 IL-11 治疗组 内加入 LPS 建立 NEC 体外模型,LPS 作用一段时 间后,IL-11 治疗组加入 100 ng/mL rhIL-11 进行治 疗,空白对照组和 LPS 处理组加入等量生理盐水 替代,置于 37℃、5%CO2培育箱培育;各孔加入 200 μL MTT 溶液,置培养箱培养 4 h;吸去孔内 上清液终止培养;每孔加入 150 μL DMSO,振荡 10 min;用酶标仪在 570 nm 波长下测量各孔吸光 度值。 1.5.1 不同剂量 LPS 作用不同时间对 IEC-6 细胞 增殖活力的影响
通过预实验,选择 LPS 作用 的最佳浓度及最佳时间。依据 LPS 加入剂量,分 为 5、10、50、100 和 200 μg/mL 剂量组,以上不 同剂量LPS 分别作用于IEC-6 细胞 1、3、6、12 和 24 h,MTT 比色法检测比较空白对照组与不同 剂量 LPS 处理组细胞在不同时间点的增殖活力。 各组在不同时间点均取 10 个孔,实验重复 3 次。 1.5.2 rhIL-11 作用时间不同对 IEC-6 细胞增殖活 力的影响
确定LPS 作用的最佳浓度及时间后, IL-11 治疗组加入 100 ng/mL rhIL-11,分别作用 3、 6、9 和 12 h 后进行 MTT 检测,比较空白对照组、 LPS 处理组及 IL-11 治疗组细胞在不同时间点的增 殖活力。各组在不同时间点均取 20 个孔,实验重 复3次。 1.6 流式细胞术检测 IEC-6 细胞凋亡率
采用流式细胞术对各组 IEC-6 细胞凋亡率进 行检测,实验步骤参照试剂盒说明书进行,实验 重复 3 次。 1.7 统计学分析
采用 SPSS 19.0 统计软件对数据进行统计学分 析,计量资料采用均数 ± 标准差(x±s)表示, 多组间均数比较采用方差分析,组间两两比较采 用 SNK-q检验。P<0.05 为差异有统计学意义。 2 结果 2.1 LPS 剂量的选择
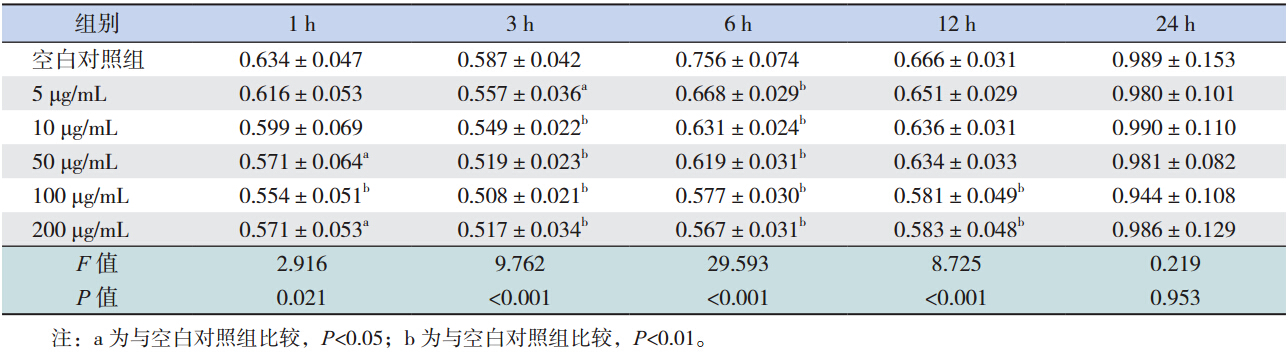
预 实 验 时,分 别 加 入 5、10、50、100 和 200 μg/mL LPS 作用 1 h 后,5 μg/mL 和 10 μg/mL 剂 量组 IEC-6 细胞增殖活力与空白对照组比较差异 无统计学意义(均P>0.05),其余剂量组增殖活 力均较空白对照组下降(均P<0.05);LPS 作用 3 h、6 h 后,各剂量组增殖活力均较空白对照组明 显降低(均P<0.05),尤以 6 h 时差异最为显著; LPS 作用 12 h 后,5、10 和 50 μg/mL 剂量组 IEC-6 细胞的增殖活力恢复,与空白对照组比较差异无 统计学意义,100 μg/mL、200 μg/mL 剂量组 IEC-6 细胞的增殖活力仍与空白对照组存在明显差异(均 P<0.05);而至 LPS 作用 24 h 时各剂量组 IEC-6 细胞的增殖活力均恢复(均P>0.05)。表明 LPS 可降低 IEC-6 细胞增殖活力,在一定剂量范围内, LPS 剂量越大,对 IEC-6 细胞的增殖活力影响越大, 恢复越慢。
由于该实验后继需加入 rhIL-11 进行治疗,因 此需要选择 LPS 发挥作用时间较长的剂量组,以 便于观察 rhIL-11 的作用,由表 1 结果可知,5、 10 和 50 μg/mL LPS 作用后 IEC-6 细胞增殖活力恢 复较快,LPS 发挥作用时间较短;而 100 μg/mL 及 200 μg/mL 剂量组 LPS 发挥作用时间较长,且两组 在各个时间点细胞的增殖活力无明显差异,因此 选择 100 μg/mL LPS 用于模型复制。
| 表 1不同剂量 LPS 对 IEC-6 细胞增殖活力的影响 (x±s) |
将 100 μg/mL LPS 作用于 IEC-6 细胞后,比较 空白对照组与 LPS 处理组(100 μg/mL)细胞的增 殖活力。在 LPS 作用 1 h 时,空白对照组细胞增 殖活力高于 LPS 处理组(P=0.003);而 LPS 作用 3 h、6 h 时,空白对照组细胞增殖活力亦高于 LPS 处理组(P<0.001)。由于 IEC-6 细胞自身增殖能 力强,且该实验后继需加入 rhIL-11,因此 LPS 作 用时间不宜过长,且综合考虑 1、3、6 h IEC-6细 胞增殖活力下降的程度,故选择 100 μg/mL LPS 作 用 3 h 建立体外模型。见表 1。 2.3 rhIL-11 对 LPS 致 IEC-6 细胞增殖活力改变 的影响
100 μg/mL LPS 作用 IEC-6 细胞 3 h 后,IL-11 治疗组加入 100 ng/mL rhIL-11 对 IEC-6 细胞进行治 疗,LPS 处理组和空白对照组未加入 rhIL-11,而 予等量生理盐水替代。在 rhIL-11 治疗 3 h 时,LPS 处理组、IL-11 治疗组细胞的增殖活力均明显低于 空白对照组(均P<0.01),而 LPS 处理组和 IL-11 治疗组之间增殖活力差异无统计学意义(P>0.05); 在 rhIL-11 治 疗 6 h 后,虽 然 LPS 处 理 组、IL-11 治疗组细胞的增殖活力仍低于空白对照组(均 P<0.01),但 IL-11 组增殖活力有增加的趋势;而 在 rhIL-11 治疗 9 h 后,IL-11 治疗组细胞的增殖 活力增加,与空白对照组比较差异无统计学意义 (P>0.05),而此时 LPS 处理组增殖活力仍明显 低于空白对照组和 IL-11 治疗组(均P<0.05);在 rhIL-11 加入 12 h 后,各组间 IEC-6 细胞的增殖活 力差异无统计学意义(P>0.05)。表明 rhIL-11 可 促进 LPS 损伤后的 IEC-6 细胞增殖,促进 IEC-6细 胞增殖活力的尽早恢复。见表 2。
| 表 2rhIL-11 对 IEC-6 细胞增殖活力的影响 (x±s) |
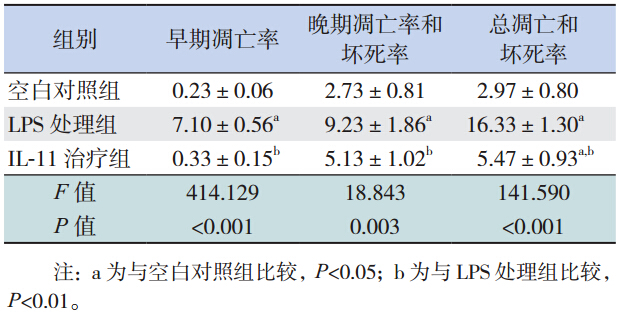
IL-11 治疗组在 100 ng/mL rhIL-11 施加 9 h 后, 其早期凋亡率、晚期凋亡率和坏死率与空白对照 组比较差异均无统计学意义(均P>0.05),却显 著低于 LPS 处理组(均P<0.05)。表明 100 μg/mL LPS 可明显增加 IEC-6 细胞的凋亡和坏死率,而给 予 rhIL-11 治疗可显著降低 IEC-6 细胞的凋亡和坏 死率,因此,rhIL-11 对 LPS 损伤后的 IEC-6 细胞 具有保护作用。见表 3。
| 表 3IL-11 治疗 9 h 后各组 IEC-6 细胞凋亡和坏死率比较(x±s,%) |
IL-11 是由骨髓基质细胞系分泌的一种多效能 的细胞因子[11] ,目前国内外有关 IL-11 在 NEC 中 的保护作用及其信号转导机制的研究甚少。国外 研究报道,IL-11 可减轻炎症性肠病的临床症状和 组织学病变[12] ;在急性 NEC 患儿中,IL-11 mRNA 水平上调,且 IL-11 mRNA 的表达水平与 NEC 的 严重程度呈负相关[13];在肠道缺血性坏死及再灌 注损伤时,予 IL-11 预处理后肠上皮细胞凋亡和坏 死明显减少,并可促进细胞增殖再生[14, 15] ;rhIL-11 可促进患有西 - 维氏瘘大鼠的肠上皮再生,减 轻肠道黏膜萎缩,并可减少短肠综合征的发生[16]。另外,国内研究发现小鼠受中子辐射损伤肠道后, 外源性应用 IL-11 可减轻辐射引起的肠道 IL-11 受 体下调,从而减轻损伤,促进肠道修复[17]。以上 研究结果均提示,IL-11 在肠道损伤时具有保护作 用。
目前多采用 LPS 建立 NEC 细胞模型[18],本实 验予不同浓度 LPS 作用于 IEC-6 细胞,MTT 结果 显示不同浓度 LPS 可在加入后 1 ~24 h 导致 IEC-6 细胞增殖活力降低,剂量越大,增殖活力降低越 明显,但 LPS 剂量超过 100 μg/mL 后,细胞增殖活 力未见明显改变。当予 100 μg/mL LPS 作用 IEC-6 细胞 3 h,LPS 处理组增殖活力明显降低,与空白 对照组存在差异;而 IL-11 治疗组加入 100 ng/mL rhIL-11 治疗 9 h 时,IL-11 治疗组增殖活力与空白 对照组无明显差异,但此时 LPS 处理组细胞增殖 活力仍低于空白对照组和 IL-11 治疗组。提示: rhIL-11 可促进 LPS 致 IEC-6 细胞损伤后增殖活力 恢复。另外,流式细胞术结果显示 100 ng/mL rhIL-11 治疗 9 h 时,LPS 处理组细胞的早期凋亡率及晚 期凋亡率和坏死率较空白对照组和 IL-11 治疗组均 明显增加,而 IL-11 治疗组与空白对照组比较无差 异;虽然 IL-11 治疗组细胞的总凋亡率和坏死率仍 较空白对照组高,但与 LPS 处理组相比,却明显 降低,提示 rhIL-11 可降低 LPS 致 IEC-6 细胞凋亡 和坏死率,在 NEC 时对肠上皮细胞发挥一定的保 护作用。
但值得指出的是,在 rhIL-11 作用 12 h 后, MTT 显示各组间增殖活力无差异,考虑 IEC-6细 胞为正常SD 大鼠空肠隐窝分离培养的上皮细胞系, 其增殖能力及自我修复能力强,且流式细胞术结 果提示 LPS 导致细胞凋亡主要在早期,故考虑原 因为:模型建立后,LPS 损伤较轻的 IEC-6 细胞在 后期迅速修复及增殖所致。
目前关于IL-11 对NEC 的保护机制尚不清楚。有研究报道 IL-11 可能通过下调 TNF-α等NEC发 病过程中重要的促炎细胞因子的表达,抑制盲肠 髓过氧化物酶的活性,而发挥抗炎作用[19]。另外, IL-11 可下调细胞凋亡蛋白酶的表达,而细胞凋亡 蛋白酶在细胞凋亡启动方面起着关键性的作用。 IL-11 在 NEC 发病过程中究竟如何发挥保护作用尚 待进一步的研究。
综上所述,本研究显示在 LPS 致 IEC-6 细胞 损伤时,rhIL-11 可通过促进细胞增殖、抑制其凋 亡的作用,减轻损伤,促进肠上皮细胞恢复正常, 从而为该病的治疗提供新的思路,对临床应用 rhIL-11 治疗 NEC 提供了一定的理论依据。
| [1] | Yee WH, Soraisham AS, Shah VS, et al. Incidence and timing of presentation of necrotizing enterocolitis in preterm infants[J]. Pediatrics, 2012, 129(2): 298-304. |
| [2] | Berman L, Moss RL. Necrotizing enterocolitis: an update[J]. Semin Fetal Neonatal Med, 2011, 16(3): 145-150. |
| [3] | Kuenzler KA, Pearson PY, Schwartz MZ. IL-11 pretreatment reduces cell death after intestinal ischemia-reperfusion[J]. J Surg Res, 2002, 108(2): 268-272. |
| [4] | Du X, Liu Q, Yang Z, et al. Protective effects of interleukin-11 in a murine model of ischemic bowel necrosis[J]. Am J Physiol, 1997, 272(3Pt 1): 545-552. |
| [5] | Fiore NF, Ledniczky G, Liu Q, et al. Comparison of interleukin-11 and epidermal growth factor on residual small intestine after massive small bowel resection[J]. J Pediatr Surg, 1998, 33(1): 24-29. |
| [6] | Dickinson EC, Tuncer R, Nadler EP, et al. Recombinant human interleukin-11 prevents mucosal atrophy and bowel shortening in the defunctionalized intestine[J]. J Pediatr Surg, 2000, 35(7): 1079-1083. |
| [7] | Peterson RL, Wang L, Albert L, et al. Molecular effects of recombinant human interleukin-11 in the HLA-B27 rat model of inflammatory bowel disease[J]. Lab Invest, 1998, 78(12): 1503-1512. |
| [8] | McElroy SJ, Hobbs S, Kallen M, et al. Transactivation of EGFR by LPS Induces COX-2 Expression in Enterocytes[J]. PLoS One, 2012, 7(5): 38373. |
| [9] | Richter JM, Schanbacher BL, Huang H, et al. LPS-binding protein enables intestinal epithelial restitution despite LPS exposure[J]. J Pediatr Gastroenterol Nutr, 2012, 54(5): 639-644. |
| [10] | 王瑞娟, 彭瑞云, 付凯飞, 等. rhIL-11 对中子辐射IEC-6 细胞IL-11RA和gp130 表达的影响[J]. 中华放射医学与防护杂志, 2006, 26(5): 438-441. |
| [11] | Schwertschlag US, Trepicchio WL, Dykstra KH, et al. Hematopoietic, immunomodulatory and epithelial effects of interleukin-11[J]. Leukemia, 1999, 13(9): 1307-1315. |
| [12] | Greenwood-Van Meerveld B, Tyler K, Keith JC Jr. Recombinant human interleukin-11 modulates ion transport and mucosal inflammation in the small intestine and colon[J]. Lab Invest, 2000, 80(8): 1269-1280. |
| [13] | Nadler EP, Stanford A, Zhang XR, et al. Intestinal cytokine gene expression in infants with acute necrotizing enterocolitis: interleukin-11 mRNA expression inversely correlates with extent of disease[J]. J Pediatr Surg, 2001, 36(8): 1122-1129. |
| [14] | Kuenzler KA, Pearson PY, Schwartz MZ. IL-11 pretreatment reduces cell death after intestinal ischemia-reperfusion[J]. J Surg Res, 2002, 108(2): 268-272. |
| [15] | Du X, Liu Q, Yang Z, et al. Protective effects of interleukin-11 in a murine model of ischemic bowel necrosis[J]. Am J Physiol, 1997, 272(3 Pt 1): 545-552. |
| [16] | Dickinson EC, Tuncer R, Nadler EP, et al. Recombinant human interleukin-11 prevents mucosal atrophy and bowel shortening in the defunctionalized intestine[J]. J Pediatr Surg, 2000, 35(7): 1079-1083. |
| [17] | 王瑞娟, 彭瑞云, 高亚兵, 等. IL-11对中子辐射小鼠肠道IL-11受体表达的影响[J]. 中国体视学与图像分析, 2006, 11(4): 258-262. |
| [18] | Mollen KP, Gribar SC, Anand RJ, et al. Increased expression and internalization of the endotoxin coreceptor CD14 in enterocytes occurs as an early event in the development of experimental necrotizing enterocolitis[J]. J Pediatr Surg, 2008, 43(6): 1175-1181. |
| [19] | Peterson RL, Wang L, Albert L, et al. Molecular effects of recombinant human interleukin-11 in the HLA-B27 rat model of inflammatory bowel disease[J]. Lab Invest, 1998, 78(12): 1503-1512. |
 2014, Vol. 16
2014, Vol. 16