2. 大连医科大学附属第一医院神经内科, 辽宁 大连 116011
目前,全世界各年龄组肥胖发病率急剧增加[1]。 导致肥胖的主要因素包括:久坐的生活方式、缺乏 锻炼、暴饮暴食及脂肪酸代谢紊乱等[2]。既往的研 究显示肥胖是高血压、糖尿病、心血管疾病及某 些肿瘤的独立危险因素,减轻体重可以减少上述 疾病的发生[3]。为了防治肥胖及其相关心血管疾病 危险因素(如内脏白色脂肪组织增多、血脂异常、 血清脂联素降低、高糖血症、高胰岛素血症、胰 岛素抵抗等),除控制饮食和增加运动外,药物 控制食欲和体重等方法曾一度被广泛追捧。然而 遗憾的是:限制能量摄入及改变生活方式往往难 以奏效且容易复发,而药物(如氟苯丙胺和右芬 氟拉明)治疗常常伴有瓣膜性心脏病等严重不良 反应[4]。因此,寻求安全、有效的防治策略迫在眉睫。
花 青 素(anthocyanidin) 是 广 泛 存 在 于 蔬 菜、水果中的天然色素,矢车菊素 -3- 葡萄糖苷 (cyanidin-3-glucoside,C3G)是其主要活性成分, 虽有研究显示其具有改善糖脂代谢紊乱及胰岛素 抵抗等作用[5, 6, 7],但疗效尚不确切,作用机制亦不 十分清楚。本研究通过构建肥胖大鼠模型,观察 C3G 对肥胖大鼠体重、内脏脂肪量、血脂及胰岛 素抵抗等的干预作用,为 C3G 应用于肥胖相关心 血管疾病危险因素的防治提供理论依据。 1 资料与方法 1.1 实验动物和饲料
3 周龄清洁级健康雄性Sprague-Dawley 大鼠 30 只,体重 50~60 g,购自大连医科大学动物实 验中心(动物许可证号 : SYXK 辽 20080002)。 基础饲料:总能量为 19 950 KJ/kg,含脂肪 15%, 碳水化合物 65%,蛋白质 20%,购自大连医科大 学动物实验中心;高脂饲料参照文献[8] 自制:总 能量为 27 930 KJ/kg,含脂肪 53%,碳水化合物 32.5%,蛋白质 14.5%。 1.2 主要药物、试剂及仪器
C3G( 纯 度 ≥ 99%) 购 自 芬 兰 Polyphenols AS 公司,高敏大鼠胰岛素放免分析药盒(美国 Millipore 公司,SIR-13K)购自北京福瑞生物工程 公司,血糖试剂盒购自日本和光纯药工业株式会 社,甘油三脂(TG)、总胆固醇(TC)试剂盒购 自北京九强生物技术股份有限公司,高密度脂蛋 白胆固醇(HDL-C)、低密度脂蛋白胆固醇(LDC-C) 试剂盒购自温州市维日康生物科技有限公司,大 鼠脂联素 ELISA 试剂盒购自上海西唐生物科技有 限公司。所用仪器包括全自动生化分析仪(日立 Hitachi7600-110)、 酶 标 仪(AWARENS Stat Fax-3200)、电子天平(OHAUS CP153)、电子秤(上 海舜宇恒平,JA12K-1)。 1.3 肥胖模型的制备及分组
大鼠适应性喂养 3 d,按随机数字表法随机 分为两组:对照组(n=8),给予普通饲料喂养; 高脂饮食组(n=22),给予高脂饲料喂养。两组 大鼠体重分别为 54.7±4.2、55.0±4.0 g,两组比 较差异无统计学意义(t=0.175,P=0.862)。连续 喂养 5 周后,高脂饮食组中体重超出对照组平均 体重 20% 的 17 只大鼠作为实验用肥胖大鼠[9]。 造模失败的大鼠予以剔除。肥胖大鼠在随机的 基础上略作调整,分为体重匹配的两组:肥胖组 (n=8)和 C3G 组(n=9),两组大鼠体重分别为 269.5±13.1、267.0±16.5 g,两组比较差异无统计 学意义(t=0.058,P=0.812)。各组大鼠在原有饮 食的基础上,C3G 组予以浓度为 10 mg/mL 的 C3G 生理盐水溶液灌胃,其余两组予以生理盐水灌胃, 灌胃剂量均为 1 mL/100 g 体重 [C3G 灌胃剂量相当 于 100 mg/(kg · d)];每天灌胃 1 次,连续灌胃 5 周。 实验期间,每周称量大鼠体重 1 次,准确记录大鼠 体重及摄食量。所有大鼠实验期间同室分笼(毎 笼 3~4 只)喂养,自由摄食及饮水,控制环境温度 (22±2)℃和湿度(55±10)%,明暗周期 12 h。 1.4 标本的收集
实验结束前,大鼠禁食12 h,不禁水,次 日电子称重(精确到1 g)后以10%水合氯醛 (0.35 mL/100 g 体重)腹腔麻醉后,肝门静脉采 血约 4 mL,3 000 r/min,离心 10 min,取上层血 清,-20℃保存待检。断颈处死大鼠,分离内脏脂 肪组织(包括附睾脂肪垫、肾周脂肪、肠系膜脂肪), 用滤纸吸干后电子天平(精确到 0.001 g)称重。 1.5 血清标本的检测
采用放免法检测空腹胰岛素(Fins),全自动 生化分析仪检测空腹血糖(FPG)及血脂,ELISA 检测血清脂联素。并计算胰岛素抵抗指数(IRI) 和 动 脉 硬 化 指 数(AI): IRI=[FPG(mmol/mL) ×Fins(mIU/L)] /22.5;AI=TC-HDL-C/HDL-C。 1.6 平均能量利用率的计算
平均能量利用率(feed efficiency ratio)=[ 体 重增量(g)/ 同期热能摄入量(kJ)] ×100%。 1.7 统计学分析
应用 SPSS 17.0 统计软件进行数据分析。计量 资料以均数 ± 标准差(x±s)表示,两组间均数 的比较采用独立样本t检验;多组组间均数的比较 采用单因素方差分析,组间两两比较采用 LSD 法。 P<0.05 表示差异有统计学意义。 2 结果 2.1 各组大鼠体重、内脏脂肪量、摄食量、能量 摄入及能量利用率的比较
肥胖组终末体重(实验第 10 周末)、体重增 量、内脏脂肪量及平均能量利用率明显高于对照 组(P<0.05),C3G 组上述指标明显低于肥胖组 (P<0.05),但仍高于对照组(P<0.05)。肥胖组 和 C3G 组干预前体重及能量摄入明显高于对照组 (P<0.05);肥胖组和 C3G 组间干预前体重及能 量摄入差异无统计学意义(P>0.05)。见表 1。各 组大鼠体重增长趋势见图 1 。
| 表 1各组大鼠体重、内脏脂肪量、摄食量、能量摄入及平均能量利用率的比较 (x±s) |
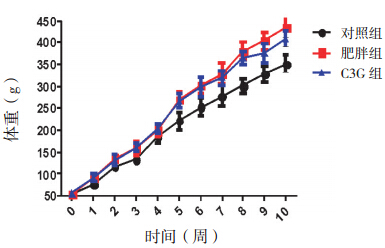 |
图 1 各组大鼠体重增长曲线 |
肥胖组血清 TC、TG、LDL-C 及 AI 明显高于对照组(P<0.05),C3G 组上述指标明显低于肥 胖组(P<0.05),但仍高于对照组(P<0.05);肥 胖组大鼠血清 HDL 明显低于对照组(P<0.05), C3G 组 HDL 明显升高(P<0.05)。C3G 组 HDL-C 与对照组相比,差异无统计学意义(P>0.05)。见 表 2。
| 表 2各组大鼠血脂指标及 AI 的比较(x±s) |
肥 胖 组 FPG、Fins 及 IRI 明 显 高 于 对 照 组 (P<0.05),C3G 组上述指标明显降低(P<0.05), 但仍高于对照组(P<0.05);肥胖组血清脂联素低 于对照组(P<0.05),C3G 组脂联素较肥胖组明显 增 高(P<0.05);C3G 组血清脂联素与对照组相比, 差异无统计学意义(P>0.05)。
| 表 3各组大鼠 FPG、Fins、IRI 及脂联素的比较(x±s) |
花青素是存在于高等植物中的天然黄酮类化 合物,广泛分布于蔬菜、水果及发酵的谷物中, 常应用于食品工业,具有抗炎、抗氧化、预防心 血管疾病等健康促进和疾病预防的功效[5, 6, 7, 10, 11, 12, 13, 14, 15, 16], C3G 是其主要活性成分。人体缺乏有效水解花青 素糖苷键的酶,饮食中的花青素不易通过消化道 吸收;饮食补充花青素具有良好的安全性[14, 17]。 因此,本研究参照Guo等[14] 和 Qin 等[15] 的研 究,饮食补充 C3G [100 mg/(kg · d)] 5 周,结果显示 明显减缓肥胖大鼠体重及内脏脂肪组织的增加。 C3G 降低肥胖大鼠体重可能通过下述作用实现: (1)增加能量消耗:本研究中肥胖组与 C3G 组摄 食量及能量摄入差异并无统计学意义,而 C3G 组 平均能量利用率明显低于肥胖组,提示 C3G 通过 增加肥胖大鼠能量消耗降低体重,而不影响其摄 食量及能量摄入;(2)降低脂肪量:通过抑制高 脂饮食诱导的脂肪细胞肥大,减少脂肪组织的增 加[14]。既往研究显示脂肪组织,尤其是内脏脂肪 与致动脉粥样硬化的脂质谱密切相关,是心血管 疾病的强独立危险因素[18]。C3G 减少内脏脂肪组 织堆积,间接说明其对心血管系统具有保护作用。
肥胖导致的血脂紊乱,尤其是 TC 和 TG 增高, 是心血管疾病的危险因素[19]。既往有关花青素降 低 TC 和 TG 的研究结果存有争议[5, 6, 7, 14]。本研究显 示 C3G 可以降低血清 TC 和 TG。血清 TC 的浓度 受多种因素的影响,包括肠道胆固醇的吸收、肝 脏胆固醇的合成、胆汁排泄及细胞利用[20] 。C3G 可能通过抑制胆固醇的合成降低血清胆固醇。既 往的研究显示花青素可以激活肝脏腺苷酸活化蛋 白激酶(AMPK),而 AMPK 抑制胆固醇合成的限速酶 - 羟甲基戊二酸单酰辅酶 A(HMG-CoA) 还原酶的活性[11, 13, 21]。因此,增强 AMPK 的活性 可抑制胆固醇的合成,导致胆固醇水平降低。此 外,AMPK 抑制乙酰辅酶 A 羧化酶(ACC)1 和 ACC2,增加脂肪酸的氧化、减少脂肪酸的合成, 进而降低 TG[10]。Guo 等[13] 将体外培养的 HepG2 细 胞经 C3G 处理后,AMPK 的活性增加导致 ACC 活 性降低,而脂肪酸氧化增强。由此推测,C3G 在 体内可能通过激活 AMPK 途径降低 TC 及 TG。
高脂饮食诱导的肥胖除伴有内脏脂肪组织增 加及血脂紊乱外,常常伴有不同程度的血糖、胰 岛素增高及胰岛素抵抗。本研究中肥胖组 FPG、 Fins 及 IRI 明显增高,但饮食补充 C3G 组上述指 标明显降低,说明 C3G 能有效改善肥胖相关高糖 血症、高胰岛素血症及胰岛素抵抗,与 Guo 等[13] 的研究结果一致。C3G 降低血糖及改善胰岛素抵 抗等的可能作用机制如下[11, 21]:饮食补充 C3G 激 活肝脏 AMPK,导致肝脏糖异生的两种限速酶 -磷酸烯醇式丙酮酸羧激酶(PEPCK)和葡萄糖 -6-磷酸酶(G6Pase)活性降低,抑制糖异生;同时 激活骨骼肌和白色脂肪组织 AMPK,增加葡萄糖转 运蛋白 4(GLUT4)的表达,增加细胞膜对葡萄糖 的摄取与利用;此外,肝脏 AMPK 激活减少胆固 醇及脂肪酸的合成、增加脂肪酸的氧化。上述共 同作用改善肥胖相关糖脂代谢紊乱及胰岛素抵抗。 而国内学者 Guo 等[14] 则认为,C3G 通过调节 c-Jun 氨基末端激酶(JNK)/ 叉头框转录因子 O1(FoxO1) 信号通路及其相关炎症因子改善肥胖导致的胰岛 素抵抗。C3G 增加胰岛素敏感性的具体机制尚需 在未来的研究中进一步证实。
脂联素是一种分子量为 30 kDa 的脂肪细胞因 子,其主要由脂肪组织分泌。既往研究显示血清脂 联素水平与体质指数、内脏脂肪量、血脂紊乱、胰 岛素抵抗等心血管疾病危险因素呈负相关关系,而 与 HDL 等心血管保护因素呈正相关关系[22]。肥胖 患者脂肪组织增加,以负反馈的形式导致血清脂联 素水平降低,而通过减少脂肪组织降低体重可增加 血清脂联素水平,改善肥胖相关代谢紊乱[21]。因此, 增加脂肪组织脂联素的表达可能是防治代谢紊乱 的有效方法。本研究发现 C3G 干预 5 周后,肥胖 大鼠血清脂联素水平恢复正常,胰岛素抵抗等心 血管疾病危险因素明显改善,提示 C3G 可能通过增加血清脂联素水平发挥防治肥胖相关心血管疾 病危险因素的作用。
本课题组前期研究表明高脂饮食诱导的肥胖 导致血清脂联素水平降低,使脂联素对 NF-kB 的 抑制减弱,导致肥胖大鼠血管内皮细胞粘附分子 (VCAM)-1、细胞间粘附分子(ICAM)-1 表达增加, 从而使动脉血管内皮增厚、血管结构发生改变, 导致血管疾病的发生[23]。在此基础上,本研究观 察了实验大鼠 AI 的变化。AI 是衡量动脉硬化的 程度的一个良好指标,其值越高越容易发生心脑 血管疾病。本研究中高脂饮食导致肥胖大鼠 AI 增 高,而 C3G 饮食干预使 AI 明显降低,提示 C3G 具有抗动脉硬化的作用,与既往研究结果一致[24]。 C3G 抗动脉硬化的一个可能机制为增加血清脂联 素的水平[14]。因为既往研究显示脂联素能够在损 伤的血管壁沉积,抑制巨噬细胞向泡沫细胞转变, 减少动脉内皮下脂质的沉积,促进血管舒张,加 速血流,进而发挥抗动脉粥样硬化的作用[21]。有 关 C3G 降低 AI 指数的具体机制尚需要在未来的研 究中进一步证实。
综上所述,C3G 可减缓肥胖大鼠体重及内脏 脂肪组织增加,改善肥胖相关糖脂代谢紊乱及胰 岛素抵抗,提示 C3G 可预防肥胖的发生,而对已 经肥胖者,C3G 可一定程度地改善肥胖,尤其是 明显改善肥胖相关糖脂代谢紊乱及胰岛素抵抗等 心血管疾病危险因素,但具体作用机制尚需进一 步研究。
| [1] | Selassie M, Sinha AC. The epidemiology and aetiology of obesity: a global challenge[J]. Best Pract Res Clin Anaesthesiol, 2011, 25(1): 1-9. |
| [2] | Karpe F, Dickmann JR, Frayn KN. Fatty acids, obesity, and insulin resistance: time for a reevaluation[J]. Diabetes, 2011, 60(10): 2441-2449. |
| [3] | Achike FI, To NH, Wang H, et al. Obesity, metabolic syndrome, adipocytes and vascular function: A holistic viewpoint[J]. Clin Exp Pharmacol Physiol, 2011, 38(1): 1-10. |
| [4] | Li MF, Cheung BM. Rise and fall of anti-obesity drugs[J]. World J Diabetes, 2011, 2(2): 19-23. |
| [5] | Basu A, Du M, Leyva MJ, et al. Blueberries decrease cardiovascular risk factors in obese men and women with metabolic syndrome[J]. J Nutr, 2010, 140(9): 1582-1587. |
| [6] | Karlsen A, Paur I, Bohn SK, et al. Bilberry juice modulates plasma concentration of NF-kappaB related inflammatory markers in subjects at increased risk of CVD[J]. Eur J Nutr, 2010, 49(6): 345-355. |
| [7] | Prior RL, Wu X, Gu L, et al. Purified berry anthocyanins but not whole berries normalize lipid parameters in mice fed an obesogenic high fat diet[J]. Mol Nutr Food Res, 2009, 53(11): 1406-1418. |
| [8] | 汤锦花,严海东.营养性肥胖大鼠模型的建立及评价[J].同济大学学报(医学版), 2010, 31(1): 32-34. |
| [9] | 高芳芳,刘戈力,郑荣秀,等.肥胖幼鼠脂肪组织vaspin与胰岛素敏感性的关系[J].中国当代儿科杂志, 2013, 15(1): 71-74. |
| [10] | Galvano F, La Fauci L, Vitaglione P, et al. Bioavailability, antioxidant and biological properties of the natural free-radical scavengers cyanidin and related glycosides[J]. Ann Ist Super Sanita, 2007, 43(4): 382-393. |
| [11] | Takikawa M, Inoue S, Horio F, et al. Dietary anthocyanin-rich bilberry extract ameliorates hyperglycemia and insulin sensitivity via activation of AMP-activated protein kinase in diabetic mice[J]. J Nutr, 2010, 140(3): 527-533. |
| [12] | Prior RL, E Wilkes S, R Rogers T, et al. Purified blueberry anthocyanins and blueberry juice alter development of obesity in mice fed an obesogenic high-fat diet[J]. J Agric Food Chem, 2010, 58(7): 3970-3976. |
| [13] | Guo H, Liu G, Zhong R, et al. Cyanidin-3-O-β-glucoside regulates fatty acid metabolism via an AMP-activated protein kinase-dependent signaling pathway in human HepG2 cells[J]. Lipids Health Dis, 2012, 11: 10-12. |
| [14] | Guo H, Xia M, Zou T, et al. Cyanidin 3-glucoside attenuates obesity-associated insulin resistance and hepatic steatosis in high-fat diet-fed and db/db mice via the transcription factor FoxO1[J]. J Nutr Biochem, 2012, 23(4): 349-360. |
| [15] | Qin Y, Xia M, Ma J, et al. Anthocyanin supplementation improves serum LDL- and HDL-cholesterol concentrations associated with the inhibition of cholesteryl ester transfer protein in dyslipidemic subjects[J]. Am J Clin Nutr, 2009, 90(3): 485-492. |
| [16] | Seymour EM, Lewis SK, Urcuyo-Llanes DE, et al. Regular tart cherry intake alters abdominal adiposity, adipose gene transcription, and inflammation in obesi-ty-prone rats fed a high fat diet[J]. J Med Food, 2009, 12(5): 935-942. |
| [17] | He J, Giusti MM. Anthocyanins: natural colorants with health-promoting properties[J]. Annu Rev Food Sci Technol, 2010, 1: 163-187. |
| [18] | Fox CS, Massaro JM, Hoffmann U, et al. Abdominal visceral and subcutaneous adipose tissue compartments: association with metabolic risk factors in the Framingham Heart Study[J]. Circulation, 2007, 116(1): 39-48. |
| [19] | Boullart AC, de Graaf J, Stalenhoef AF. Serum triglycerides and risk of cardiovascular disease[J]. Biochim Biophys Acta, 2012, 1821(5): 867-875. |
| [20] | Lecerf JM, de Lorgeril M. Dietary cholesterol: from physiology to cardiovascular risk[J]. Br J Nutr, 2011, 106(1): 6-14. |
| [21] | Towler MC, Hardie DG. AMP-activated protein kinase in metabolic control and insulin signaling[J]. Circ Res, 2007, 100(3): 328-341. |
| [22] | Brochu-Gaudreau K, Rehfeldt C, Blouin R, et al. Adiponectin action from head to toe[J]. Endocrine, 2010, 37(1): 11-32. |
| [23] | 韩同英, 马路一, 梁明华,等.肥胖大鼠血清脂联素水平与血管内皮NF-kB,VCAM-1, ICAM-1关系的研究[J].临床儿科杂志, 2011, 29(7): 674-677. |
| [24] | Mauray A, Felgines C, Morand C, et al. Bilberry anthocyanin-rich extract alters expression of genes related to atherosclerosis development in aorta of apo E-deficient mice[J]. Nutr Metab Cardiovasc Dis, 2012, 22(1): 72-80. |
 2014, Vol. 16
2014, Vol. 16