2. 首都医科大学附属北京儿童医院神经康复中心, 北京 100045;
3. 首都医科大学附属北京儿童医院消化中心, 北京 100045
病例 1:患儿,男,1 岁 20 d。主诉:生后反 复发热咳嗽,痰声明显,经常流黄鼻涕,有鼻窦 炎。运动及智力发育落后,现不能扶站,语言发 育落后,仅能发爸的单音。吃奶时间明显延长。 新生儿期有持续低钙血症伴抽搐,甲状旁腺素明 显减低,期间有明显肺炎。曾于 8 月龄于我院神 经康复门诊就诊,用比较基因组杂交芯片(arrayCGH)方法检测到 22 号染色体长臂有微缺失,缺 失位点 22q11.21,24055918~27026553 区域有缺失, 大 小 为 2 970 636 bp,该 区 域 的 缺 失 与 DiGeorge 综合征有关。体查:坐位后倾,不能扶站;耳位 低,小耳廓;高腭弓,无腭裂;其他未发现明显 异常。心脏彩超示卵圆孔未闭。辅助检查:血甲 状 旁 腺 素 8 pg/mL(10~88 pg/mL); IgG 5.41 g/L (7~16.0 g/L),IgA 0.24 g/L,IgM 0.39 g/L(0.1~ 0.3 g/L),IgE 64.27 IU/mL( ≤ 29 IU/mL);CD3 62.3%(55.0%~82.0%),CD4 40.3%(55.0%~57.0%), CD8 20.1%(9.0%~23.0%),B 13.9%(11.0%~45.0%), NK 14.3%(7.0%~40.0%)(新生儿期)。智测 83 分(8 月龄)。用荧光原位杂交(FISH)方法检测 到 22q11.2 区域缺失,所用探针为 LSI TUPLE1, 明确诊断为经典微缺失所致的部分性 DiGeorge 综 合征,见图 1。
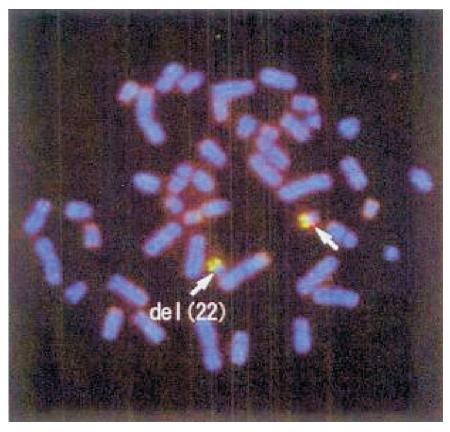 |
图 1 病例 1 FISH 方法检测结果 箭头所示为 22q11.2经典微缺失。 |
病例 2:患儿,男,2 月 19 d。主诉:间断咳 嗽发热 1 个月。现病史:初为单声咳嗽,有痰声, 鼻塞,吃奶后咳嗽加重,入睡后有鼾音。按感冒 治疗无好转。半月前咳嗽加重,阵发性咳嗽,鼻 塞加重,饮水呛咳明显,有面色青紫和口唇发绀 情况,低热 37.4℃,口服头孢类抗生素,效果不 明显。4 d 前体温升至 38℃,胸片示双中上肺野可 见斑片状高密度影;血常规示 WBC 13.67×109/L, N 50.7%,L 37.9%,Hb 98 g/L,PLT 59×109/L, CRP 4 mg/L。来我院急诊查心脏彩超示卵圆孔未闭; 静脉滴注头孢孟多 3 d,体温正常,仍有间断咳嗽, 饮水呛咳。患儿自发病以来精神弱,奶量减少,尿 少,大便每日 1 次,体重增长缓慢。既往史:新生 儿期听力筛查未通过。生后即出现进奶呛咳,生后 50 d 发现有软腭裂。体查:体温36.7℃,体重3.6 kg, 脉搏 130 bpm,呼吸 32 bpm,血压 80/50 mm Hg。 精神好,生长发育正常,呼吸平稳,无异常面 容。左上臂卡疤阳性,头顶可见2 cm×3 cm 色 素沉着,软腭缺损,未见悬雍垂,心、肺、腹体 查 均 未 见 异 常。 辅 助 检 查:WBC 8.97×109/L, N 4.22×109/L,L 3.46×109/L,Hb 96 g/L,PLT 92×109 /L;碱性磷酸酶 413.5 U/L(20~220 U/L), 谷草转氨酶 155.8 U/L(5~40 U/L),谷丙转氨酶 239.9 U/L(5~40 U/L),谷 氨 酰 转 肽 酶 66.3 U/L (5~50 U/L),总胆汁酸18.70 μmol/L(0~10 μmol/L), 甘 油 三 脂 3.04 mmol/L(0.4~1.7 mmol/L),肌 酸 激酶同工酶 32.6 U/L(0~25 U/L);甲状旁腺素 正 常;IgG 8.72 g/L,IgA 0.47 g/L,IgM 0.85 g/L, IgE 18.00 IU/mL;CD3 48.8%,CD4 18.6%,CD8 29%,B 13%,NK 39.9%。骨髓涂片示巨核细胞少见, 血小板少见。肺 CT 示两肺可见斑片状、条索状高 密度影,背侧为主,胸腺影缩小。腹部超声示肝 肋下1.9 cm,乙状结肠肠壁轻度水肿。尿筛查(-)。 血串联质谱(-)。用 FISH 方法检测到 22q11.2 区域典型微缺失,所用探针为 LSI TUPLE1,见图 2。
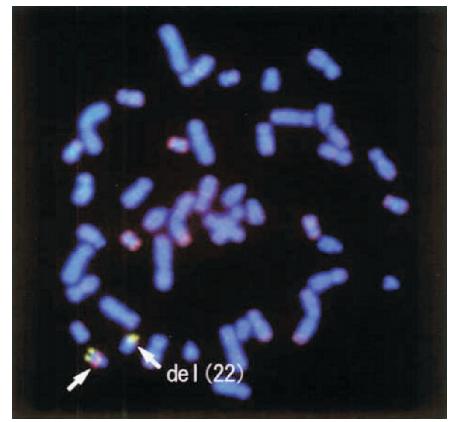 |
图 2 病例 2 FISH 方法检测结果 箭头所示为 22q11.2经典微缺失。 |
讨论:DiGeorge 综合征发病率为 1/4 000,是 最常见的染色体缺失综合征。其最初的三联征包 括先天性无胸腺、甲状旁腺缺如及心脏异常。基 于此,临床诊断标准[1] 为符合下述 4 项中的 3 项: 先天性心脏病,特征面容,甲状旁腺素低或新生 儿低钙,缺失的或不正常的胸腺或 T 细胞缺陷。 90% 患者有 22q11.2 区域经典的 3 Mb 的微缺失, 累及 30~50 个基因,另外 8% 为 1.5 Mb 的缺失[2], 不典型缺失病例亦散见报道[3]。随着 DiGeorge 综 合征患者数量的积累,医学界对该病的疾病谱的 认识也逐渐加深。心脏缺陷、语言延迟和免疫缺 陷是 DiGeorge 综合征患者最常见特征;同时可伴 有异常面容如小下颌、低耳位和耳廓异常;腭咽 功能不全伴或不伴黏膜下或明显腭裂可导致喂养 困难和鼻音;常见轻到中度学习障碍伴发育迟缓; 行为和精神异常亦可见。其他非典型特征包括眼 部、泌尿生殖道、内分泌、血管和肌肉骨骼异常。 自身免疫性疾病出现率增加。临床表型变异大, 具有相同突变的同卵双生子临床表型亦不同,提 示非遗传因素影响临床表型[4, 5]。
DiGeorge 综合征最初的临床诊断标准过于严 格,因为随着分子机制的发现,越来越多非典型 病例被报道。一项完全性 DiGeorge 综合征大样本 研究显示近一半的患者无心脏缺陷[6],又由于该病 的高发生率,提示只要有所怀疑就应详细检查。 由于是 3 Mb 的染色体微缺失,用常规染色体核型 分析方法无法分辨,即便是高分辨率的 G 显带也 无法诊断,FISH 方法是诊断的金标准。由于探针 设计大小为 100 kb,与靶基因特异结合,敏感性 和特异性均极高。近些年,array-CGH 方法逐渐在 国内应用于临床,该方法可同时筛查全基因组热 点缺失或重复序列,但还需 FISH 来证实。本文 例 1 新生儿期有甲状旁腺素低和低钙惊厥,有特 征面容,无先天性心脏病;随年龄增长,渐出现 反复呼吸道感染,吃奶时间延长,运动、智力及 语言发育落后,8 月龄时用 array-CGH 方法检测到 22q11.2 区域缺失,1 岁 20 d 时用 FISH 方法明确 诊断。例 2 生后即呛奶,50 d 时发现软腭裂;2.5 月龄时因肺炎就诊,吃奶时间延长,淋巴细胞计 数偏低,经 FISH 检测明确诊断。
在诊断 DiGeorge 综合征的基础上,需要分析 免疫表型。完全性 DiGeorge 综合征是指无胸腺的 DiGeorge 综合征,典型者表现为严重或完全 T 淋 巴细胞减少,特征为 SCID 表型,是广泛认知的与 DiGeorge 综合征相关的免疫缺陷,但极其少见, 占 DiGeorge 综合征病人的 1.5%。出生后严重 T 淋 巴细胞减少(CD3+ T<50/mm3),B 细胞和 NK 细胞 正常;针对丝裂原的增殖反应缺失或极度减低; IgG、IgA 和 IgM 减低(尽管生后数周内母体残留 影响 IgG)[7]。因两例患儿均无明显淋巴细胞减少, 故可除外完全性 DiGeorge 综合征。 在生后某段时间,完全性 DiGeorge 综合征婴 儿会出现寡克隆 T 细胞群,与皮疹和淋巴结肿大 相关,被称为不典型完全性 DiGeorge 综合征。T 细胞数可以是低的,正常的和高的。针对丝裂原 的淋巴细胞增殖反应可以是低的和正常的[8, 9, 10]。 典型与不典型的完全性 DiGeorge 综合征预后均危 重,二者鉴别关乎胸腺移植,不典型者易于排斥 移植的胸腺。无胸腺的诊断基于循环中胸腺新近 输出细胞数量的明显受抑制。由于胸腺可位于其他位置或体积很小,不能仅凭外科手术观察、放 射线或 CT 来诊断无胸腺。纯真 T 细胞比例明显 降 低(CD45RA+CD62L+T<50/mm3,<5% CD3+T; TRECs<100/100 000 T 细 胞) 代 表 无 胸 腺。 由 于 缺乏相应实验室技术,本文两例患儿未行此项检 查,为欠缺处,根据临床表现考虑不典型完全性 DiGeorge 综合征可能性小。还要与完全性 DiGeorge 综合征患儿母体 T 淋巴细胞经胎盘输注鉴别。本 文例 1 用细胞遗传学方法分析了 40 个核型的性染 色体,仅发现 XY,因此基本可除外母体 T 淋巴细 胞经胎盘输注的可能。例 2 尚未行此项检查。完 全性 DiGeorge 综合征患儿需立即转移至专业免疫 中心行进一步评估和治疗[6]。
部分性 DiGeorge 综合征更常见,免疫特征为 部分联合免疫缺陷病,临床表现为反复上呼吸道 感染,下呼吸道感染少见。6 月龄后出现荚膜菌引 起的反复窦肺感染。经常有轻到中度抗体受损伴 T 淋巴细胞减少,婴儿期明显。TCRVB 谱异常,表 现为增加,减少或寡克隆性。抗体缺陷谱广泛, 孤立的低 IgM 可能与反复感染有关,可有特异的 IgM 反应缺乏伴同族血凝素滴度减低。低 IgG 伴亚 类缺陷亦有报道。针对多糖抗体反应缺陷较常见, 同时 IgG 水平正常。缺乏的,低的或升高的 IgA 可 能与反复感染和自身免疫有关。很多患者最初低 的免疫球蛋白会随年龄增长变为正常。一些患者, B 淋巴细胞减少是一特征,尤其婴儿期,随时间 恢复正常[5, 11]。本文病例 1 有明确反复窦肺感染, 抗生素治疗有效,后用胸腺肽治疗有显效。病例 2 由于日龄小,仅表现本次肺炎迁延。两者血免疫 球蛋白均未见明显异常,由于缺乏实验室技术支 持,未能进一步行详细抗体功能检测。
部分性DiGeorge 综合征主要是对症治疗, 随着年龄增长病情会减轻。细菌性窦肺感染需及 时治疗。可能需要预防性抗生素,尤其冬季, 有的患者可能需常年预防。伴有症状性低丙种球 蛋白患者或预防效果不好的患者,可能需要丙种 球蛋白替代治疗。活疫苗通常是安全的,建议 CD4+T<400/μL 时避免接种活疫苗,由于保护性抗 体水平维持时间短,应定期监测抗体水平,必要 时重复接种疫苗[5]。
可见即便在不完全符合临床诊断标准的前提下,亦应考虑到 DiGeorge 综合征的可能。FISH 方 法是诊断的金标准。对于无明显淋巴细胞减少患 者,应考虑非典型完全性或完全性 DiGeorge 综合 征母体 T 淋巴细胞经胎盘输注的可能性,应行胸 腺输出功能及患儿体内母体 T 淋巴细胞检测。部 分性 DiGeorge 综合征应详细评价体液免疫功能, 主要为对症治疗。小婴儿的喂养困难,年长儿的 语言延迟,智力运动发育落后等问题需积极解决 来提高生存质量。
| [1] | Kornfeld SJ, Zeffren B, Christodoulou CS, et al. DiGeorge anomaly: A comparative study of the clinical and immunologic characteristics of patients positive and negative by fluorescence in situ hybridization[J]. J Allergy Clin Immunol, 2000, 105(5): 983-987. |
| [2] | Emanuel BS. Molecular mechanisms and diagnosis of chromosome 22Q11.2 rearrangements[J]. Dev Disabil Res Rev, 2008, 14(1): 11-18. |
| [3] | Amati F, Conti E, Novelli A, et al. Atypical deletions suggest five 22q 11.2 critical regions related to the DiGeorge/velo-cardio-facial syndrome[J]. Eur J Hum Genet, 1999, 7(8): 903-909. |
| [4] | Ryan AK, Goodship JA, Wilson DI, et al. Spectrum of clinical features associated with interstitial chromosome 22q11 deletions: a European collaborative study[J]. J Med Genet, 1997, 34(10): 798-804. |
| [5] | Gennery AR. Immunological aspects of 22q11.2 deletion syndrome[J]. Cell Mol Life Sci, 2012, 69(1): 17-27. |
| [6] | Markert ML, Devlin BH, Alexieff MJ, et al. Review of 54 patients with complete Digeorge anomaly enrolled in protocols for thymus transplantation: outcome of 44 consecutive transplants[J]. Blood, 2007, 109(10): 4539-4547. |
| [7] | Markert ML, Hummell DS, Rosenblatt HM, et al. Complete DiGeorge syndrome: persistence of profound immunodeficiency[J]. J Pediatr, 1998, 132(1): 15-21. |
| [8] | Vu QV, Wada T, Toma T, et al. Clinical and immunophenotypic features of atypical complete DiGeorge syndrome[J]. Pediatr Int, 2013, 55(1): 2-6. |
| [9] | Markert ML, Alexieff MJ, Li J, et al. Complete DiGeorge syndrome: development of rash, lymphadenopathy, and oligoclonal T cells in 5 cases[J]. J Allergy Clin Immunol, 2004, 113(4): 734-741. |
| [10] | Selim MA, Markert ML, Burchette JL, et al. The cutaneous manifestations of atypical complete DiGeorge syndrome: a histopathologic and immunohistochemical study[J]. J Cutan Pathol, 2008, 35(4): 380-385. |
| [11] | McLean-Tooke A, Spickett GP, Gennery AR. Immunodeficiency and autoimmunity in 22q11.2 deletion syndrome[J]. Scand J Immunol, 2007, 66(1): 1-7. |
 2014, Vol. 16
2014, Vol. 16
