新生儿重症监护病房(neonatal intensive care unit,NICU)中由于抗生素的广泛使用存在许多耐 药微生物。其中产超广谱β 内酰胺酶(extendedspectrum beta-lactamase,ESBL)的细菌是NICU 中 最常见耐药菌之一,国外资料统计其由定植发展 为感染的风险可达25%[1]。早产儿各器官功能发育 不健全,生后常需入住NICU 病房,因此接触这些 耐药微生物、发生定植并引起感染风险大大增加。 益生菌被认为可能在正常菌群建立之前通过多种 途径阻止致病菌的增殖,重建定植抗力。因此在 早产儿早期喂养的同时给予补充益生菌,理论上 可以直接补充肠道所缺乏的正常菌群,减少潜在 致病菌定植,降低感染风险。但目前国内外关于 益生菌对肠道耐药菌定植的影响相关报道还很少 见,本研究旨在通过前瞻性随机双盲试验探讨使 用益生菌能否减少NICU 中早产儿肠道产ESBL 耐 药菌的定植,以及相关感染的发生。 1 资料与方法 1.1 研究对象
2012 年7~12 月期间于我院产科出生后立即 入住NICU 病房,72 h 内开始胃肠内营养,且住院 时间超过7 d,胎龄<37 周的早产儿。排除先天性 肠梗阻、肠旋转不良、先天性无肛等消化道畸形, 或有腹裂、膈疝、严重脐膨出、严重先天性心脏 病病例。
在开始经口或经胃管喂养的同时采取随机数 字表法将患儿随机分为试验组和对照组,再以是 否母乳喂养进行分层。试验组患儿在开始经胃肠 喂养当日开始,混合奶汁经胃管或口服给予金双 歧(双歧杆菌乳杆菌三联活菌片,内蒙古双奇药 业股份有限公司生产)每次1/2 片,一日两次。对 照组常规喂养,不使用金双歧。 1.2 观察指标
生后第1、3、7、14 天直肠拭子耐药菌筛查 结果,晚发性败血症(late onset sepsis,LOS)、 感染性肺炎、喂养不耐受、坏死性小肠结肠炎 (necrotizing enterocolitis,NEC)、死亡、益生菌相 关感染的发生。 1.3 标本采集
所有患儿分别于生后第1、3、7、14 天采集 直肠拭子,拭子接种法国生物梅里埃公司ESBL 显 色培养基,最终显色菌落经革兰染色确认是否存 在ESBL 耐药菌定植。 1.4 统计学分析
应用SPSS 20.0 统计软件进行分析。资料用均
数± 标准差(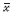 ±s)或率(%)表示。计量资料
组间比较采用t 检验,计数资料组间比较采用χ2
检验,P<0.05 为差异有统计学意义。
2 结果
2.1 一般资料
±s)或率(%)表示。计量资料
组间比较采用t 检验,计数资料组间比较采用χ2
检验,P<0.05 为差异有统计学意义。
2 结果
2.1 一般资料
共纳入257 例患儿,男125 例(48.6%),女 132 例(51.4%);胎龄232±13 d。母乳喂养62 例, 非母乳喂养195 例。
试验组119 例,其中母乳喂养26 例,非母乳 喂养93 例;对照组纳入138 例,其中母乳喂养36 例,非母乳喂养102 例。
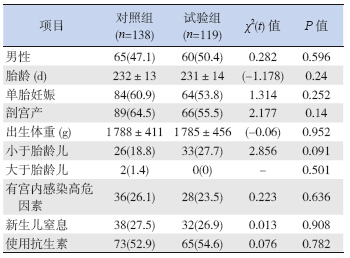
试验组与对照组病例在性别构成、胎龄、单 胎妊娠、生产方式、出生体重、宫内感染高危因素、 新生儿窒息、是否使用抗生素等方面的差异均无 统计学意义,具有可比性,见表 1。
|
|
表 1 各组患儿一般资料 [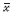 ±s 或n(%)] ±s 或n(%)]
|
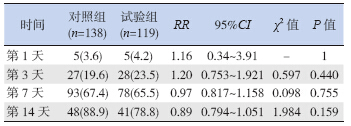
试验组与对照组患儿比较,第1、3、7、14 天直肠耐药菌定植差异均无统计学意义,见表 2。
|
|
表 2 两组直肠耐药菌定植率比较 [n(%)] |
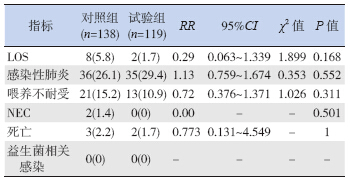
试验组和对照组在LOS、感染性肺炎、喂养 不耐受、NEC 及死亡的发生率的差异均无统计学 意义,见表 3。
|
|
表 3 两组其他疾病发生率的比较 [n(%)] |
试验组母乳喂养26 例,对照组母乳喂养36 例, 两组患儿第1、3、7、14 天直肠耐药菌定植差异 无统计学意义,在LOS、感染性肺炎、喂养不耐 受及死亡的发生率的差异也无统计学意义,两组 均无NEC 发生,见表 4。
|
|
表 4 母乳喂养患儿临床指标结果 [n(%)] |
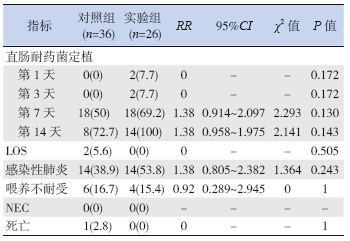
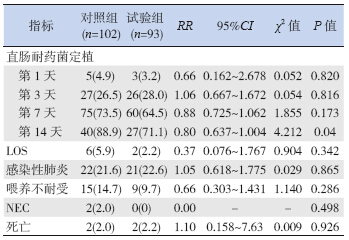
试验组非母乳喂养93 例,对照组非母乳喂养 102 例,两组患儿比较,第1、3、7 天直肠耐药菌 定植差异无统计学意义。第14 天对照组直肠拭子 查见耐药菌明显高于试验组(88.9% vs. 71.1%,RR 0.80,95%CI 0.637~1.004,P=0.04)。两组患儿在 LOS、感染性肺炎、喂养不耐受、NEC 及死亡的发 生率的差异均无统计学意义,见表 5。
|
|
表 5 非母乳喂养患儿临床指标结果 [n(%)] |
益生菌阻止肠道致病菌定植的可能机制包括 竞争性排斥潜在致病菌,通过增强黏膜IgA 应答 减轻致病菌定植能力,改善肠道通透性,增加黏 膜抵抗致病屏障等,需要达到一定的数量才能起 到作用[2, 3]。Smith 等[4] 报道了口服罗伊氏乳杆菌 4 d 后才能在粪便中监测到相应菌株。本研究试验 组与对照组比较,第1、3、7、14 天直肠耐药菌 定植均无显著差异,可能与使用时间短、尚未达 到有效剂量,以及母乳喂养可促进益生菌作用等 因素相关。
现存的一些关于益生菌对感染性疾病防治的 研究提示,益生菌可能能够减少院内感染性疾病 的发生[5, 6, 7]。但本研究中两组患儿在LOS 和感染性 肺炎的发生率上差异并不具有统计学意义。之前 的一些循证医学研究也指出目前的证据并不足以 说明益生菌能够减少院内感染性疾病的发生[7, 8], 其作用尚待进一步研究证实。
早产儿由于胃肠功能低下、肠道屏障功能 及动力尚不成熟,易发生呕吐、功能性腹胀、胃 食管反流、胃潴留等喂养不耐受表现。益生菌可 补充肠道正常菌群,产生各种消化酶促进消化吸 收,在代谢过程中还能产生有机酸促进肠蠕动和 排空,临床研究也证明了益生菌有助于改善早产 儿喂养不耐受的发生、缩短达到完全经口喂养所 需时间[5, 9]。本研究观察到了相同的趋势,对照组 喂养不耐受发生率较试验组有增高趋势(15.2% vs 10.9%),但差异无统计学意义。
早期异常的肠道菌群定植被认为是NEC 最重 要的发病机制之一。近年来有许多临床研究及高 质量的循证医学证据指出使用益生菌能够显著降 低早产儿严重NEC 的风险[7, 10, 11, 12]。本研究中2 例 NEC 患儿均发生在对照组中,但阳性结果太少, 未观察到统计学差异。
此外,观察时间不够长、药物剂量不足、抗 生素的影响以及交叉污染问题也是本研究在耐药 菌定植、喂养不耐受、LOS、感染性肺炎等方面未 观察到显著差异的可能原因。
本研究未发现与益生菌使用有关的不良反应, 与之前的较多大样本研究结果一致,支持了早产 儿使用益生菌制剂有较高的安全性[7, 10, 11]。但早产 儿毕竟是特殊的群体,且个体差异显著,不同益 生菌也存在菌株特异性。在没有完全确认其安全 性的情况下,针对早产儿的益生菌研究仍需谨慎 开展、严密监测、长期随访。
综上,早产儿早期使用益生菌制剂在一定条 件下可能减少直肠耐药菌定植,这些条件包括规 律摄入足够时间,根据胎龄、出生体重、是否使 用抗生素、是否母乳喂养等情况不同,达到一定 肠道存活数量等。通过抑制耐药菌定植,益生菌 可能对LOS 等感染性疾病有预防作用,但现存证 据尚不足。本研究也观察到早期使用益生菌对早 产儿喂养不耐受的发生有一定预防趋势,且进一 步证实了益生菌使用的安全性。对于益生菌在早 产儿中的使用仍存在许多不确定因素,值得进一 步研究。
| [1] | 刘健慧, 王丹华. NICU 常见院内感染耐药菌的定植与感染[J].新生儿科杂志, 2004, 19(5): 233-236. |
| [2] | Kalliomaki M, Salminen S, Arvilommi H, et al. Probiotics in primary prevention of atopic disease: s randomised placebocontrolled trial[J].Lancet, 2001, 357(9262): 1076-1079. |
| [3] | Brand S, Reinecker HC, Sandborn WJ. An enhanced barrier is a better defense: Effects of probiotics on intestinal barrier function[J].Inflamm Bowel Dis, 2002, 8(1): 67-69. |
| [4] | Smith TJ, Anderson D, Margolis LM, et al. Persistence of Lactobacillus reuteri DSM 17938 in the human intestinal tract: response to consecutive and alternate-day supplementation[J].J Am Coll Nutr, 2011, 30(4): 259-264. |
| [5] | 乔立兴, 唐月华, 王伟, 等. NICU 内早产儿早期肠道内添 加益生菌的临床观察[J].中国微生态学杂志, 2012, 24(11): 1011-1013. |
| [6] | Nair V, Soraisham AS. Probiotics and prebiotics: role in prevention of nosocomial sepsis in preterm infants[J].Int J Pediatr, 2013, 2013: 874726. |
| [7] | Wang Q, Dong J, Zhu Y. Probiotic supplement reduces risk of necrotizing enterocolitis and mortality in preterm very low-birthweight infants: an updated meta-analysis of 20 randomized, controlled trials[J].J Pediatr Surg, 2012, 47(1): 241-248. |
| [8] | Deshpande G, Rao S, Patole S, et al. Updated Meta-analysis of Probiotics for Preventing Necrotizing Enterocolitis in Preterm Neonates[J].Pediatrics, 2010, 125(5): 921-930. |
| [9] | Indrio F, Riezzo G, Raimondi F, et al. The Effects of Probiotics on Feeding Tolerance, Bowel Habits, and Gastrointestinal Motility in Preterm Newborns[J].J Pediatr. 2008, 152(6): 801-806. |
| [10] | AlFaleh K, Anabrees J, Bassler D, et al. Cochrane Review: Probiotics for prevention of necrotizing enterocolitis in preterm infants[J].Evid Based Child Health, 2012,7(6): 1807-1854. |
| [11] | Lin HC, Hsu CH, Chen HL, et al. Oral probiotics prevent necrotizing enterocolitis in very low birth weight preterm infants: a multicenter, randomized, controlled trial[J].Pediatrics, 2008, 122(4): 693-700. |
| [12] | Bin-Nun A, Bromiker R, Wilschanski M, et al. Oral probiotics prevent necrotizing enterocolitis in very low birth weight neonates[J].J Pediatr, 2005,147(2): 192-196. |
 2014, Vol. 16
2014, Vol. 16