2. 中国医学科学院、北京协和医学院血液病医院/血液学研究所 病理中心, 天津 300020
急性髓系白血病(AML)是一组起源于造血 干细胞的恶性克隆性疾病,由基因突变导致的细 胞增殖、分化及凋亡途径改变是AML 的发病基础。 目前国际上依据初诊时的白细胞计数、年龄、细 胞遗传学(染色体核型分析)检测结果等将其分 为预后良好、预后中等及预后差3 组[1]。
SIRT1(silent mating-type information regulation 2 homologue 1)是Sirtuins 去乙酰化酶家族中的一 员,参与了众多基因转录、能量代谢以及细胞衰 老过程的调节。目前的研究表明,SIRT1 与肿瘤的 发生发展有至关重要的作用。部分研究显示SIRT1 在许多鼠以及人类肿瘤细胞中高表达,下调SIRT1 的表达可引起相应肿瘤细胞的生长停止及凋亡[2, 3]。 也有研究表明,SIRT1 在许多肿瘤中的表达水平是 降低的,在一定程度上抑制了肿瘤发生[4]。
关于SIRT1 在白血病领域的研究目前仍处于 探索当中。研究显示:SIRT1 低表达于正常成人造 血干/ 祖细胞,但是在慢性粒细胞白血病造血干/ 祖细胞中的表达却是升高的[5]。SIRT1 的活化可以 被bcr/abe 酪氨酸激酶介导也可独立发生。SIRT1 的活化促进慢性髓系白血病(CML)干细胞对酪 氨酸激酶抑制因子拮抗,从而起到了后天获得的 类似bcr/abe 突变的拮抗作用[5]。Bradbury 等[6] 首 先发现SIRT1 在AML 病人中表达升高。而关于 SIRT1 在AML 中的表达情况及对预后的影响目前 鲜有报道。本课题组前期研究发现除目前常见的 染色体异常会影响AML 患儿的预后外,一些尚未 被列为诊断或分型标准的基因异常,如FLT3/TKD 突变等也是儿童AML 致病及预后的关键因素[7]。 那么SIRTl 在儿童AML 的致病及预后中又扮演了 什么样的角色呢?为了解儿童AML 中SIRT1 的表 达情况,本研究对54 例初诊AML 患儿骨髓活检 组织中SIRTl 的表达情况进行检测,并分析其与临 床特征、疗效的相关性,报告如下。 1 资料与方法 1.1 一般资料
选取2009 年7 月至2012 年4 月于中国医学 科学院血液病医院儿童血液病诊疗中心初诊并行 骨髓活检的54 例AML 患儿为研究对象,所有患 儿均经骨髓形态学、细胞组织化学染色、细胞免 疫分型、分子生物学等确诊。其中男30 例,女24 例,年龄9.5 岁(2~18 岁)。该研究已取得患儿 监护人知情同意。 1.2 诊断、危险度分组及疗效标准
参照1987 年全国白血病化疗讨论会制定的 白血病诊断标准[8] 并依据AML-99 方案改良的 CAMS-2009 方案[9] 分型标准对患儿进行危险度分 型。(1)低危组:伴t(8;21) 且WBC<50×109/L, 伴inv16(p13q22),或年龄<2 岁且无高危因素; (2)高危组:诱导治疗1 疗程未达完全缓解(CR) 或伴-7,5q-、t(16;21)、t(9;22) 等;(3) 中危组: 无上述两组特征的患儿。疗效判断标准参照《血 液病诊断和疗效标准》第3 版[10]。 1.3 治疗方案
所有进行治疗的非AML-M3 患儿均采用根据 AML-99 方案改良的CAMS-2009 方案[9] 进行治疗。 A 方案:依托泊甙(VP-16)、阿糖胞苷(Ara-C) 和米托蒽醌(MTZ)组成单诱导方案,第6 天三 联鞘注;B 方案:VP-16、Ara-C 和去甲氧柔红霉 素(IDA)组成的双诱导方案,第4 天三联鞘注; C 方案:VP-16、Ara-C 和IDA 组成的方案,第1 天三联鞘注。其中年龄<2 岁或WBC<100×109/L 的患儿采用A 方案;年龄>2 岁且WBC>100×109/ L 的患儿采用B 方案;1 疗程治疗后骨髓象呈M3 状态的患儿则进行C 方案再诱导治疗。巩固治疗 方案为4~6 个含中、大剂量Ara-C 组成的方案。
所有进行治疗的AML-M3 患儿均采用如下方 案:诱导治疗应用全反式维甲酸(ATRA)或三氧 化二砷(As2O3)或二者联合应用,达CR 后给予 至少2疗程强化治疗,化疗方案为DA(柔红霉素 +Ara-C) 或MA(MTZ+Ara-C)或HA(高三尖杉 酯碱+Ara-C),维持治疗采用全反式维甲酸(ATRA) 联合6- 巯基嘌呤(6-MP)和甲氨蝶呤(MTX), 缓解期行腰穿加三联鞘注[11]。 1.4 免疫组化法检测骨髓组织SIRT1 蛋白表达
采用EnVision 两步法进行免疫组化检测[12]。 兔抗人SIRT1 抗体( 克隆号E104) 购于美国 Abcam 公司,工作浓度1 : 100;二抗快捷型酶标羊 抗属/ 兔IgG 聚合物购于福州迈新公司。DBA 显色 剂购于北京中山金桥公司。石蜡标本4 μm 厚度 连续切片,高压抗原修复,DBA 显色。用已知阳 性切片作为阳性对照,PBS 代替一抗作为阴性对照。
SIRT1 蛋白定位于细胞核,阳性着色细胞核 呈黄色或棕黄色。每例患儿骨髓组织标本随机选 取2 张切片,每张切片随机观察10 个高倍视野, 在无背景着色条件下用半定量积分法判断结果[13]: (1)黄色为1 分,棕黄色为2 分,棕褐色为3 分; (2)计数10 个高倍视野,阳性细胞在同类细胞 中所占百分率<25% 为0 分,25%~ 为1 分,50%~ 为2 分,≥ 75% 为3 分。(3)按照上述两项指标 的分数乘积:0 分为阴性,1~3 分为弱阳性,4~6 分为阳性,7~9 分为强阳性。 1.5 分组
根据患儿骨髓活检组织中SIRT1 蛋白的表达 情况将病例分为SIRT1 阴性组(10 例)和SIRT1 阳性组(44 例);根据SIRT1 表达的阳性程度不 同进一步将SIRT1 阳性组分为(+)组、(2+)组 和(3+)组。各组患儿性别、年龄、FAB 分型、 初诊白细胞计数、骨髓初诊幼稚细胞比例、融合基 因、染色体等分布上差异均无统计学意义,见表 1 。
| 表 1 例患儿初诊时基本临床资料 |
采用SPSS 17.0 统计软件对数据进行统计学 分析。符合正态分布的计量资料以均数± 标准差 (x±s)表示,组间比较采用t 检验;非正态分 布的计量资料以中位数(四分位间距)[M(P25, P75)表示,组间比较采用秩和检验;计数资料用 例(%)表示,采用卡方检验比较组间差异。生存 曲线采用Kaplan-Meier 分析,多因素分析采用Cox 回归分析,P<0.05 为差异有统计学意义。总生存 (OS)期指自诊断到死亡或末次随访日期。无事 件生存(EFS)期定义为自诊断到第1 次事故(包 括复发、在CR 期间的死亡,未达CR 者EFS 为0) 或末次随访日期。随访时间截至2013 年6 月31 日。 2 结果 2.1 各组患儿SIRT1 表达的比较
病理组织骨髓活检显示,SIRTI 阴性组所有有 核细胞均未着色;SIRTI 阳性(+)组、(2+)组和(3+) 组细胞胞核均染色成黄棕色,着色深度由黄棕色 至棕褐色依次加深,着色细胞比例由少至多。见 图 1。
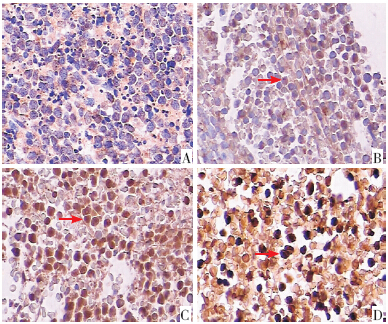 | 图 1 SIRT1 骨髓活检病理组织免疫组织化学染色 (×400,DBA 显色)A:SIRTI 阴性组,有核细胞均未着色; B~D 为SIRTI 阳性组,其中B 为(+)组,C 为(2+)组,D 为(3+)组。(+) 组阳性细胞胞核染色成棕色;(2+)组阳性细胞胞核染色为棕色, 每个高倍镜视野着色细胞比例高于(+)组;(3+)组阳性细胞胞 核染色成棕黑色,每个高倍镜视野着色细胞比例高于(2+)组。 箭头所指为SIRT1 阳性细胞。 |
54 例患儿中有10 例失访,44 例可评价,总 缓解率为75%(33/44),复发率为21%(7/33), 病死率为32%(14/44)。SIRT1 阴性组10 例患儿中, 2 例失访,8 例可评价,缓解率为87%(7/8),复 发率和病死率均为0。SIRT1 阳性组44 例患儿中, 9 例失访,35 例可评价,缓解率为71%(25/35), 复发率为28%(7/25),病死率为37%(13/35)。 (+)组8 例患儿中,无失访,缓解率为87%(7/8), 复发率为14%(1/7),病死率为12%(1/8); (2+)组7 例患儿中,1 例失访,6 例可评价,缓 解率为83%(5/6),复发率为60%(3/5),病死 率为50%(3/6);(3+)组29 例患儿中,失访8 例, 21 例可评价,缓解率为62%(13/21),复发率为 23%(3/13),病死率为43%(9/21)。SIRT1 阴 性组、SIRT1 阳性组及其各亚组间在缓解率、复发 率上差异均无统计学意义(均P>0.05);仅SIRT1 阴性组病死率明显低于(3+)组(P<0.05)。 2.3 两组患儿生存分析结果
SIRT1 阴性组2 年OS 率(100%)高于SIRT1 阳性组[(44.9±15.5)%,P=0.048]( 图 2); SIRT1 阴性组2 年EFS 率(100%)高于SIRT1 阳 性组[(53.0±9.0)%,P=0.033],见图 3。
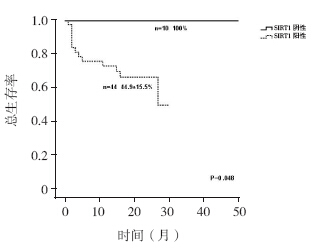 | 图 2 SIRT1 阴性与阳性患儿2 年总生存分析 |
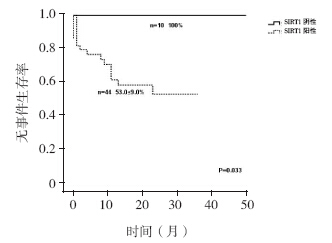 | 图 3 SIRT1 阴性与阳性患儿2 年无事件生存分析 |
在排除了性别、年龄、FAB 分型、初诊时外 周血白细胞计数、初诊时骨髓幼稚细胞比例、染 色体、融合基因等影响因素的影响后,仅SIRT1 阳性表达水平不利于患儿的长期生存(P=0.045, 危险系数绝对值=2.071,95%CI:1.017~4.219)。 3 讨论
SIRT1 广泛表达于胎儿及成人组织中,其生 理功能涉及基因转录沉默、细胞生长周期调节、 能量代谢、血管生成、神经保护及细胞衰老等。 SIRT1 通过对染色质结构、染色质重塑和基因表达 的决定作用来影响不同的细胞过程[14]。
本研究共检测54 例AML 患儿骨髓活检组织 中SIRT1 蛋白的表达情况,其中有44 例(82%) SIRT1 表达阳性,进一步对这54 例患儿临床治疗 情况及预后随访进行研究后发现,SIRT1 阴性患儿 的预后普遍优于SIRT1 阳性患儿,生存分析显示: SIRT1 阴性组无论是在2 年OS 还是2 年EFS 均明 显高于SIRT1 阳性组。Cox 多因素回归分析方法 检测也显示:在排除了性别、年龄、FAB 分型、 初诊时外周血白细胞计数、初诊时骨髓幼稚细胞 比例、染色体、融合基因等影响因素的影响后, SIRT1 阳性仍是不利于患儿的长期生存的独立因 素。上述结果提示:高表达的SIRT1 在儿童AML 的发生发展中很可能扮演了促进肿瘤细胞增殖、 抑制肿瘤细胞凋亡的作用。本研究结果跟目前国 际上报道的关于SIRT1 在CML 耐药复发过程中所 起的作用基本一致。Yuan 等[15] 报道:对于原发性 或继发性耐药的CML 细胞,酪氨酸激酶抑制剂显 得有些无能为力,研究其分子生物学特征,发现 该部分细胞多高表达SIRT1,提示SIRT1 的高表达 对于CML 的耐药起到了一定的作用。Li 等[16] 同样 发现:酪氨酸激酶抑制剂对于CML 中静止期的白 血病干细胞作用非常有限,而这些静止期的白血 病干细胞上检测出有高表达的SIRT1,应用SIRT1 抑制剂或敲除SIRT1 基因后,CML 小鼠体内或体 外的静止期CML 白血病细胞均加速凋亡。O'Hare 等[17] 同样在CML 的靶向治疗中提到了SIRT1 的重 要作用。
综上所述,SIRT1 在半数以上AML 患儿骨髓 活检组织表达,且高表达与AML 患儿不良预后相 关。但由于儿童活检存在技术难度,本研究样本 量有限,有必要进行大样本量临床验证,为儿童 AML 寻找有意义的预测预后的分子标志。
| [1] | Vardiman JW, Thiele J, Arber DA, et al. The 2008 revision of the World Health Organization (WHO) classification of myeloid neoplasms and acute leukemia: rationale and important changes[J].Blood, 2009, 114(5): 937-951. |
| [2] | Huffman DM, Grizzle WE, Bamman MM, et al. SIRT1 is significantly elevated in mouse and human prostate cancer[J].Cancer Res, 2007, 67(14): 6612-6618. |
| [3] | Stunkel W, Peh BK, Tan YC, et al. Function of the SIRT1 protein deacetylase in cancer[J].Biotechnol J, 2007, 2(11): 1360-1368. |
| [4] | Firestein R, Blander G, Michan S, et al. The SIRT1 deacetylase suppresses intestinal tumorigenesis and colon cancer growth[J].PLoS ONE, 2008, 3(4): e2020. |
| [5] | Chen W, Bhatia R. Roles of SIRT1 in leukemogenesis[J].Curr Opin Hematol, 2013, 20(4): 308-313. |
| [6] | Bradbury CA, Khanim FL, Hayden R, et al. Histone deacetylases in acute myeloid leukaemia show a distinctive pattern of expression that changes selectively in response to deacetylase inhibitors[J].Leukemia, 2005, 19(10): 1751-1759. |
| [7] | 阮敏, 王雅琴, 张丽, 等. 儿童急性髓系白血病FLT3突变临床分析:单中心研究[J].中国当代儿科杂志, 2011, 13(11): 863-866. |
| [8] | 张之南, 沈悌. 血液病诊断及疗效标准[M]. 第3 版. 北京: 科学出版社, 2007: 19-23. |
| [9] | Tsukimoto I, Tawa A, Horibe K, et al. Risk-stratified therapy and the intensive use of cytarabine improves the outcome in childhood acute myeloid leukemia: the AML99 trial from the Japanese Childhood AML Cooperative Study Group[J].J Clin Oncol, 2009, 27(24): 4007-4013. |
| [10] | 张之南, 沈悌. 血液病诊断及疗效标准[M]. 第3 版. 北京: 科学出版社, 2007: 103-116. |
| [11] | Zhang L, Zhu X, Zou Y, et al. Effect of arsenic trioxide on the treatment of children with newly diagnosed acute promyelocytic leukemia in China[J].Int J Hematol, 2011, 93(2): 199-205. |
| [12] | K n a b e C, K r a s k a B, K o c h C, e t a l. A m e t h o d f o r immunohistochemical detection of osteogenic markers in undecalcified bone sections[J].Biotech Histochem, 2006, 81(1): 31-39. |
| [13] | 王泰龄, 黄受方, 李维华, 等. 《全国免疫组织化学技术与 诊断标准化专题研讨会》会议纪要[J].中华病理学杂志, 1996, 25(6): 7-9. |
| [14] | Knight JR, Milner J. SIRT1, metabolism and cancer[J].Curt Opin Oncol, 2012, 24(1): 68-75. |
| [15] | Yuan H, Wang Z, Li L, et al. Activation of stress response gene SIRT1 by BCR-ABL promotes leukemogenesis[J].Blood, 2012, 119(8): 1904-1914. |
| [16] | Li L, Wang L, Wang Z, et al. Activation of p53 by SIRT1 inhibition enhances elimination of CML leukemia stem cells in combination with imatinib[J].Cancer Cell, 2012, 21(2): 266-281. |
| [17] | O'Hare T, Zabriskie MS, Eiring AM, et al. Pushing the limits of targeted therapy in chronic myeloid leukaemia[J].Nat Rev Cancer, 2012, 12(8): 513-526. |
 2014, Vol. 16
2014, Vol. 16