甲基丙二酸血症(methylmalonic acidemia, MMA) 是由甲基丙二酰辅酶A 变位酶 (methylmalonyl-CoAmutase,MCM)或其辅酶腺苷 钴胺素(Ado-Cb1)缺陷导致的一种常染色体隐性 遗传代谢性疾病。其患病率在美国为1 : 48 000, 日本为1 : 50 000[1],国内患病率尚不清楚,但对临 床疑似患儿进行串联质谱检测发现MMA 患儿并不 少见[2]。正常情况下,甲基丙二酸在MCM 和Ado- Cbl 作用下转变成琥珀酰辅酶A 参与三羧酸循环, MCM 活性不足或维生素B12 代谢障碍可导致甲基 丙二酸及其前体丙酸、甲基枸橼酸等代谢物的异 常蓄积,从而引起神经、肾脏、肝脏等多系统损 伤[3, 4]。微小RNA(microRNA,miRNA) 是一类 长约22 个核苷酸的非编码单链RNA,它可以通过 与靶基因的3' 端非翻译区(3'-UTR)互补配对抑 制基因转录后表达,从而参与细胞增殖、分化、 发育、凋亡等多种生物过程。近年来研究表明, miRNA 在疾病状态下可异常表达且具有检测方法 灵敏、准确等特点,这提示miRNA 可能作为潜在 的生物标记物辅助相关疾病的诊断[5]。生物信息 学工具预测发现miR-9 有众多可预测的下游靶基 因,而研究亦证实miR-9 在生物发育、细胞增殖、 凋亡和神经前体细胞分化过程中起着重要的调控 作用。本研究通过检测MMA 患儿与健康人之间 miRNA 的表达差异,以寻找合适的生物标志物来 辅助MMA 的诊断。 1 资料与方法 1.1 研究对象
所有MMA 病例来自2011 年8 月至2013 年6 月就诊于郑州大学第一附属医院及郑州 大学第三附属医院的患儿,共收集17 例MMA 患儿、10 例非MMA 的高同型半胱氨酸血症 (hyperhomocysteinemia)患者及10 例健康对照者 的血浆样本。MMA 患儿的诊断标准参照文献[6]。 尿液样本送至北京儿童医院进行气相色谱- 质谱 (GC-MS)定量测定甲基丙二酸含量。结合临床表 现、影像学及生化学检查后确诊为MMA。
17 例MMA 患儿根据血浆同型半胱氨酸 (Hcy)水平进行分组:Hcy>16 μmol/L 者为MMA 合并HHcy 组(MMA+HHcy 组,12 例);Hcy ≤ 16 μmol/L 者为MMA 未合并HHcy 组(MMA 组, 5 例)。上述病例中经维生素B12 治疗并具有一定 家庭经济能力的5 例患儿于治疗3 周后将其尿液 样本送至北京儿童医院复查GC/MS。
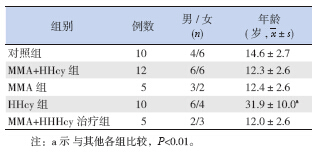
由于单纯HHcy 在青少年中少见,故本研究 中HHcy 组年龄较其他各组大(P<0.05),余各组 间性别,年龄差异无统计学意义。各组患儿临床 基本资料见表 1。
| 表 1HME 家系基本临床资料 |
采集患儿资料并建立档案,留取外周血。本 研究经我院医学伦理委员会批准,患儿家长知情 并签署知情同意书。 1.2 主要试剂
miRcute miRNA isolation Kit(DP501) 购自Tiangen 公司,Reverse Transcriprition System(A3500)、Gotaq qPCR Master Mix (A6001) 购自Promega 公司,miR-9-1 引物购 自广州锐博生物科技有限公司( 序列Forward 5'-TCATAAAGCTAGATAACCGAAGAT-3'; Reverse 5'-TCCAGAGGCGACCCAGAGC-3')。 1.3 血浆标本的收集
参照Kim 等[7] 方法,抽取患儿外周血3 mL, 收集于氟化钠(NaF)管中,采用4℃、3 000 r/min 离心15 min,取上层血浆置于-80℃冰箱备用。 1.4 血浆miRNA 的抽提
按照miRcute miRNA 提取分离试剂盒说明书 进行抽提miRNA。 1.5 微阵列基因芯片
选取MMA 患儿和健康对照各5 例进行 miRNA 微阵列基因芯片检测,其中MMA 组男3 例, 女2 例,平均年龄13.4±2.1 岁; 对照组男2 例, 女3 例,平均年龄13.4±1.7 岁。两组性别、年龄 差异无统计学意义(P>0.05)。
由 LC Sciences 提供技术服务,在 MMA 患儿 和健康对照组血浆 miRNA 3' 端加上poly(A)尾, 并将寡聚核苷酸标记与 poly(A) 尾连接。将标记 产物、含有 25% 甲酰胺的 100 μL 6xSSPE 缓冲液 混合后在 LC Sciences 微阵列基因芯片上杂交过夜, 杂交温度为34℃。杂交后与标记特异结合的 Cy3 染料进行染色。利用GenePix 4000B 采集杂交图像 并使用Array-Pro 进行图像数字化转换。所得数值 减除背景值后,采用 LOWESS 法进行信号归一化, t 检验进行两组差异表达基因分析。 1.6 RT-PCR
MMA+HHcy 组、单纯MMA 组、单纯HHcy 组及MMA+HHHcy 治疗组(经维生素B12 治疗并 复查尿甲基丙二酸含量)进行实时荧光定量PCR (RT-PCR)检测。另检测10 例健康儿童作为对照。
根据 Reverse Transcription System 说明书,将 miRNA 逆转录为cDNA。按照Gotaq qPCR Master Mix 说明书进行荧光定量检测,以5S 为内参。记 录相应的Ct 值,miRNA 相对表达量采用公式2-△△ Ct 方法计算,每例样本重复3 次,整个实验采用盲法。 1.7 统计学分析
采用 SPSS 17.0 统计软件进行统计学分析。计 量资料采用均数± 标准差或中位数(四分位数) [M(P25,P75)] 表示,正态分布连续变量资料采 用t 检验,非连续变量资料采用卡方检验,非正态 分布连续变量资料采用秩和检验,相关性分析采 用Pearson 相关性分析方法,P<0.05 为差异有统计 学意义。 2 结果
2.1 尿液甲基丙二酸倍率
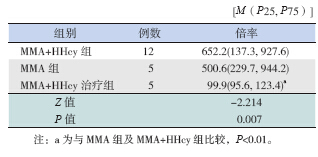
GC-MS 测定尿液甲基丙二酸倍率( 倍率 = 分析值/ 基准值,基准值为0.001) 显示, MMA+HHcy 治疗组甲基丙二酸倍率显著低于 MMA+Hcy 组及 MMA 组(P<0.01),见表 2。
| 表 2HME 家系基本临床资料 |
miRNA 微阵列基因芯片筛选出具有表达差异 的miRNA 有 26 个,其中上调2 倍以上的有miR- 144-3p、miR-4687-3p、miR-30c-1 等10 个,下调 的有miR-9-1、miR-191-5p、miR-30a-5p 等16 个,见 图1。
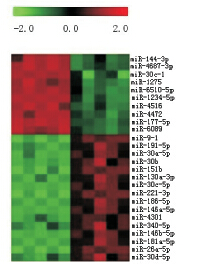 |
图 1 微阵列芯片聚类图 上调2 倍以上的有miR-144- 3p、miR-4687-3p、miR-30c-1 等10 个,下调的有miR-9-1、miR- 191-5p、miR-30a-5p 等16 个。 |
MMA + HHcy 组miR-9-1 相对表达量为 (1.11±0.95)×10-3,MMA 组为(2.46±2.91) ×10-2,HHcy 组为 0.161±0.119,MMA+HHcy 治 疗组为0.214±0.023,健康对照组为0.250±0.103, 其中MMA+Hcy、MMA 及HHcy 组与健康对照组比 较差异均有统计学意义(P<0.01),MMA+HHcy 治疗组与健康对照组比较差异无统计学意义,见图 2 ;且在 MMA+HHcy 组及 MMA 组中 甲基丙二 酸倍率值越高,miR-9-1 相对表达量越低,相关 系数分别为-0.789、-0.867,见图3A、3C,而在 MMA+HHcy 组及HHcy 组中 miR-9-1 相对表达量 与血Hcy 值无相关性,见图 3B、3D 。
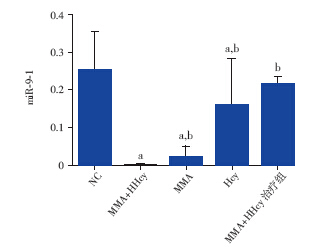 |
图 2 各组 miR-9-1 的相对表达量 a 为与NC 组( 健 康对照) 比较,P<0.01;b 为与MMA+Hcy 组比较,P<0.01。 |
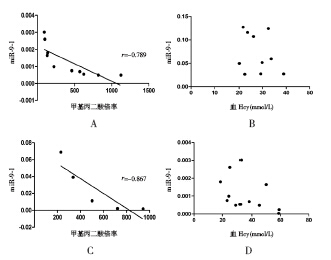 |
图 3 miR-9-1 表达与尿甲基丙二酸倍率、血Hcy 值 的相关性 A:MMA+HHcy 组,尿甲基丙二酸倍率与miR-9-1 表达呈负相关(r=-0.789,P=0.007);B:HHcy 组,miR-9-1 表 达与血Hcy 值无相关性;C:MMA 组,尿甲基丙二酸倍率与miR- 9-1 表达呈负相关(r=-0.867,P=0.04);D:MMA+HHcy 组, miR-9-1 表达与血Hcy 值无相关性。 |
2.3 miR-9-1 对MMA 的诊断效能
ROC 曲线分析结果显示,利用 miR-9-1 的相 对表达量对 MMA 进行诊断时,ROC 曲线下面积为 0.974。若以0.027 为诊断临界值,即miR-9-1 相对 表达量低于0.027 时诊断为MMA,约登指数最大, 为0.832,灵敏度和特异度分别为0.95、0.882,见图 4 。
 |
图 4 通过血浆miR-9-1 相对表达量诊断MMA 的曲线下面积(AUC) |
3 讨论
本研究发现MMA+HHcy 组及MMA 组中甲基 丙二酸倍率越高,miR-9-1 相对表达量越低,而在 MMA+HHcy 组及HHcy 组中血Hcy 值与miR-9-1 相对表达量无相关性。这提示MMA 患儿甲基丙二 酸蓄积量可能在miR-9-1 的下调中起主导作用,而 MMA+HHcy 组miR-9-1 相对表达量明显低于MMA 组及HHcy 组,则可能是由甲基丙二酸及Hcy 的 共同作用引起。MMA+HHcy 治疗组复查尿甲基丙 二酸倍率较治疗前显著下调,提示患儿治疗后病 情控制较好,此时检测miR-9-1 相对表达量明显上 调,基本恢复正常人水平,推测miR-9-1 可能是反 映治疗效果及病情状况的一个指标。
MMA 造成脑损伤的机制尚不十分明确,有研 究表明其可能通过抑制三羧酸循环途径以及氧化 磷酸化,导致线粒体功能障碍,诱发氧化应激以 及兴奋性毒性,从而诱导神经元细胞发生凋亡[8, 9]。 最新研究发现将 甲基丙二酸经皮下注射至 Wistar 大鼠体内可引起大鼠血液中多形核白细胞的减少 及皮质组织中 IL-1β、TNFα、iNOS 表达水平的 增高,由此推测神经炎症机制可能参与了 MMA 患 儿脑损伤的过程[10]。
关于 miR-9-1 在 MMA 中的作用机制,目前国 内尚无相关报道。研究表明miR-9-1 可能对炎症 因子起到一定的抑制作用。如Jones 等[11] 报道在 人骨关节炎软骨细胞过表达miR-9 可使IL-1β 诱 导产生的 TNFα 减少40%,提示miR-9 可能对骨 关节炎疾病起到保护作用。Kaneko 等[12] 在交感性 眼炎患儿的眼球样本中发现miR-9 下调,并证实 miR-9 可负调控靶基因TNFα 及NF-κB1,而后二 者与线粒体氧化应激介导的光感受器凋亡有关。 Bazzoni 等[13] 研究发现TLR-4 激活的NF-κB1 可诱 导多形核中性白细胞与单核细胞中的miR-9 上调, 而miR-9 形成的负反馈通路可对 NF-κB 家族成员 的表达进行调控。本研究发现miR-9-1 在MMA 患 儿血浆中下调,为国内首次报道,推测可能是由 于MMA 引起的炎症反应超过了miR-9-1 的抑制 作用,这为miR-9-1 是否可作为MMA 治疗靶点 提供了新思路。但亦有一些报道不能解释本研究 发现,如Liu 等[14] 报道在由LPS 介导的炎症反应 中miR-9上调,提示其与炎症反应有关;还有研 究发现miR-9 可在转录后水平抑制NF-κB1 表达, 而后者已被证实具有抗凋亡作用[15, 16],故miR-9-1 在MMA 中下调的原因和机制尚需进一步研究。而 miR-9-1 表达水平与MMA 进展过程的深层关系仍 需进一步扩大样本量进行验证,miR-9-1 在MMA 中的可能作用机制亦需进一步研究。
总之,miR-9-1 在MMA 患儿血浆中显著下调, 维生素B12 治疗后显著上调,且在尿中甲基丙二酸 值越增高,miR-9-1 下调越明显,可作为潜在的生 物标记物辅助MMA 的诊断,从而监测病情的变化。
| [1] | Deodato F, Boenzi S, Santorelli FM, et al. Methylmalonic and propionic aciduria [J].Am J Med Genet C Semin Med Genet, 2006, 142C (2): 104-112. |
| [2] | Tu WJ. Methylmalonic acidemia in mainland China [J].Ann Nutr Metab, 2011, 58(4): 281. |
| [3] | Wajner M, Coelho JC. Neurological dysfunction in methylmalonic acidaemia is probably related to the inhibitory effect of methylmalonate on brain energy production [J].J Inherit Metab Dis, 1997, 20(6): 761-768. |
| [4] | Richard E, Alvarez-Barrientos A, Desviat LR, et al. Methylmalonic acidaemia leads to increased production of reactive oxygen species and induction of apoptosis through the mitochondrial/caspase pathway [J].J Pathol, 2007, 213(4): 453-461. |
| [5] | Jin XF, Wu N, Wang L, et al. Circulating microRNAs: a novel class of potential biomarkers for diagnosing and prognosing central nervous system diseases[J].Cell Mol Neurobiol, 2013, 33(5): 601- 613. |
| [6] | Han LS, Ye J, Qiu WJ, et al. Selective screening for inborn errors of metabolism on clinical patients using tandem mass spectrometry in China: a four-year report[J].J Inherit Metab Dis, 2007, 30(4): 507-514. |
| [7] | Kim DJ, Linnstaedt S, Palma J, et al. Plasma components affect accuracy of circulating cancer-related microRNA quantitation [J].J Mol Diagn, 2011, 14(1): 71-80. |
| [8] | Melo DR, Kowaltowski AJ, Wajner M, et al. Mitochondrial energy metabolism in neurodegeneration associated with methylmalonic academia[J].J Bioenerg Biomembr, 2011, 43(1): 39-46. |
| [9] | Fernandes CG, Borges CG, Seminotti B, et al. Experimental evidence that methylmalonic acid provokes oxidative damage and compromises antioxidant defenses in nerve terminal and striatum of young rats[J].Cell Mol Neurobiol, 2011, 31(5): 775-785. |
| [10] | Ribeiro LR, Della-Pace ID, de Oliveira Ferreira AP, et al. Chronic administration of methylmalonate on young rats alters neuroinflammatory markers and spatial memory[J].Immunobiology, 2013, 218(9): 1175-1183. |
| [11] | Jones SW, Watkins G, Le Good N, et al. The identification of differentially expressed microRNA in osteoarthritic tissue that modulate the production of TNF-alpha and MMP13 [J].Osteoarthritis Cartelage, 2009, 17(4): 464-472. |
| [12] | Kaneko Y, Wu GS, Saraswathy S, et al. Immunopathologic processes in sympathetic ophthalmia as signified by microRNA profiling [J].Invest Ophthalmol Vis Sci, 2012, 53(7): 4197-4204. |
| [13] | Bazzoni F, Rossato M, Fabbri M, et al. Induction and regulatory function of miR-9 in human monocytes and neutrophils exposed to proinflammatory signals[J].Proc Natl Acad U S A, 2009, 106(13): 5282-5287. |
| [14] | Liu GD, Zhang H, Wang L, et al. Molecular hydrogen regulates the expression of miR-9, miR-21 and miR-199 in LPS-activated retinal microglia cells [J].Int J Ophthalmol, 2013, 6(3): 280-285. |
| [15] | Wan HY, Guo LM, Liu T, et al. Regulation of the transcription f a c t o r N F -k a p p a B 1 b y m i c r o R N A -9 i n h u m a n g a s t r i c adenocarcinoma[J].Mol Cancer, 2010, 9: 16. |
| [16] | Okada Y, Kato M, Minakami H, et al. Reduced expression of fliceinhibitory protein (FLIP) and NFkappaB is associated with death receptor-induced cell death in human aortic endothelial cells (HAECs)[J].Cytokine, 2001, 15(2): 66-74. |
 2014, Vol. 16
2014, Vol. 16