2. 拉萨市人民医院儿科, 西藏 拉萨 850000
气道炎症和气道重塑是支气管哮喘重要的病 理生理特征[1],其发生机制复杂,目前仍未完全阐 明。许多证据显示,Th1/Th2 细胞免疫功能紊乱是 支气管哮喘发病的中心环节,导致多种细胞因子 和炎症介质的产生,参与了气道炎症和气道重塑 的发生、发展。Th1/Th2 细胞的分化受到许多因素 影响,其中Notch 信号通路通过激活靶基因Hes-1 等也参与了Th 细胞分化的调节[2],但是其与支气 管哮喘气道炎症和气道重塑间的关系研究甚少, 国内尚未见报道。因此,本研究拟建立大鼠哮喘 模型,观察Hes-1 的表达变化及与哮喘大鼠气道炎 症和气道重塑间的关系,以期为阐明哮喘发病机 制及寻求新的治疗方法提供思路和依据。 1 资料与方法 1.1 实验动物及材料
清洁级雄性Sprague-Dawley(SD)大鼠由四川 大学华西医学中心实验动物中心提供;卵白蛋白 (OVA)购自美国Sigma 公司,白细胞介素4(IL- 4)、INF-γ ELISA 试剂盒购自美国Invitrogen 公司, 小鼠抗大鼠Hes-1 单克隆抗体为英国Abcam 公司 产品。 1.2 动物分组与哮喘模型的建立
生后6 周龄雄性SD 大鼠48 只,平均体重 149±12 g,按随机数字表法随机分为对照组和哮 喘组,两组依据不同处理时间点各分为4 周、8 周、12 周3 个亚组,每组8 只大鼠。哮喘大鼠气 道重塑模型的建立参考文献方法[3] 并加以改良: (1)致敏:第1 天和第8 天腹腔注射1 mL 0.1% OVA(1 mg)加Al(OH)3(100 mg)混合液致敏; (2)激发:第15 天开始以1% OVA 雾化吸入激发, 每次35 min,隔天1 次,分别激发4 周、8 周及12 周。 在相应时间点致敏与激发时以生理盐水代替OVA 建立对照组。 1.3 标本收集
末次激发后2 h,予大鼠10% 水合氯醛 400 mg/kg 腹腔注射麻醉,心脏穿刺取血后标本于 4 ℃ 静置2 h,3 000 r/min 离心15 min,吸取血清 于-80℃保存备用。即刻打开胸腔,暴露肺组织, 气管切开插管,结扎右主支气管,用2 mL 生理盐 水于气管插管处注入,缓慢灌洗左肺,并用手指 轻轻按摩肺组织约30 s 后回收支气管肺泡灌洗液 (BALF),共3 次,保留回收率高于80% 的标本, 1 800 r/min 离心15 min,取上清分装于EP 管中, -80℃保存备用。切取右肺近肺门组织,4% 多聚 甲醛固定,常规石蜡包埋切片,进行苏木精- 伊 红(HE)染色及免疫组织化学检测;其余肺组织 液氮保存用于PCR 检测。 1.4 支气管平滑肌厚度的测定
参照文献[3] 方法,在200 倍光镜下,每只大 鼠随机取3 张切片,挑选每张切片中有完整横断 面的中小支气管3 支,应用Image Pro Plus 图像 分析软件测量基底膜周径(Pbm),单位长度基 底膜的平滑肌厚度(Wam,μm2/μm)=[ 平滑肌外 缘内气管厚度(Wam1)- 平滑肌内缘内气管厚度 (Wam2)] /Pbm。 1.5 IL-4 和INF-γ 浓度的测定
应用酶联免疫吸附试验(ELISA)法测定血清 和BALF 中IL-4、INF-γ 的浓度,测定方法按产 品说明书进行操作。 1.6 免疫组织化学法检测肺组织Hes-1 蛋白的表 达
切片经常规脱蜡至水,水化,微波修复,阻 断内源性过氧化氢酶和非特异性反应,滴加小鼠 抗大鼠Hes-1 单克隆抗体(稀释度为1 : 200),4℃ 过夜;洗涤后滴加二抗及SP 工作液,3,3- 二氨 基联苯胺(DAB)显色,苏木素复染,脱水,透明, 树胶封片。阳性结果呈棕黄色,集中表达于气道 上皮细胞、平滑肌细胞胞浆。每只大鼠随机取3 张切片,每张切片随机选择3 个200 倍镜下支气 管视野,应用Image Pro PLus 图像分析软件测定阳 性部位的平均吸光度(OD),用以代表阳性部位 的蛋白表达水平。 1.7 实时荧光定量PCR 法检测肺组织Hes-1 mRNA 的变化
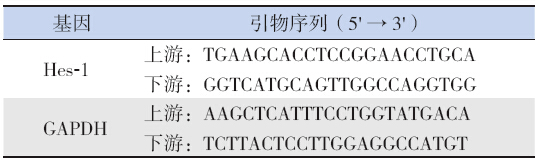
大鼠肺组织加入TRIzol 进行总RNA 提取, 其后采用Two-Step Real Time-PCR 试剂盒( 大连 宝生生物公司)合成cDNA 用于PCR 扩增。根据 NCBI Genebank 中大鼠Hes-1、GAPDH 基因序列 设计引物(上海生工生物工程公司)(表 1)。 在FTC2000 型荧光定量PCR 仪上进行PCR 反应: 94℃预变性2 min;94℃变性20 s,56℃退火30 s, 60℃延伸40 s,进行45 个循环。得到样品的Ct值(每个反应管内荧光信号到达设定阈值时所 经历的循环数)。采用2- △△ Ct法进行统计分析 [ △△ Ct=(Ct哮喘组Hes-1-Ct哮喘组GAPDH)-(Ct对照组Hes-1 -Ct对照组GAPDH)]。
| 表 1PCR 反应中所用引物序列 |
采用SPSS 16.0 统计软件对数据进行统计学分 析。计量资料采用均数± 标准差(x±s)表示, 两组均数间的比较采用t 检验;多组均数间比较采 用单因素方差分析,组间两两比较采用Bonferroni 法;变量间的相关分析采用Pearson 相关分析, P<0.05 为差异有统计学意义。 2 结果 2.1 HE 染色观察肺组织病理改变及Wam 测定
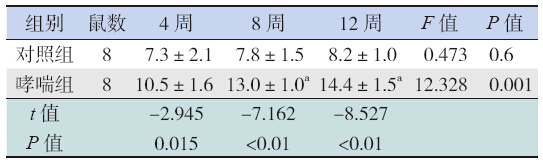
对照组大鼠肺组织结构完整,支气管管腔形 态规则,黏膜上皮完整,少见炎性细胞浸润。哮 喘组大鼠黏膜下、支气管及血管周围大量的炎性 细胞浸润、黏膜下水肿、黏液腺增生、支气管壁 明显增厚,基底膜增厚且不规则,支气管平滑肌 增厚,各时间点Wam 均明显高于相应时间点对 照组(均P<0.01);且随着激发时间延长,哮喘 组Wam 逐渐增厚,与4 周时相比,8 周及12 周时 Wam 差异有统计学意义(P<0.05)。对照组不同 时间点Wam 的差异均无统计学意义(P>0.05), 见表 2和图 1。
| 表 2各组大鼠不同时间点Wam 结果 (x±s,μm2/μm) |
 |
图 1 各组大鼠肺组织苏木精- 伊红染色结果(×400) 对照组大鼠支气管管腔通畅,黏膜上皮完整,少见 炎性细胞浸润,基底膜厚度正常、一致。哮喘组大鼠支气管上皮下及周围见大量炎性细胞浸润,黏膜水肿、黏液腺增生, 支气管平滑肌增厚、管腔狭窄,且随着激发时间延长上述改变愈加明显。 |
哮喘组血清、BAFL 中的IL-4 浓度均明显高 于同时间点对照组(均P<0.05),随着激发时间 延长,IL-4 浓度逐渐升高,与4 周时相比,8 周 及12 周时IL-4 浓度均显著升高(均P<0.01)。哮 喘组血清和BAFL 中的INF-γ 浓度均低于同时间 点对照组(均P<0.01),且随着激发时间延长, INF-γ 浓度逐渐降低,与4 周时相比,8 周及12 周时INF-γ 浓度均显著降低(均P<0.01)。见表 3~4。
| 表 3 血清中IL-4 和INF-γ 浓度 (x±s,pg/mL) |
| 表 4 BALF 中IL-4 和INF-γ 浓度 (x±s,pg/mL) |
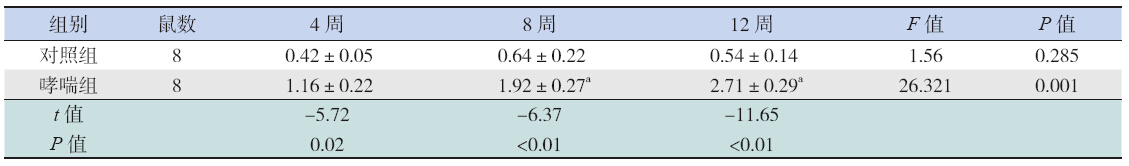
Hes-1 蛋白阳性结果呈棕黄色,主要表达于支 气管上皮细胞和平滑肌细胞。哮喘组的蛋白表达 均明显高于同时间点对照组(均P<0.01),且随 着激发时间延长,Hes-1 蛋白阳性表达增加,与4 周时相比,8 周及12 周时Hes-1 蛋白水平均显著 升高(均P<0.01)。对照组各时间点间Hes-1 蛋 白表达差异无统计学意义(P>0.05)。见表 5 和图 2。
| 表 5 大鼠肺组织Hes-1 蛋白表达 (x±s) |
 |
图 2 各组大鼠肺组织Hes-1 蛋白的表达(DAB 显色,×400) 对照组大鼠肺组织中Hes-1 蛋白表达少; 而在哮喘组大鼠支气管上皮细胞、平滑肌细胞上Hes-1 蛋白表达增多,且随着激发时间延长Hes-1 蛋白表达明 显增多。Hes-1 蛋白阳性结果呈棕黄色。 |
哮喘组Hes-1 mRNA 的表达均明显高于同时 间点对照组(均P<0.05),且随着激发时间延 长,Hes-1 mRNA 表达水平增高,与4 周时相比, 8 周及12 周时Hes-1 mRNA 水平均显著升高(均 P<0.01)。对照组各时间点Hes-1 mRNA 表达差异 无统计学意义(P>0.05)。见表 6。
| 表 6 大鼠肺组织Hes-1 mRNA 的表达 (x±s) |
哮喘组Hes-1 蛋白和mRNA 的表达与Wam 呈 正相关(分别r=0.833、0.839,均P<0.01);哮喘 组Hes-1 mRNA 的表达与血清及BALF 中INF-γ 的浓度呈负相关( 分别r=-0.929、-0.858,均 P<0.01),与血清及BALF 中IL-4 水平呈正相关(分 别r=0.883、0.924,均P<0.01);哮喘组Hes-1 蛋 白的表达与血清及BALF 中INF-γ 的浓度呈负相 关(分别r=-0.946、-0.888,均P<0.01),与血清 及BALF 中IL-4 水平呈正相关(分别r=0.938、0.946, 均P<0.01)。 3 讨论
支气管哮喘是一种影响儿童健康和生长发育 最常见的的慢性呼吸道疾病。有研究显示,哮喘 发病的中心环节是由于Th2 细胞过度活化,释放 细胞因子,并激活多种炎症细胞和结构细胞共同 参与的气道慢性炎症,炎症持续存在并且损伤反 复进行修复,最后引起气道重塑,是导致难治性 哮喘重要的病理生理学基础[4]。因此,为阻断哮喘 的发生、发展,有必要深入研究影响Th2 细胞活 化的机制并寻求相应的解决办法。
Th 细胞分化受到许多因素调节,近年来 Notch 信号通路的作用倍受关注。完整的Notch 信 号通路包括Notch 受体、配体、细胞内效应分子、 其他效应物及调节分子等。Notch 受体是一组异二 聚体组成的细胞表面受体,哺乳动物中共发现4 种Notch 受体,分别为Notch1~4,Notch 配体与受 体一样为I 型跨膜蛋白,当配体与受体结合后, Notch 受体发生2 次蛋白水解,其后释放出Notch 胞内结构域NICD 移至核内,激活下游基因如 Hes-1 等转录。目前许多研究显示Notch 信号通路 促进了Th2 细胞的分化。当肺树状突细胞受屋尘 螨刺激后,Notch 配体Jagged2 上调,促进了Th2 细胞分化[5];Notch 信号通路抑制剂GSI 可减轻哮 喘小鼠气道嗜酸性粒细胞浸润、杯状细胞化生等 炎症反应及气道反应性,降低血中IgE 水平;体外 培养的BALF 细胞经GSI 处理后Th2 细胞反应减轻, Th1 细胞因子水平增高[6]。哮喘小鼠肺内Notch 基 因表达增高[7],经Notch 信号通路另一种抑制剂 MW167 处理后,血及BALF 中IL-4 水平降低,肺 内T 细胞中IL-4mRNA 表达减少[8]。与文献报道类 似,本研究中大鼠经OVA 致敏及反复激发后,肺 组织表现出典型哮喘的改变,BALF 及血清中Th1 细胞因子INF-γ 水平降低,而Th2 细胞因子水平 IL-4 升高;同时哮喘大鼠Notch 信号通路效应因子 Hes-1 蛋白及mRNA 水平较对照组明显升高,随着 激发时间延长,增高趋势越明显;此外,Hes-1 蛋 白及mRNA 表达与Th2 炎症因子IL-4 水平呈正相关,与Th1 细胞因子INF-γ 水平呈负相关,提示 Hes-1 与哮喘大鼠Th2 细胞功能亢进有密切联系, 参与了哮喘气道慢性炎症的发生。
气道在慢性炎症的刺激下,可发生结构改变 即气道重塑,其发生与气道内炎性细胞释放的炎 症促进因子和生长因子有关。气道重塑的重要表 现之一是气道平滑肌细胞在炎症刺激下增生、增 厚[4, 9]。国内有文献报道Notch1 促进了哮喘气道重 塑,哮喘大鼠Notch1 基因表达增加,并与气道重 塑特异性指标α- 肌动蛋白呈正相关[10]。本研究 中,哮喘大鼠随着激发时间延长,炎症细胞浸润, 气道平滑肌厚度也逐渐增加,符合气道重塑表现, 与文献报道类似;同时气道平滑肌厚度与Notch 信 号通路靶基因Hes-1 蛋白及mRNA 水平呈正相关, 提示Hes-1 参与了哮喘大鼠气道重塑的发生。
综上所述,本研究中Notch 信号通路靶基因 Hes-1 蛋白及mRNA 表达与哮喘大鼠气道炎症因子 水平和气道重塑密切相关,可能参与了哮喘的发生, 阻断该信号通路可能对哮喘有潜在的治疗价值。
| [1] | Zhang WX, Li CC. Airway remodeling: a potential therapeutic target in asthma[J].World J Pediatr, 2011, 7(2): 124-128. |
| [2] | Amsen D, Antov A, Flavell RA. The different faces of Notch in T-helper-cell differentiation[J].Nat Rev Immunol, 2009, 9(2): 116-124. |
| [3] | 张维溪, 戴欢, 贺孝良, 等. 糖皮质激素调控哮喘大鼠气道 重塑中TGF2β1/Smad 信号通路的研究[J].中国药理学通报, 2009, 25(9): 1142-1146. |
| [4] | Kudo M, Ishigatsubo Y, Aoki I. Pathology of asthma[J].Front Microbiol, 2013, 4: 263. |
| [5] | Krishnamoorthy N1, Oriss TB, Paglia M, et al. Activation of c-Kit in dendritic cells regulates T helper cell differentiation and allergic asthma[J].Nat Med, 2008, 14(5): 565-573. |
| [6] | Kang JH, Kim BS, Uhm TG, et al. Gamma-secretase inhibitor reduces allergic pulmonary inflammation by modulating Th1 and Th2 responses[J].Am J Respir Crit Care Med, 2009, 179(10): 875-882. |
| [7] | 周敏, 郭雪君. Notch 基因在支气管哮喘模型小鼠肺中的表 达[J].诊断学理论与实践, 2006, 5(6): 515-518. |
| [8] | 周敏, 郭雪君. γ- 促分泌酶抑制剂阻断Notch 信号对支气管 哮喘模型小鼠气道炎症的影响[J].中华哮喘杂志( 电子版), 2012, 6(1): 7-11. |
| [9] | 崇蕾, 李昌崇, 张维溪. Notch 信号通路及其在支气管哮喘中 的作用[J].中华哮喘杂志( 电子版), 2011, 5(3): 197-200. |
| [10] | 栾斌, 冯晓霞, 杨玉霞, 等. FIZZ1及NOTCH1在哮喘中的作用[J].中国当代儿科杂志, 2011, 13(3): 219-222. |
 2014, Vol. 16
2014, Vol. 16