2. Cincinnati Children's Hospital Medical Center, USA
近年来随着医学的进步和新生儿重症监护技 术的发展,中国越来越多的早产儿得以存活,探 索有益于早产儿健康的营养管理策略,改善早产 儿的生命质量成为人们关注的热点[ 1 ]。《中华儿科 杂志》编辑委员会、中华医学会儿科学分会新生 儿学组、儿童保健学组也发布了《早产/ 低出生体 重儿喂养建议》[ 2 ],为我国早产儿喂养提供了科学 可行的指导意见。为更好地促进早产儿营养研究 与国际接轨,本文将中美两家医院的早产儿营养 支持数据进行回顾性对照研究,以期找到差距, 进一步完善早产儿营养管理,为提高我国早产儿 的生命质量做出积极努力。 1 资料与方法 1.1 研究对象
纳入标准:(1)2011 年1 月至2012 年5 月 北京协和医院儿科NICU 收治的早产儿及2011 年 1 月至2012 年1 月美国辛辛那提儿童医学中心辛 辛那提大学医院NICU 收治的早产儿;(2)出生 胎龄<32 周;(3)生后24 h 内入院。北京协和医 院儿科NICU 收治的早产儿为PUMCH 组,美国辛 辛那提儿童医学中心辛辛那提大学医院NICU 收治 的早产儿为CCHMC 组。
排除标准:(1)先天性消化道畸形;(2)遗 传代谢性疾病。
本研究分别通过北京协和医院和美国辛辛那 提儿童医学中心医学伦理委员会的批准。 1.2 收集基础数据
包括胎龄、出生体重、性别、Apgar 评分、 新生儿呼吸窘迫综合征(NRDS)发生率、机械 通气时间、脐静脉和经外周穿刺的中心静脉导管 (peripherally inserted central catheter,PICC) 置管 时间。 1.3 收集胃肠内喂养及肠外营养资料
胃肠内营养包括开奶时间、开奶量、达到足 量喂养的时间;肠外营养(PN)包括开始应用氨 基酸(amino acid,AA)的时间、每日应用AA 的 最大量、应用AA 的总量、开始应用脂肪乳(Fat) 的时间、每日应用Fat 的最大量、应用Fat 的总量、 应用PN 的时间。 1.4 统计学分析
采用SPSS 13.0 统计软件,应用Kolmogorov
Smirnov 法对计量资料进行正态性检验。符合正态
分布的数据以均数± 标准差(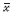 ±s)表示,非正
态分布的数据以M(P25,P75)表示。组间比较
采用t 检验或非参数统计进行分析。计数资料采用
卡方检验。P<0.05 为差异有统计学意义。
2 结果
2.1 基本情况
±s)表示,非正
态分布的数据以M(P25,P75)表示。组间比较
采用t 检验或非参数统计进行分析。计数资料采用
卡方检验。P<0.05 为差异有统计学意义。
2 结果
2.1 基本情况
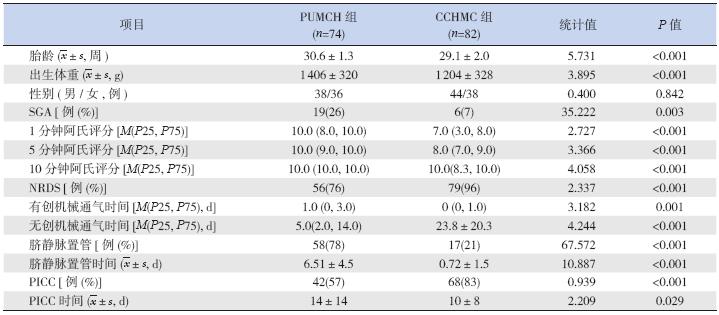
共有156 例早产儿纳入本研究,PUMCH 组 74 例,CCHMC 组82 例。两组基本情况比较见表 1, CCHMC 组的胎龄和出生体重均明显低于PUMCH 组,PUMCH 组的小于胎龄儿(SGA)百分比较高, CCHMC 组的1、5、10 min Apgar 评分明显低于 PUMCH 组,NRDS 的发生率明显高于PUMCH 组, 有创机械通气时间明显短于PUMCH 组,无创机械 通气时间明显长于PUMCH 组。PUMCH 组脐静脉 置管百分比高、置管时间长,CCHMC 组PICC 应 用百分比高,但PUMCH 组PICC 置管时间显著长 于CCHMC 组。见表 1。
|
|
表 1 两组基本情况比较 |
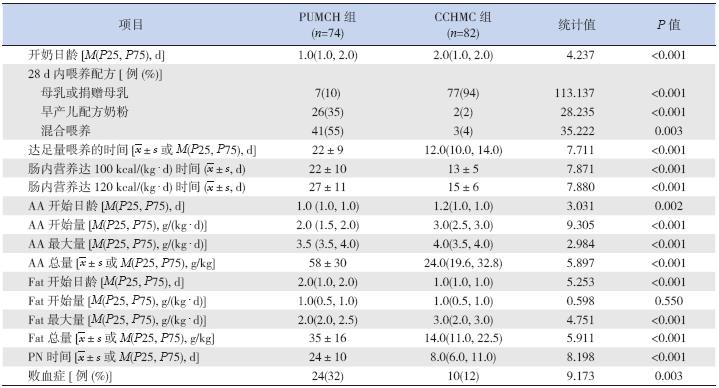
两组早产儿均同时应用了胃肠道内喂养及 肠外营养。PUMCH 组开始喂养时间早于CCHMC 组,但达到足量喂养时间显著长于CCHMC 组。 PUMCH 组开始应用AA 的时间早于CCHMC 组, 但开始应用的剂量、每日应用的最大剂量显著低 于CCHMC 组,AA 总用量显著高于CCHMC 组。 PUMCH 组开始应用Fat 的时间显著晚于CCHMC 组,每日应用的最大剂量显著低于CCHMC 组, Fat 总用量显著高于CCHMC 组。PUMCH 组的PN 时间显著长于CCHMC 组。见表 2。
|
|
表 2 两组营养支持情况比较 |
CCHMC 组坏死性小肠结肠炎(NEC)发生 率(13%,11/82) 明显高于PUMCH 组(3%, 2/74)(P=0.018)。CCHMC 组败血症的发生率 (12%)显著低于PUMCH 组(32%)(P=0.003)。 CCHMC 组败血症10 例中血培养阳性败血症3 例、 临床败血症7 例;PUMCH 组败血症24 例中血培 养阳性败血症19 例、临床败血症5 例。 3 讨论
随着早产儿存活率的逐年提高,国际上越 来越多的围产、新生儿和营养专家更加关注早产 儿的营养与健康。Lucas[ 3 ] 提出“营养程序化” 的概念,即在发育的关键期或敏感期的营养状况 将对机体或各器官功能产生长期乃至终生的影 响。如何为早产儿提供积极恰当的营养支持不但 影响早产儿的近期结局,也将影响其远期健康。 目前最常用是否达到正常胎儿在宫内的生长速率 来评价早产儿早期生长是否理想,从23~27 周的 21 g/(kg · d)( 15 g/d)到35~37 周的12 g/(kg · d() 33 g/d), 平均生长速率为16 g/(kg · d)(25 g/d)[ 4 ] 或参照 Fenton[ 5 ] 的宫内生长曲线。
为了使早产儿达到宫内生长速度,需要进行 积极的肠内肠外营养支持。早产儿的胃肠道功能 不成熟,生后早期的PN 是为早产儿提供营养的主 要途径。但由于担心PN 的安全性及耐受性,在生 后的最初几天,常给予较小剂量的AA 和Fat。直 到近年的研究结果表明生后1 周内的蛋白质和能 量供给不足直接与神经系统发育相关[ 6 ],且生后 2 h 即给予AA 2.5 g/(k · d) 是安全有效的[ 7, 8 ],促使 临床上在生后早期即开始应用较大剂量的PN。目 前大多数学者对极低出生体重儿进行PN 的推荐是 生后2 h 内开始应用AA 2~2.5 g/(kg · d),每日递增 1.0 g/kg ,至3.5 g/(kg · d);生后24 h 内开始应用Fat 1.0 g/(kg · d),递增1.0 g/(kg · d),至2~2.5 g/(kg · d)[ 9 ]。 本研究中PUMCH 组在生后第1 天即开始应用 AA,开始剂量平均为2.0 g/(kg · d)、每日最大应用剂 量为3.5 g/(kg · d),显著低于CCHMC 组的3.0 g/(kg · d) 和4.0 g/(kg · d)。PUMCH 组AA 的总量平均为58 g/kg, 而CCHMC 组仅为24.0 g/kg,PUMCH 组显著高于 CCHMC 组。两组Fat 开始剂量均为1.0 g/(kg · d), 无显著差异,但PUMCH 组大多早产儿开始应用 Fat 的时间为生后第2 天,而CCHMC 组于生后 第1 天即开始应用Fat。PUMCH 组Fat 的每日最 大应用剂量2.0 g/(kg · d),显著低于CCHMC 组的 3.0 g/(kg · d)。PUMCH 组应用Fat 的总量平均为 35 g/kg,而CCHMC 组仅为14.0 g/kg,PUMCH 组 显著高于CCHMC 组。CCHMC 组应用PN 的平 均时间仅为8 d,明显低于PUMCH 组(24 d)。 早产儿生后早期由于胃肠道内喂养不能提供足够 的营养物质,早期应用AA 和Fat 就非常必要。 PUMCH 组在生后第1 天即开始应用AA,开始应 用剂量和每日最大应用剂量较CCHMC 组小,但 CCHMC 组的早产儿胎龄和出生体重较小,对AA 的需求较大,对于多数极低出生体重儿而言,给 予AA 3.5 g/(kg · d) 已经足够。PUMCH 组在生后第 2 天开始应用Fat,可以提前至生后第1 天即开始 应用,但因PUMCH 组应用Fat 时间较长,每日应 用的最大剂量不宜过大,否则可能增加PN 相关性 胆汁淤积的发生风险。
实现全胃肠道内喂养是住院早产儿营养供给 的最终目标,因此关于早产儿喂养策略的临床实 践日益受到关注。早产儿的胃肠道功能不成熟, 早期肠内营养不能满足其全部的营养需求,但对 维持早产儿消化道结构和功能的完整性是必需的。 PUMCH 组多在生后第1 天即开始胃肠道内喂养, 但临床医生出于对早产儿喂养不耐受和NEC 的担 心,对奶量的增加慎之又慎。北京协和医院对极 (超)低出生体重儿胃肠道喂养的影响因素进行分 析[ 10, 11 ],根据各相关因素与达到足量喂养时问的相 关程度不同赋予不同的分值,制定评分体系,用 于指导早产儿的喂养。应用评分法后喂养进程加 快,达足量喂养和应用肠外营养时问显著缩短[ 10 ]。 但PUMCH 组的加奶速度仍显著慢于CCHMC 组, 达到足量喂养时间、肠内营养达到100 kcal/(kg · d) 和120 kcal/(kg · d) 时间均较CCHMC 组延迟10 d 之 多。其原因与CCHMC 组采用更为积极的胃肠道内 喂养方案及喂养多应用母乳和捐赠母乳有关。母 乳可以促进胃排空、增强胃肠动力和促进排便。 母乳中因含有多种酶而可以促进脂肪的吸收。母 乳中还含有多种激素、多肽、核苷酸、生长因子 及致炎因子的抑制因子,可以促进肠道的黏膜屏 障成熟[ 12, 13 ]。因此,母乳喂养可以减少喂养不耐 受、NEC 和院内感染的发生[ 14, 15 ]。北京协和医院 NICU 近5 年来大力提倡母乳喂养,对家长进行母 乳喂养益处的宣教,鼓励并指导早产儿母亲分娩 后即开始促进泌乳、每日送母乳至NICU,大大加 强了早产儿的母乳喂养。但有的早产儿母亲由于 疾病不能哺乳,且我国尚没有国家标准的母乳库 可提供捐赠母乳,使PUMCH 组仅7 例为母乳喂养、 41 例为混合喂养,显著少于CCHMC 组77 例的母 乳或捐赠母乳喂养,从而影响了胃肠道内喂养的 进程。CCHMC 组发生NEC 11 例(超低出生体重 儿6 例,胎龄24+6~30+2 周),显著多于PUMCH 组,其原因与CCHMC 组胎龄和出生体重较小及喂 养方案较为积极有关。另一方面,因肠内营养的 延迟而延长了PN 的时间,使PN 相关并发症如胆 汁淤积、代谢性骨病、院内感染等发生率增加, 在一定程度上延长住院时间和增加医疗负担[ 16 ]。 PUMCH 组由于PN 时间显著延长,脐静脉和PICC 置管时间均显著长于CCHMC 组,血培养阳性败 血症的发生率也显著高于CCHMC 组。CCHMC 组 的PN 时间较短,平均仅为8 d,胆汁淤积发生的 风险较低,在达到足量喂养后未常规监测血生化 指标,本研究无法得到两组胆汁淤积发生情况的 对比数据。由于两国国情、医疗保险制度和出院 标准不同,本研究未对住院时间和费用进行比较, 但PUMCH 组由于喂养进程较慢、PN 和深静脉置 管时间较长、院内感染较多,均成为延长住院时间、 增加医疗负担的重要因素。
本研究通过对中美两家医院早产儿营养管 理的对比,发现PUMCH 组的早期PN 策略与 CCHMC 组接近,但胃肠道内喂养相差甚远,从而 导致PN 时间延长、深静脉置管时间延长、败血症 发生率增高。提示对早产儿的营养管理中在胃肠 道内喂养方面还有很大可提升空间,需要推进强 化母乳喂养,采取更积极的方案加快喂养进程, 从而改善早产儿的近远期结局。
| [1] | 王丹华. 《早产/低出生体重儿喂养建议》解读[J]. 中华儿 科杂志, 2009, 47(7): 513-517. |
| [2] | 《中华儿科杂志》编辑委员会, 中华医学会儿科学分会新生 儿学组, 中华医学会儿科学分会儿童保健学组. 早产/低出 生体重儿喂养建议[J]. 中华儿科杂志, 2009, 47(7): 508-510. |
| [3] | Lucas A. Long-term programming effects of early nutritionimplications for the preterm infant[J]. J Perinatol, 2005, 25(Suppl 2): S2-S6. |
| [4] | Uhing MR, Das UG. Optimizing growth in the preterm infant[J]. Clin Perinatol, 2009, 36(1): 165-176. |
| [5] | Fenton TR. A new growth chart foo preterm babies. Babson and Benda's chart updated with recent data and a new format[J]. BMC Pediatr, 2003, 16(3): 13-23. |
| [6] | Stephens BE, Walden RV, Gargus RA, et al. First-week protein and energy intakes are associated with 18-month developmental outcomes in extremely low birth weight infants[J]. Pediatrics, 2009, 123(5): 1337-1343. |
| [7] | Ibrahim HM, Jeroudi MA, Baier RJ, et al. Aggressive early total parenteral nutrition in low-birth-weight infants[J]. J Perinatol, 2004, 24(8): 482-486. |
| [8] | te Braake FW, van den Akker CH, Wattimena DJ, et al. Amino acid administration to premature infants directly after birth[J]. J Pediatr, 2005, 147(4): 457-461. |
| [9] | Ziegler EE. Meeting the nutritional needs of the low-birthweight infant[J]. Ann Nutr Metab, 2011, 58(Suppl 1): 8-18. |
| [10] | 李正红, 董梅, 王丹华. 147 例极低和超低出生体重儿胃 肠道内喂养的影响因素[J]. 中华围产医学杂志, 201l, 14(4): 240-244. |
| [11] | 李正红, 董梅, 孙秀静, 等. 超低出生体重儿胃肠道内喂养 24 例临床分析[J]. 中华儿科杂志, 2011, 49(3): 222-225. |
| [12] | Underwood MA. Human milk for the premature infant[J]. Pediatr Clin North Am, 2013, 60(1): 189-207. |
| [13] | Menon G, Williams TC. Human milk for preterm infants: why, what, when and how?[J]. Arch Dis Child Fetal Neonatal Ed, 2013, 98(6): F559-F562. |
| [14] | Tudehope D, Fewtrell M, Kashyap S, et al. Nutritional needs of the micropreterm infant[J]. J Pediatr, 2013, 162(3 Suppl): s72-s80. |
| [15] | Tudehope DI. Human milk and the nutrional needs of preterm infants[J]. J Pediatr, 2013, 162(3 Suppl): s17-s25. |
| [16] | 王丹华. 早产儿营养管理面临的挑战[J]. 中华儿科杂志, 2012, 50(5): 321-325. |
 2014, Vol. 16
2014, Vol. 16