新生儿难治性惊厥以新生儿期起病的反复惊 厥发作,止惊药物难以控制为特点,常遗留癫癎、 发育落后等神经系统后遗症[ 1 ]。结合儿童难治性癫 癎的定义和文献报道将需长期应用2 种以上止惊 药物控制惊厥发作,或仍不能控制惊厥发作的一 类新生儿惊厥称为难治性惊厥[ 1, 2, 3, 4 ]。这类疾病常见 的病因是严重围产期脑损伤、先天遗传代谢性疾 病及脑发育畸形等,但在实际临床工作中有相当 一部分患儿难以找到明确病因。STXBP1 基因突变 是近年来发现的早发癫癎脑病的致病突变之一, 存在该突变的患儿常以新生儿期出现的难治性惊 厥起病,部分病例表现为大田原综合征或在新生 儿期后发展为婴儿痉挛症及其他类型难治性癫癎, 遗留发育落后等神经系统后遗症[ 5 ],国内尚无新生 儿惊厥患儿存在该基因突变的报道。本研究对病 因不明的新生儿难治性惊厥患儿进行STXBP1 基因 突变的检测,探讨该类疾病与STXBP1 基因突变的 关系,报告如下。 1 资料与方法 1.1 研究对象
我院新生儿病房于2012 年1 月1 日至2013 年2 月1 日收治的不明原因的难治性惊厥新生儿。 入组标准:(1)临床诊断符合新生儿难治性惊厥: 新生儿期起病的惊厥发作,应用2 种以上止惊药 物维持治疗;(2)病因不明。对每例患儿进行血 电解质、血糖、头颅磁共振、血和尿代谢筛查的 检查,除外围产期脑损伤、脑结构发育异常及先 天性代谢性疾病等引起新生儿难治性惊厥的常见 病因。符合入组条件的患儿共11 例。本研究获得 我院伦理委员会批准及家长书面知情同意。 1.2 DNA 提取
对患儿及其父母采集外周血各2 mL,EDTA 抗凝,采用试剂盒法提取淋巴细胞基因组DNA。 1.3 PCR 扩增
STXBP1 共有20 个外显子,其DNA 序列来 自GenBank,NM_003165.3。参考文献[ 6 ] 并应用 Primer 3.0 设计引物,引物由诺赛基因公司合成。 PCR 扩增编码区,反应在20 μL 的反应体系中进行: 2×GC 缓冲液10 μL,dNTPs(10 Mm)1 μL,DNA (100~200 ng/μL)1 μL,primer-F(10 μM)1 μL, primer-R(10 μM)1 μL,Taq DNA 聚合酶(2 U/ μL)1 μL ,去离子水5 μL。反应条件采用Touch Down PCR。 1.4 基因测序及结果分析
扩增产物经琼脂糖凝胶电泳鉴定后送北京诺 赛基因组研究中心有限责任公司进行测序,应用 ABI3100 测序仪正向测序。测序结果应用DNAStar 软件及Chromas 2 进行分析。如发现突变,对突变 外显子进行二次反向测序以核实,通过数据库检 索突变是否引起氨基酸改变、是否为单核苷酸多 态性(single nucleotide polymorphisms,SNPs)、是 否为已报道的致病突变。如发现致病突变,需对 突变患儿父母进行该基因检测,以明确突变来源 及是否为新发突变。 2 结果 2.1 基因检测结果
本研究收集的不明原因难治性新生儿惊厥患 儿11 例中,发现1 例患儿存在STXBP1 基因突 变,该突变为杂合突变,突变位点位于STXBP1 基 因的第16 外显子,双链DNA 之一的编码序列第 1 439 位碱基由胞嘧啶(C)变为胸腺嘧啶(T)引 起氨基酸改变,第480 个氨基酸由脯氨酸(密码 子CCG,简写P)变为亮氨酸(密码子CTG,简 写L),为错义突变:c.1439C>T(p.P480L)(图 1)。经文献查询该突变为已报道致病突变[ 5 ]。对 该患儿父母进行STXBP1 基因检测,未发现该位点 存在突变(图 1),证实该患儿突变为新生突变。 其他10 例患儿应用PCR 直接检测STXBP1 编码区 突变未发现阳性结果。
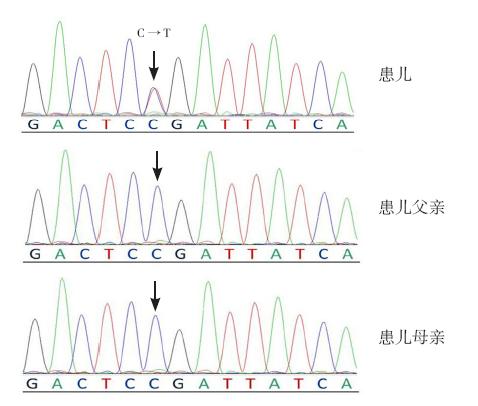 | 图 1 STXBP1 基因突变c.1439C>T(p.P480L) 患儿DNA 双链之一编码序列第1 439 位碱基由C 变为T,发生氨 基酸改变,为错义突变。患儿父母该位点未发现突变。 |
存在STXBP1 突变患儿为第2 胎第1 产,胎 龄39+1周顺产娩出,出生体重3 350 g,无产前宫 内窘迫及生后窒息。母亲孕期规律产检,无不良 产史,第1 胎为人工流产。否认妊娠期高血压及 妊娠期糖尿病病史,否认类似疾病家族史。患儿 生后第2 天起病,发作表现为双眼凝视、头部及 四肢抖动,数秒后缓解,每日1~3 次。生后20 余 天发作频繁,出现成串痉挛发作,每日10 余串, 每串10 余次,生后40 余天就诊于外院行脑电图 检查示“高度失律?”,头颅CT 未见脑结构异常 及颅内钙化点,考虑“癫癎?”,予维生素B6 静 滴、肌注鲁米那及静推安定止惊治疗仍抽搐频繁, 于生后46 d 收入我院治疗。患儿喂养困难,体重 较出生体重下降20 g。入院体查:精神差,中度 营养不良,心肺腹未见异常,双下肢肌张力增高、 腱反射活跃、不能逗笑。辅助检查:V-EEG 结果 示高度失律,部分暴发- 抑制;头颅磁共振、血 尿代谢筛查、脑脊液常规及生化检查均未见异常, 血巨细胞病毒(CMV)IgM 及尿CMV-DNA 阳性。 诊断为癫癎、痉挛发作、大田原综合征。入院后 应用托吡酯抗癫癎治疗,剂量加至每日8 mg/kg 发作无好转,由于存在CMV 感染,未予应用 ACTH,建议行生酮饮食治疗,家长放弃治疗出院, 患儿于生后4 个月死亡。
另外10 例未发现该基因突变的新生儿难治 性惊厥患儿中婴儿痉挛症2 例,其中1 例经托吡 酯、左乙拉西坦、ACTH 治疗后已4 个月无临床 发作,脑电图有所改善,为界限性脑电图表现, 发育同同龄儿;大田原综合征患儿3 例,1 例转为 婴儿痉挛症,应用托吡酯、ACTH、生酮饮食治疗 抽搐仍频繁,1 例放弃治疗,1 例临床发作减少, 应用托吡酯、ACTH 抽搐未完全控制,3 例患儿均 存在发育落后;非综合征型的早发型癫癎脑病1 例,部分性发作,脑电图表现为高度失律,患儿 起病时即伴随发育落后,院外应用苯巴比妥治疗, 入院监测苯巴比妥血药浓度在有效范围内,予逐 渐减量并加用托吡酯患儿抽搐未控制,未同意用 ACTH;其它类型癫癎4 例,其中2 例为痉挛发作, 但脑电图无高度失律或暴发- 抑制表现,1 例脑 电图为高度失律,但仅表现为部分性发作,另外1 例脑电图为高度失律,部分暴发- 抑制,临床表 现为痉挛发作和部分性发作,单用一种抗癫癎药 物均未控制临床发作。 3 讨论
新生儿难治性惊厥的患儿中有相当一部分 病因不明,为临床诊治带来了很大的困难。本研 究尝试对不明原因的新生儿难治性惊厥患儿进行 STXBP1 基因突变的检测,初步探讨该类疾病与 STXBP1 基因突变的关系,为不明原因的难治性惊 厥患儿的病因诊断提供新的思路。
STXBP1 基因位于9 号染色体长臂,其遗 传方式为常染色体显性遗传。STXBP1 基因编 码的蛋白质为突触融合蛋白,对可溶性NSF (N-ethylmaleimide-sensitive fusion protein,NSF,N- 乙 基马莱酰胺敏感因子蛋白)附着蛋白受体的形成、 钙通道感受器的敏感性和突触囊泡与突触前膜的快 速融合有调节作用,负责突触间神经递质的释放。 所以STXBP1 基因突变会引起神经递质释放的异 常,改变神经元的兴奋性,导致惊厥发作[ 7, 8, 9, 10 ]。自 2008 年Saitsu 等[ 10 ] 第1 次报道STXBP1 的基因突 变存在于大田原综合征的日本患儿中,现已发现 该基因突变与婴儿痉挛症、早发肌阵挛脑病、婴 儿游走性部分性癫癎等癫癎综合征、智力运动发 育落后和孤独症相关[ 11, 12, 13, 14, 15, 16, 17 ]。
结合既往文献报道,对存在STXBP1 基因突 变的难治性惊厥患儿的临床特点进行总结发现, 存在该基因的惊厥患儿起病早,大部分病例在生 后6 个月内起病;现有临床检查手段未发现病因; 大田原综合征和婴儿痉挛症是该基因突变引起的 两类常见的癫癎综合征;需应用多种抗癫癎药物 治疗;新生儿期惊厥不易控制,但经止惊药物积 极治疗,临床发作会在短时间内很快减少,多在2 岁以内抽搐停止,脑电图改善明显,极少数会在 停止抽搐多年后复发;起病时甚至起病前即伴有 发育落后,即使惊厥很快控制仍难以避免地出现 发育落后的表现;后期临床发作已控制,脑电图 恢复正常后,仍可出现一些行为异常的动作,如 肌张力异常、手足徐动、震颤、舞蹈样动作、啃 咬手指的刻板动作等[ 5, 6, 11, 12, 13, 14, 15 ]。而本研究重点讨论的 新生儿难治性惊厥患儿临床特点表现为新生儿期 起病,惊厥难以控制,病因不明,且多预后不良, 大田原综合征是起病时常见的癫癎综合征类型, 还有一部分患儿会在新生儿期后转变为婴儿痉挛 症,这些临床特点与前述文献所报道的部分临床 特点一致,故考虑存在对新生儿难治性惊厥患儿 进行STXBP1 基因突变检测的可能性。目前已发现 STXBP1 基因存在32 个突变类型,均为杂合突变, 尚未发现人群中的热点突变。20 个外显子除第1、 2、12、17、20 外显子外均有突变的报道,突变类 型包括错义突变、无义突变、剪切突变和缺失突变, 还有4 例患儿表现为染色体微缺失[ 5, 6, 11, 12, 13, 14, 15, 18 ]。
本研究发现的存在STXBP1 突变患儿的基因 位点与Milh 等[ 5 ] 在2011 年发表的文章中报告1 例大田原综合征患儿一致。本患儿临床特点为典 型的大田原综合征表现,新生儿早期起病的难治 性惊厥,发作形式为痉挛发作,脑电图呈现暴发- 抑制的波形,并在起病初期就存在发育落后。但 文献报道存在该突变的患儿在应用止惊治疗后惊 厥得以缓解,而本例患儿的惊厥未控制。由于本 例患儿因放弃治疗死亡,不能对止惊药物的疗效 进行正确评估,故对于存在STXBP1 基因突变患儿 的特征性临床表现,尤其是对抗惊厥药物的反应 还有待继续研究。
目前与早发难治性癫癎相关的突变基因热点 研究除STXBP1 外,还有CDKL5 和ARX,对于这 两者的研究起步要早于STXBP1。这两个基因均位 于X 染色体短臂,X 连锁遗传使其发病率有性别差 异。CDKL5 突变主要累及女婴,也以新生儿期起 病的难治性惊厥为特点,但随年龄增加可伴有Rett 样表现,如啃咬手指的刻板动作、孤独症等[ 19, 20, 21, 22, 23, 24 ]。 ARX 突变主要发生在男性患儿,患儿可伴有生殖 器的异常[ 24, 25, 26 ]。对于不存在STXBP1 基因突变的新 生儿难治性惊厥患儿可以考虑进行CDKL5 和ARX 基因突变的检测,以发现可能存在的病因。
本研究对临床未找到明确病因的新生儿难治 性惊厥患儿进行STXBP1 基因突变的检测,并发现 1 例患儿存在该基因突变,其突变率和临床表现与 现有文献报道一致,为该类疾病的临床诊治和预 后判断提供了依据,同时为进一步深入研究提供 了新的思路。
| [1] | 刘黎黎, 周丛乐, 侯新琳. 新生儿难治性惊厥的研究进展[J]. 中国当代儿科杂志, 2011, 13(1): 77-81. |
| [2] | Bassan H, Ental Y, Shany E, et al. Neonatal seizures: dilemmas in workup and management[J]. Pediatr Neurol, 2008, 38(6): 415-421. |
| [3] | Garcias Da Silva LF, Nunes ML, Da Costa JC. Risk factors for developing epilepsy after neonatal seizures[J]. Pediatr Neurol, 2004, 30(4): 271-277. |
| [4] | Ramos LJ, Aguilera LP, Aguirre R, et al. Early prediction of refractory epilepsy in childhood[J]. Seizure, 2009, 18(6): 412-416. |
| [5] | Milh M, Villeneuve N, Chouchane M, et al. Epileptic and nonepileptic features in patients with early onset epileptic encephalopathy and STXBP1 mutations[J]. Epilepsia, 2011, 52(10): 1828-1834. |
| [6] | Saitsu H, Kato M, Okada I, et al. STXBP1 mutations in early infantile epileptic encephalopathy with suppression-burst pattern[J]. Epilepsia, 2010, 51(12): 2397-2405. |
| [7] | Rizo J, Rosenmund C. Synaptic vesicle fusion [J]. Nat Struct Mol Biol, 2008, 15(7): 665-674. |
| [8] | Wojcik SM, Brose N. Regulation of membrane fusion in synaptic excitation-secretion coupling: speed and accuracy matter[J]. Neuron, 2007, 55(1): 11-24. |
| [9] | Burkhardt P, Hattendorf DA, Weis WI, et al. Munc18a controls SNARE assembly through its interaction with the syntaxin N-peptide[J]. Embo J, 2008, 27(7): 923-933. |
| [10] | Saitsu H, Kato M, Mizuguchi T, et al. De novo mutations in the gene encoding STXBP1 (MUNC18-1) cause early infantile epileptic encephalopathy[J]. Nat Genet, 2008, 40(6): 782-788. |
| [11] | Shen J, Tareste DC, Paumet F, et al. Selective activation of cognate SNAREpins by Sec1/Munc18 proteins[J]. Cell, 2007, 128(1): 183-195. |
| [12] | Deprez L, Weckhuysen S, Holmgren P, et al. Clinical spectrum of early-onset epileptic encephalopathies associated with STXBP1 mutations[J]. Neurology, 2010, 75(13): 1159-1165. |
| [13] | Hamdan FF, Piton A, Gauthier J, et al. De novo STXBP1 mutations in mental retardation and nonsyndromic epilepsy[J]. Ann Neurol, 2009, 65(6): 748-753. |
| [14] | Otsuka M, Oguni H, Liang JS, et al. STXBP1 mutations cause not only Ohtahara syndrome but also West syndrome-result of Japanese cohort study[J]. Epilepsia, 2010, 51(12): 2449-2452. |
| [15] | Mignot C, Moutard ML, Trouillard O, et al. STXBP1-related encephalopathy presenting as infantile spasms and generalized tremor in three patients[J]. Epilepsia, 2011, 52(10): 1820-1827. |
| [16] | Chelly J, Khelfaoui M, Francis F, et al. Genetics and pathophysiology of mental retardation[J]. Eur J Hum Genet, 2006, 14(6): 701-713. |
| [17] | Zoghbi HY. Postnatal neurodevelopmental disorders: meeting at the synapse?[J]. Science, 2003, 302(5646): 826-830. |
| [18] | Hamdan FF, Gauthier J, Dobrzeniecka S, et al. Intellectual disability without epilepsy associated with STXBP1 disruption[J]. Eur J Hum Genet, 2011, 19(5): 607-609. |
| [19] | Archer HL, Evans J, Edwards S, et al. CDKL5 mutations cause infantile spasms, early onset seizures, and severe mental retardation in female patients [J]. J Med Genet, 2006, 43(9): 729-734. |
| [20] | Weaving LS, Christodoulou J, Williamson SL, et al. Mutations of CDKL5 cause a severe neurodevelopmental disorder with infantile spasms and mental retardation [J]. Am J Hum Genet, 2004, 75(6): 1079-1093. |
| [21] | Tao J, Van Esch H, Hagedorn-Greiwe M, et al. Mutations in the X-linked cyclin-dependent kinase-like 5 (CDKL5/STK9) gene are associated with severe neurodevelopmental retardation[J]. Am J Hum Genet, 2004, 75(6): 1149-1154. |
| [22] | Scala E, Ariani F, Mari F, et al. CDKL5/STK9 is mutated in Rett syndrome variant with infantile spasms[J]. J Med Genet, 2005, 42(2): 103-107. |
| [23] | Rosas-Vargas H, Bahi-Buisson N, Philippe C, et al. Impairment of CDKL5 nuclear localization as a cause for severe infantile encephalopathy [J]. J Med Genet, 2008, 45(3): 172-178. |
| [24] | Pavone P, Spalice A, Polizzi A, et al. Ohtahara syndrome with emphasis on recent genetic discovery [J]. Brain Devel, 2012, 34(6): 459-468. |
| [25] | Kato M, Saitoh S, Kamei A, et al. A longer polyalanine expansion mutation in the ARX gene causes early infantile epileptic encephalopathy with suppression-burst pattern (Ohtahara syndrome)[J]. Am J Hum Genet, 2007, 81(2): 361-366. |
| [26] | Kato M, Das S, Petras K, et al. Polyalanine expansion of ARX associated with cryptogenic West syndrome[J]. Neurology, 2003, 61(2): 267-276. |
 2014, Vol. 16
2014, Vol. 16


