新生儿缺氧缺血性脑病(hypoxic-ischemic encephalopathy,HIE)是导致新生儿死亡和婴幼儿 神经系统功能障碍的主要原因之一。近年来,促 红细胞生成素(erythropoietin,EPO)被认为是最有 前途的防治新生儿脑损伤的药物之一[ 1 ],能促进 HIE 患儿神经功能的早期恢复[ 2 ],并可减少HIE 后遗症的发生[ 3 ]。但其作用机制尚不明确。神经元 特异性烯醇化酶(neuron-specific enolase,NSE)是 神经元的特异性生化标志物,S-100B 是神经胶质 细胞的标记蛋白,正常情况下,血中NSE 和S-100B 含量甚少,神经细胞损伤时含量增加,因此两者 变化能及时反映神经细胞的受损状态。那么EPO 对HIE 的作用是否与NSE 或S-100B 有关呢?目前 国内外未见有关报道。因此本研究拟通过检测HIE 患儿EPO 治疗前后血清中NSE、S-100B 的变化, 了解EPO 对HIE 的神经细胞是否有修复作用,探 讨EPO 治疗脑损伤的作用机制,为临床应用提供 依据。 1 资料与方法 1.1 研究对象
为2012 年5 月至2013 年8 月入住我院的HIE 患儿40 例,诊断及分度参照HIE 诊断标准和临床 分度标准[ 4 ]。纳入病例符合下列条件: (1)入院 日龄≤ 24 h,出生体重≥ 2 500 g 的足月新生儿; (2)无严重先天畸形,如膈疝、染色体异常或脑 发育不全;(3)无头部产伤或颅骨骨折导致的大 量颅内出血、无严重呼吸道阻塞性疾病、无贫血。 排除标准:疗程小于7 d 者,包括未开始治疗即死 亡或放弃治疗者。
40 例HIE 患儿随机分为两组:常规治疗组 和EPO 治疗组(各20 例)。另选择产科同期出生 1 d 的健康足月新生儿20 例作正常对照组。 1.2 治疗方法
两组患儿常规治疗均根据新生儿HIE 治疗方 案[ 5 ] 进行。EPO 治疗组于出生后第2 天给予EPO (雪达升重组人红细胞生成素注射液 3 000 IU/支, 西林瓶包装,哈药集团生物工程有限公司提供), 按每日200 IU/kg 静脉注入,连续用药7 d。 1.3 标本采集
两组HIE 患儿均于出生后第1 天和第9 天(即 EPO 治疗前和治疗后) 分别采集股静脉血3 mL, 同时采取正常对照组新生儿股静脉血3 mL, 置于无热原和内毒素的试管内,3 000 rpm 离心 10 min,分离血清,去除溶血标本,每份血清分为 两份,按组标记,-70℃冰箱保存待测。 1.4 血清NSE 和S-100B 检测
采用双抗体夹心ABC-ELISA 法进行血清NSE 和S100B 的检测。ELISA 试剂盒由上海恒远生物 科技有限公司提供。 1.5 统计学分析
应用SPSS 20.0 统计学软件进行统计学分析。
计数资料采用卡方检验。计量资料用均数± 标准
差(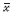 ±s)表示,进行正态检验和方差齐性检验,
两组间比较采用配对设计的t 检验,多组间比较采
用单因素方差分析,均数的两两比较采用LSD 检
验。P<0.05 为差异有统计学意义。
2 结果
2.1 3 组新生儿一般资料比较
±s)表示,进行正态检验和方差齐性检验,
两组间比较采用配对设计的t 检验,多组间比较采
用单因素方差分析,均数的两两比较采用LSD 检
验。P<0.05 为差异有统计学意义。
2 结果
2.1 3 组新生儿一般资料比较
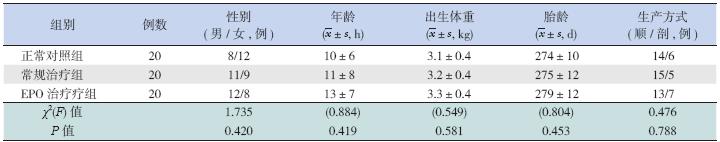
常规治疗组20 例(轻度6 例,中度13 例, 重度1 例),EPO 治疗组20 例( 轻度7 例,中 度11 例,重度2 例),其中中重度HIE 患儿 为68%。两组患儿病情分度差异无统计学意义 (χ2=0.577,P=0.749);3 组新生儿的性别、年龄、 出生体重、胎龄、生产方式差异均无统计学意义 (P>0.05),见表 1。
|
|
表 1 3 组新生儿一般资料比较 |
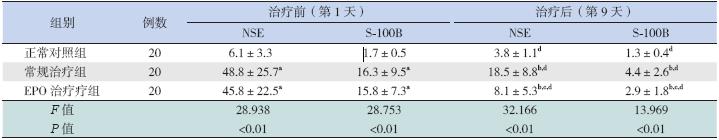
治疗前2 组HIE 患儿血清中NSE、S-100B 的 水平高于正常对照组;而2 组HIE 患儿之间血清 中NSE、S-100B 的水平差异无统计学意义。
对照组出生后第9 天NSE、S-100B 水平较第 1 天明显下降(P<0.01);2 组HIE 患儿第9 天血 清NSE、S-100B 水平也均低于第1 天,表明在正 常情况下和疾病状态下,NSE、S-100B 水平在新 生儿体内可能存在自然降低过程。
治疗后(生后第9 天),HIE 常规治疗组和 EPO 治疗组血清中NSE、S-100B 水平仍高于正常 对照组(P<0.05),其中EPO 治疗组血清中NSE、 S-100B 水平低于常规治疗组(P<0.05),见表 2。
|
|
表 2 3 3 组新生儿血清NSE 和S-100B 水平的比较 |
NSE是胞浆内糖酵解烯醇化酶神经元的形态, 生物半衰期约24 h[ 6 ],主要存在于神经元和神经内 分泌细胞中,正常血液中NSE 含量甚微,波动范 围小,相对稳定,脑损伤后神经细胞受损,血脑 屏障破坏,NSE 释放入脑脊液及血液。研究表明, NSE 可以作为早期判断神经细胞损伤的灵敏指标, 且与HIE 病情严重程度成正相关,可随HIE 病程 的延长,病情的好转而逐渐降低[ 7 ]。血清NSE 的 水平可用来评估HIE 的严重程度[ 8 ]。S-100B 是一 种酸性钙结合蛋白,生物半衰期为0.5 h,被认为 是神经胶质细胞的特异性标志物。正常情况下血 清中含量甚微,研究显示,血清S-100B 蛋白水 平首先取决于脑损伤的范围和严重程度[ 9 ];血清 S-100B 水平可以作为脑损伤的敏感性和特异性标 记物[ 10, 11 ]。本研究结果显示,HIE 患儿经历了缺 氧缺血以后,血清中NSE、S-100B 水平均显著升 高,表明HIE 患儿的神经元及神经胶质细胞均受 到损伤。由此可见,临床上遇有缺氧缺血病史并 有神经系统症状和体征的患儿,同时检测外周血 中NSE、S-100B 水平的变化,有助于了解患儿有 无神经元及神经胶质细胞损伤。
研究发现,中枢神经系统有EPO 及其受体 (EPO-R)的表达,在缺氧缺血刺激下表达增加, 并证实EPO 具有神经营养及神经保护作用[ 12 ];动 物研究发现,EPO 可以减少神经细胞凋亡,改善 脑功能障碍[ 13 ],外源性EPO 可抑制细胞死亡途径 的激活,促进神经细胞和血管的再生,对多种脑 损伤动物模型具有神经保护作用[ 14, 15, 16, 17 ],国内外研 究表明,EPO 在治疗HIE 时,可以保护因缺氧缺 血损害的神经细胞,可以促进HIE 患儿的神经行 为发育,改善HIE 的预后,减少后遗症的发生[ 18, 19, 20 ]。
本研究结果显示,健康新生儿和两组HIE 患 儿第9 天血清NSE、S-100B 水平均低于第1 天 水平,表明在正常情况下和疾病状态下,NSE、 S-100B水平在新生儿体内可能存在自然降低过程。 目前国内尚未见文献报道这一现象。新生儿从宫 内到外界环境中,经历了分娩这一特殊过程,体 内多种生化指标可随日龄的增加而变化(如白细 胞、心肌酶、胆红素等)。因此,要把新生儿血 清NSE、S-100B 水平的变化作为判断神经元和神 经胶质细胞损伤及其损伤程度的指标时,应当考 虑新生儿日龄因素对其造成的影响。本研究结果 显示,治疗后(生后第9 天)HIE 患儿常规治疗组 和EPO 治疗组血清中NSE、S-100B 水平仍高于正 常对照组,表明经过7 d 治疗后神经元和神经胶质 细胞尚未完全恢复,仍需继续治疗。可能是因为 本研究选择的HIE 患儿中重度的比例(68%)较大, 脑损伤的恢复需要较长时间所致。
本研究结果显示,生后第9 天EPO 治疗组 血清中NSE、S-100B 水平低于常规治疗组,提示 EPO 对神经元及神经胶质细胞均有修复作用。其 修复机制可能为:在HIE 患儿中,缺氧使血脑屏 障的通透性增加,也使神经元和星形胶质细胞转 录EPO-R 增加,外源性的EPO 通过血脑屏障进入 脑脊液,与EPO-R 结合,使EPO 受体蛋白,信号 蛋白Janus 家族酪氨酸蛋白激酶2(JAK-2)构象 发生变化,诱导EPO 受体和JAK-2 的磷酸化,从 而起到抗凋亡和对脑白质的保护作用[ 12 ];EPO 直 接调节神经元祖细胞和干细胞的增殖和分化,增 强神经祖细胞的产生,促进生产神经前体细胞, 从而达到对神经元及神经胶质细胞的再生和修复 作用。EPO 对HIE 患儿脑损伤的具体修复机制以 及EPO 在临床应用时的疗程和剂量及其不良反应 还有待进一步研究。
| [1] | Kumral A, Tuzun F, Oner MG, et al. Erythropoietin in neonatal brain protection: the past, the present and the future[J]. Brain Dev, 2011, 33(8): 632-643. |
| [2] | 康文清, 朱长连, 熊虹, 等. 重组人促红细胞生成素治疗新 生儿缺氧缺血性脑病的疗效[J]. 实用儿科临床杂志, 2006, 21(2): 86-87. |
| [3] | 郭敏, 巨容, 刘秀香, 等. 重组人促红细胞生成素治疗新生 儿缺氧缺血性脑病疗效分析[J]. 中华神经医学杂志, 2007, 6(5): 523-525. |
| [4] | 中华医学会儿科学分会新生儿学组. 新生儿缺氧缺血性脑病诊断标准[J]. 中国当代儿科杂志, 2005, 7(2): 97-98. |
| [5] | 周丛乐, 宋琳琳. 新生儿缺氧缺血性脑病[M]//金汉珍, 黄德 珉, 官希吉. 实用新生儿学. 第3 版. 北京: 人民卫生出版社, 2004: 770. |
| [6] | Tiainen M, Roine RO, Pettila V, et al. Serum neuron-specific enolase and S-100B protein in cardiac arrest patients treated with hypothermia[J]. Stroke, 2003, 34(12): 2881-2886. |
| [7] | 戴宏清, 罗艳华. 新生儿缺氧缺血性脑病脑电图背景活动及血清神经元特异性烯醇化酶变化与临床意义[J]. 中国当代儿 科杂志, 2009, 11(3): 173-176. |
| [8] | Celtik C, Acunas B, Oner N, et al. Neuron-specific enolase as a marker of the severity and outcome of hypoxic ischemic encephalopathy[J]. Brain Dev, 2004, 26(6): 398-402. |
| [9] | Nygaard O, Langbakk B, Romner B. Age-and sex-related changes of S-100 protein concentrations in cerebrospinal fluid and serum in patients with no previous history of neurological disorder[J]. Clin Chem, 1997, 43(3): 541-543. |
| [10] | Muller B, Evangelopoulos DS, Bias K, et al. Can S-100B serum protein help to save cranial CT resources in a peripheral trauma centre? A study and consensus paper[J]. Emerg Med J, 2011, 28(11): 938-940. |
| [11] | Wojtczak-Soska K, Lelonek M. S-100B protein: An early prognostic marker after cardiac arrest[J]. Cardiol J, 2010, 17(5): 532-536. |
| [12] | Xiong T, Qu Y, Mu D, et al. Erythropoietin for neonatal brain injury: opportunity and challenge[J]. International journal of developmental neuroscience: the official journal of the International Society for Developmental Neuroscience, 2011, 29(6): 583-591. |
| [13] | Zhou TF, Yu JG.Recombinant human erythropoietin attenuates neuronal apoptosis and cognitive defects via JAK2/STAT3 signaling in experimental endotoxemia[J]. J Surg Res, 2013, 183(1): 304-312. |
| [14] | Hempel C, Hyttel P, Staalso T, et al. Erythropoietin treatment alleviates ultrastructural myelin changes induced by murine cerebral malaria[J]. Malar J, 2012, 11: 216. |
| [15] | Bendix I, Schulze C, Cv H, et al. Erythropoietin modulates autophagy signaling in the developing rat brain in an in vivo model of oxygen-toxicity[J]. Int J Mol Sci, 2012, 13(10): 12939-12951. |
| [16] | Fan X,van Bel F, Kooij MA, et al. Hypothermia and erythropoietin for neuroprotection after neonatal brain damage[J]. Pediatr Res, 2013, 73(1): 18-23. |
| [17] | Fang AY, Gonzalez FF, Sheldon RA, et al. Effects of combination therapy using hypothermia and erythropoietin in a rat model of neonatal hypoxia-ischemia[J]. Pediatr Res, 2013, 73(1): 12-17. |
| [18] | 王英娟, 潘凯丽, 赵晓莉, 等. 促红细胞生成素治疗新生儿缺 氧缺血性脑病疗效观察[J]. 中国当代儿科杂志, 2011, 13(11): 855-858. |
| [19] | Zhu C, Kang W, Xu F, et al. Erythropoietin improved neurologic outcomes in newborns with hypoxic-ischemic encephalopathy[J]. Pediatrics, 2009, 124(2): e218-e226. |
| [20] | Wu YW, Bauer LA, Ballard RA, et al. Erythropoietin for neuroprotection in neonatal encephalopathy: safety and pharmacokinetics[J]. Pediatrics, 2012, 130(4): 683-691. |
 2014, Vol. 16
2014, Vol. 16