1999 年11 月至2010 年1 月在我院接受 UCBT 的恶性疾病患儿37 例,其中34 例非血缘 相关,3 例血缘相关。37 例患儿中,男25 例,女 12 例,中位年龄5.7 岁(1.0~12.0 岁),中位体重 20 kg(10~56 kg)。移植前行病毒检测:乙型肝炎 表面抗原(HBsAg)均呈阴性;丙型肝炎病毒核糖 核酸-PCR 仅1 例为阳性,其余均为阴性;EB 病 毒(EBV)IgM 和巨细胞病毒(CMV)IgM 均阴性; 仅5 例EBV-IgG 和3 例CMV-IgG 为阴性,其余均 为阳性。
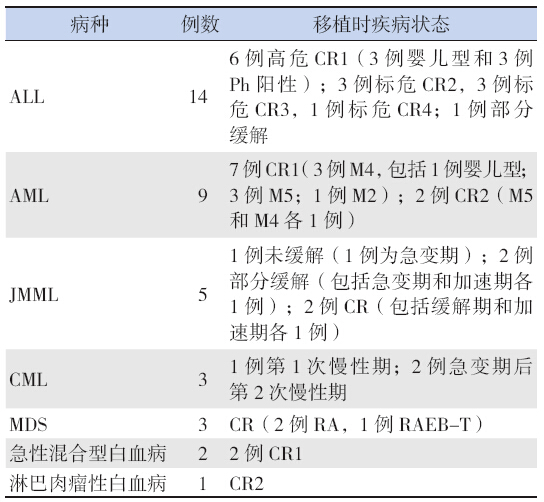
37 例患儿中,急性淋巴细胞性白血病(ALL) 患儿14 例,急性髓细胞性白血病(AML)患儿9 例, 幼年粒单细胞白血病(JMML)患儿5 例,慢性粒 细胞白血病(CML)和骨髓增生异常综合征(MDS) 患儿各3 例,急性混合型白血病患儿2 例,淋巴 肉瘤性白血病患儿1 例,见表 1。
| 表 1 37 例移植患儿一般情况 |
白血病分型(高危、中危、低危;M 分型) 依据和预后判别标准(未缓解、部分缓解、完全 缓解)见文献[3, 4, 5, 6]。 1.2 脐血资料
脐血来源:山东脐血库12 份,广东脐血库 10 份,北京脐血库8 份,天津脐血库、四川脐血 库和上海脐血库各2 份,浙江脐血库1 份。34 例 非血缘相关,3 例血缘相关。脐血进行了HLA-A 和B 位点低分辨检测,HLA-DR 位点高分辨检测。 HLA 配型6/6 相合5 例,5/6 相合12 例,4/6 相合 11 例,3/6 相合9 例。检测乙型和丙型肝炎病毒核 糖核酸-PCR 均为阴性,CMV-IgM 和IgG 均阴性。 0 d 回输脐血有核细胞中位数为6.2(2.6~19.3) ×107/kg,CD34+ 细胞的中位数为2.7(0.3~10.1) ×105/kg。 1.3 预处理方案
根据疾病类型、移植时疾病状态及年龄, 选用不同的方案,均加用兔抗人胸腺细胞免疫球 蛋白(ATG 10 mg/kg,商品名为复宁),36 例采 用清髓性预处理,包括28 例采用白消安[Bu 0.8~ 1.2 mg/kg,16 次] + 环磷酰胺(CTX 120~200 mg/kg) 为主方案,其中10 例加马法兰[ 包括5 例JMML、 4 例婴儿白血病,1 例CML 急变期,9 例加足叶 乙甙,3 例加阿糖胞苷;8 例采用全身放疗(TBI 12~13.5 Gy,分成4~9 次)+CTX(120 mg/kg) +ATG 方案(均为ALL)。1 例为ALL 因严重肝功 能损害,采用非清髓性预处理,方案为氟达拉滨(Flu 125 mg/m2)+CTX(60 mg/kg)+TBI(2 Gy)。 1.4 急性移植物抗宿主病预防方案
急性移植物抗宿主病(GVHD) 的预防采 用环孢霉素A(CsA)为基础的方案,2 例仅用 CsA,13 例加用小剂量甲基强的松龙(MP), 6 例加用吗替麦考酚酸酯(MMF),16 例采用 CsA+MP+MMF。CsA 从移植前1 d 开始按照每日 3 mg/kg 持续静脉滴注24 h,待肠道恢复正常时改 口服。使用CsA 期间,采用荧光偏振免疫测定法, 每周监测CsA 血药浓度,根据结果调整剂量,使 其维持在200~400 ng/dL,移植后180 d,逐渐减量 停药。 1.5 并发症的预防和治疗
给予前列地尔注射液、低分子肝素预防肝静 脉闭塞症;移植前静脉滴注更昔洛韦,移植后口服 阿昔洛韦预防病毒感染,移植后WBC ≥ 0.5×109/L 时采用RT-PCR 每周监测CMV 抗原拷贝值,如 CMV>1×103 copies/mL 作为CMV 病毒复燃依据, 给予更昔洛韦和(或)膦甲酸钠。 1.6 支持治疗
预处理同时给予水化、碱化,回输后予输注 丙种球蛋白。酌情予脂肪乳、氨基酸、人血白蛋 白等;当血小板和血红蛋白分别低于20×109/L 和 70 g/L 时输注经60Co 20 Gy 照射及相应过滤器过滤 的机采血小板和红细胞悬液。自移植后1 d 开始至 WBC>10×109/L 给予粒细胞刺激因子。 1.7 植入证据的检测
移植后WBC ≥ 2.0×109/L 时,采骨髓行如下 检测:对于HLA 不相合采用分子生物学PCR-SSO 方法检测不同位点基因分型;对于不同性别采用 性染色体核型分析;对于HLA 全相合且同性别者 采用荧光标记复合扩增短串联重复(STR)位点检 测,供者达95%以上为完全嵌合。 1.8 主要观察指标
(1)造血重建:粒系和血小板植入。粒系植 入以中性粒细胞绝对值连续3 d ≥ 0.5×109/L 为标 准(确定第1 天为粒系植入天数);血小板植入 以脱离血小板输注且血小板计数连续7 d ≥ 20× 109/L 为标准(确定第1 天为血小板植入天数)。 (2) 急性GVHD 的发生。(3) 并发症情况。 (4)结果随访及长期生存分析。 1.9 统计学分析
采用SPSS 13.0 统计软件对数据进行统计学分 析,采用秩和检验进行中位值组间数据的分析, 用Kaplan-Meier 方法进行总生存率分析、以方差 分析和Log-rank 检验对各组进行统计。2 例未植入 者进行急性GVHD 相关分析被排除;移植后100 d 内死亡的10 例病例未纳入慢性GVHD 的分析。 2 结果 2.1 造血重建
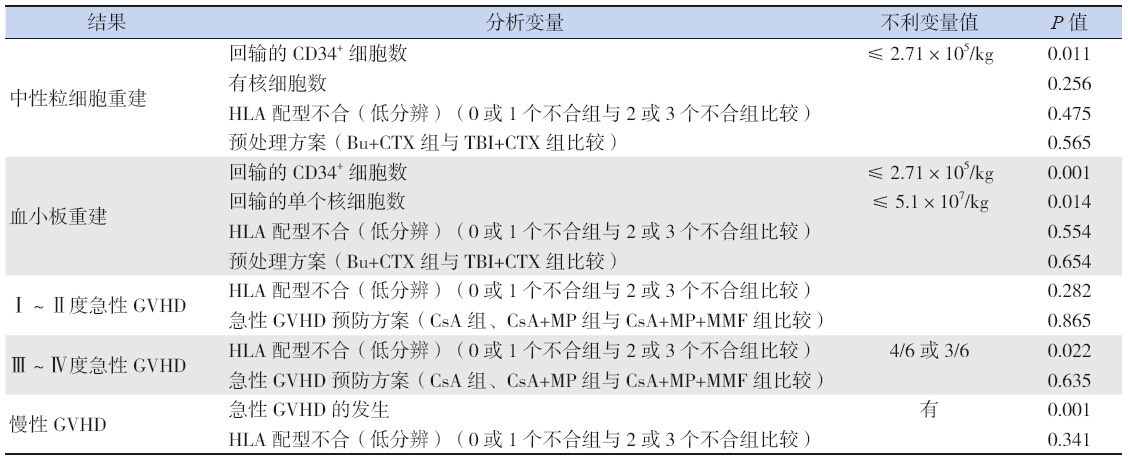
除2 例外,35 例粒系均植入,植入中位时 间是+12 d(+8 d ~ +35 d),其中 CD34+ 细胞数 >2.71×105/kg 组较≤ 2.71×105/kg 组粒细胞植入 时间提前,分别为13 d 和17 d(P=0.036),35 d 植入的累积发生率为95%(35/37)。8 例患儿在 血小板植入前死亡,血小板植入中位时间是+25 d (+16~+42 d),42 d 植入的累积发生率为78% (29/37)。影响造血重建的变量因素分析见表 2。
| 表 2 影响不同结果的变量因素的分析 |
在可评估的35 例患儿中,17 例(49%)发生 急性GVHD,其中Ⅰ ~ Ⅱ度发生率为37%(13/35), Ⅲ ~ Ⅳ 度急性GVHD 发生率为11%(4/35), 发生Ⅱ ~ Ⅳ 度急性GVHD 的中位时间是+28 d (+13 d ~ +104 d)。2 例Ⅳ度患儿加用MP 和CD25 单抗,未控制,发病平均年龄为1.1 岁,均为HLA 配型3 个位点不合者;3 例发生慢性GVHD,其中 局限型2 例,广泛型1 例。影响GVHD 发生的变 量因素分析见表 2。 2.3 移植相关其他并发症与治疗
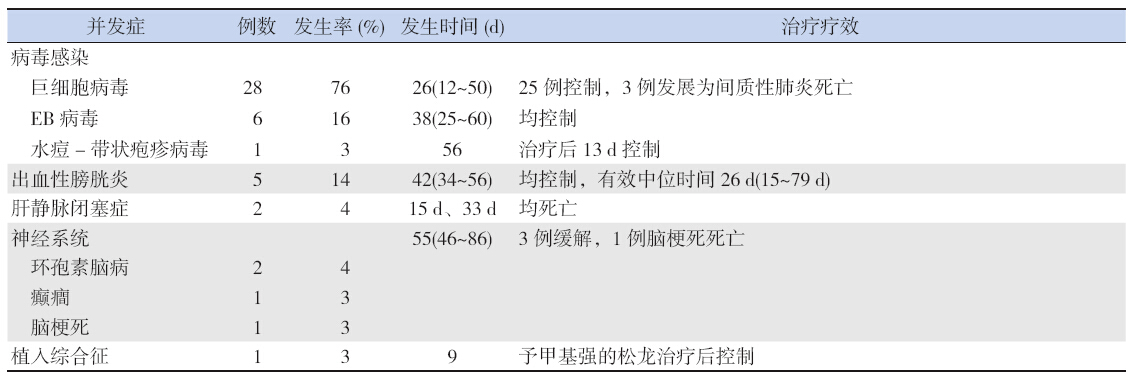
移植相关并发症具体情况见表 3,可见28 例 发生CMV 感染,其发生率高达76%,发生中位时 间约26 d,25 例可控制,而3 例进展为间质性肺 炎而死亡。秩和检验显示,CMV 感染率与预处理 方案无关(P=0.672),与急性GVHD 预防方案有 关(P=0.036)。
| 表 3 移植相关并发症发生情况 |
随访截至2012 年11 月,随访中位时间54 (34~156)个月,现存活20 例,包括1 例移植时 合并丙型肝炎和1 例并发移植后淋巴细胞增殖性 疾病(PTLD)患儿[7]。死亡17 例,其中7 例因原 发病复发(3 例JMML,1 例高危ALL,1 例淋巴肉瘤性白血病,2 例AML)死亡,1 例部分缓解 ALL 患儿因发生Ⅳ度急性GVHD 合并感染死亡,9 例因感染(3 例CMV 间质性肺炎,2 例霉菌性肺炎, 4 例未明病原体)死亡。原发病复发发生的中位时 间是6(1.5~8)个月,复发率为19%(7/37);移 植相关死亡发生的中位时间是139 d(36~457 d), 5 年的移植相关病死率为27%(10/37)。2 年整体 生存率(OS)和无病生存率(DFS)分别为75% 和58%,5 年OS 和DFS 分别为57% 和41%, Kaplan-Meier 生存曲线见图 1。
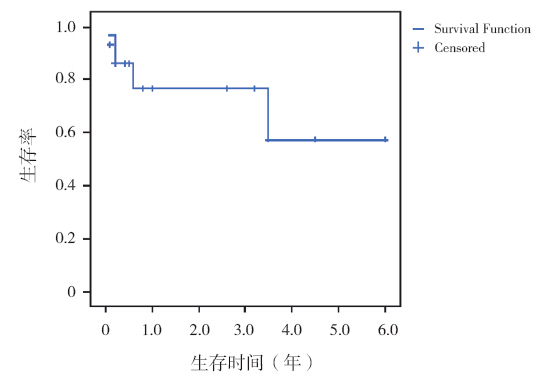 |
图 1 移植后生存曲线分析 |
与其他来源的造血干细胞相比,脐血移植植 入失败率较高[8, 9],分析其原因为:其一,回输的 脐血细胞数低,尤其是CD34+ 细胞数;其二,供 受者之间HLA 配型不合比例高以及配型方向有关 所致[10, 11]。本研究结果显示:恶性疾病粒系和血 小板的植入率分别为95% 和78%。粒系和血小板 植入率与CD34+ 细胞数有关,粒系植入率与有核 细胞数无关,但血小板植入率与有核细胞数有关。 此结果与其他文献报道相同[9, 10, 11, 12],不同之处在于植入率与HLA 配型不合无关,原因需要进一步明确。 国外相关文献报道,粒系和血小板植入的中位天 数分别为20 d 和60 d [9]。本研究中粒系和血小板 植入的中位天数别是12 d 和25 d,显示本组病例 植入时间较快,这与输入CD34+ 细胞数高成正比, 这也证实了脐血植入与CD34+ 细胞数有关。本研 究结果也显示,粒系与血小板植入率与预处理方 案均无关系。 因此,为了提高此类疾病的植入率, 同时减少预处理的毒副作用,有如下措施,首先, 加大回输脐血的CD34+ 细胞数;其次,在预处理时, 加用如Flu 等药物来加强免疫抑制[13],尽量减少 TBI 的远期毒副作用;第三,要尽量提高HLA 配 型的相合程度,同时选择脐血时需要考虑其方向 性[10, 11];第四,可采用输注第三方脐带间充质干 细胞具有造血支持性能来纠正脐血移植后移植物 排斥现象,起到了脐血移植后中性粒细胞植入时 间提前[14]。
自脐血应用治疗恶性疾病以来,因其免疫原 性弱,与非血缘骨髓移植(UD-BMT)相比,非血 缘UCBT(UD-UCBT)后原发病的复发率和整体生 存率一直是学术界的关注热点,Eapen 等[15] 比较 了UD-BMT 和UD-UCBT 治疗儿童白血病的临床疗 效,得出全相合UD-BMT 和UD-UCBT 后的复发率 分别为39.4% 和19.4%~31.4%,差异无统计学意义, 且两个位点不合UD-UCBT 后复发率比UD-BMT 还 低。本研究结果显示,恶性疾病UCBT 后复发率 为19%,与国外资料相当。Shi-Xia[16] 将UD-UCBT 和UBMT 治疗儿童恶性疾病进行了meta 分析,得 出由于UD-UCBT 后造血恢复延迟,使其植入失败 率和早期TRM 高,但因为UD-UCBT 后GVHD 发 生率低,故两者长期EFS 无明显差异。
本研究CMV 复燃的发生率高,达76%,其 中有3 例发生CMV 肺炎而死亡,这与脐血移植后 的抗病毒细胞介导的免疫反应的重建和保护能力 低有关[17, 18, 19],因为移植后CMV 感染与移植物的类 型和患儿移植前感染情况有关,脐血移植后CMV 感染率、病毒的复制高峰值、发展为CMV 病及 感染的时间均较骨髓和外周有所提高和延长,本 研究显示CMV 感染率与预处理方案无关,与急性 GVHD 预防方案有关,提示为了降低急性GVHD 的发生率,本研究采用的加强免疫抑制的预防方 案,这样反而增加了CMV 复燃的几率,因此为了 降低CMV 感染率,将尽量减轻免疫抑制,同时本 组病例CMV 发生率高也与这组患儿移植前CMV 血清约90% 阳性有关。Albano 等[20] 认为移植后 CMV 感染者较没有感染者有较高的排斥率。因此 对于脐血移植后,应该采用更加积极的措施来预 防和治疗CMV 感染,如采用口服缬更昔洛韦或静 脉输注泛昔洛韦或更昔洛韦预防脐血移植后CMV 感染[21]。
本组病例移植相关病死率为37%,肺部感染 是死亡的主要原因,这同样与UD-UCBT 后免疫恢 复慢[22],其次为了促进脐血的植入,采用清髓性 预处理,反而增加了感染机会。相关文献报道, UD-UCBT 清髓性的移植相关病死率为30%~50%, 而非清髓性的移植相关病死率为14%~24%[23, 24, 25]。 因此,选择合适的病种,应用合理的减低强度的 预处理可降低移植相关病死率。
脐血移植也会出现一些少见并发症,如1 例 Ph 阳性ALL 患儿在移植后92 d 出现EBV 相关的 移植后淋巴增殖性疾病(PTLD)。文献报道, 脐血移植后PTLD 的发生率约12%,总病死率约 35%[26]。此例经过积极有效治疗后,目前仍无病生 存。本病例治疗之所以有效,与及早确诊有很大 关系,因此在临床上,严格监测移植后EBV 抗原 定量,尤其对于不能解释的发热和扁桃体淋巴结 肿大者,应警惕PTLD 的发生。
值得一提的是1例移植时合并丙型肝炎患者, 现仍无病存活,且经移植后现丙型肝炎病毒呈阴 性。因为肝炎病毒感染会引起肝脏损伤和免疫功 能障碍,因此对于伴随肝炎病毒阳性患儿,需要 行造血干细胞移植,可能会增加移植后非复发病 死率,如发生肝静脉闭塞症及爆发性肝炎。Ramos 等[27] 比较了携带丙型肝炎病毒患者和非携带者进 行造血干细胞移植,两者1 年的非复发病死率分 别为43% 和23%,差异有统计学意义,对于携带 型肝炎病毒患者进行造血干细胞移植有极大的风 险。
综上,脐血是有效的造血干细胞供体来源之 一,在儿童恶性疾病的治疗中有着不能低估的地 位,其原发病的复发率也无明显增加。现随着移 植支持治疗的不断改进,抗感染药物的不断推进, 在降低移植后感染有很好的潜能,这将大大降低 移植相关病死率,进一步扩大脐血移植在儿童恶性疾病治疗的作用。
| [1] | Rubinstein P, Carrier C, Scaradavou A, et al. Outcomes among 562 recipients of placental-blood transplants from unrelated donors[J]. N Engl J Med, 1998, 339(22): 1565-1577. |
| [2] | Gluckman E, Rocha V. Cord blood transplantation for children with acute leukaemia: a Eurocord registry analysis[J]. Blood Cells Mol Dis, 2004, 33(3): 271-273. |
| [3] | 中华医学会儿科学分会血液学组, 中华儿科杂志编辑委员 会. 儿童急性淋巴细胞白血病诊疗建议(第三次修订草案)[J]. 中华儿科杂志, 2006, 44(5): 392-395. |
| [4] | 符仁义, 刘玉峰. 儿童血液与肿瘤疾病[M]. 郑州:河南科学 技术出版社, 2005: 264-265, 328-336. |
| [5] | 张之南, 沈悌. 血液病诊断及疗效标准[M]. 第3 版. 北京: 科学出版社, 2007: 163-165. |
| [6] | Chan RJ, Cooper T, Kratz CP, et al. Juvenile myelomonocytic leukemia: a report from the 2nd International JMML Symposium[J]. Leuk Res, 2009, 33(3): 355-362. |
| [7] | 唐湘凤, 栾佐, 吴南海, 等. 无关脐血移植后淋巴增殖性疾 病病例报道[J]. 中华儿科杂志, 2007, 45(4): 315-316. |
| [8] | Kurtzberg J, Prasad VK, Carter SL, et al. Results of the Cord Blood Transplantation Study(COBLT):Clinical outcomes of 193 unrelated donor umbilical cord blood transplantation in pediatric patients with malignant conditions[J]. Blood, 2008, 112(10): 4318-4327. |
| [9] | Diaz MA, Gonzalez-Vicent M, Ramirez M, et al. Allogeneic cord blood transplantation in children with hematological malignancies: a long-term follow-up single-center study[J]. Pediatr Hematol Oncol, 2009, 26(4): 165-174. |
| [10] | Stevens CE, Carrier C, Carpenter C, et al. HLA mismatch direction in cord blood transplantation: impact on outcome and implications for cord blood unit selection[J]. Blood, 2011, 118(14): 3969-3978. |
| [11] | Kanda J, Atsuta Y, Wake A, et al. Impact of the Direction of HLA mismatch on transplantation outcomes in single unrelated cord blood transplantation[J]. Biol Blood Marrow Transplant, 2013, 19(2): 247-254. |
| [12] | 刘莎, 郝文革, 黄永兰, 等. 脐血总有核细胞数对脐血移植 疗效的影响[J]. 中国当代儿科杂志, 2010, 12(7): 551-556. |
| [13] | Sanz J, Boluda JC, Martin C, et al. Single-unit umbilical cord blood transplantation from unrelated donors in patients with hematological malignancy using busulfan, thiotepa, fludarabine and ATG as myeloablative conditioning regimen[J]. Bone Marrow Transplant, 2012, 47(10): 1287-1293. |
| [14] | Lee SH, Lee MW, Yoo KH, et al. Co-transplantation of third-party umbilical cord blood-derived MSCs promotes engraftment in children undergoing unrelated umbilical cord blood transplantation[J]. Bone Marrow Transplant, 2013, 48(8): 1040-1045. |
| [15] | Eapen M, Rubinstein P, Zhang MJ, et al. Outcomes of transplantation of unrelated donor umbilical cord blood and bone marrow in children with acute leukaemia: a comparison study[J]. Lancet, 2007, 396(9577): 1947-1954. |
| [16] | Shi-Xia X, Xian-Hua T, Xiang-Feng T. Unrelated umbilical cord blood transplantation and unrelated bone marrow transplantation in children with hematological disease: a meta-analysis[J]. Pediatr Transplant, 2009, 13(3): 278-284. |
| [17] | Szabolcs P, Cairo MS. Unrelated umbilical cord blood transplantation and immune reconstitution[J]. Semin Hematol, 2010, 47(1): 22-36. |
| [18] | Tomonari A, Iseki T, Ooi J, et al. Cytomegalovirus infection following unrelated cord blood transplantation for adult patients: a single institute experience in Japan[J]. Br J Haematol. 2003 121(2): 304-311. |
| [19] | Merindol N, Salem Fourati I, Brito RM, et al. Reconstitution of protective immune responses against cytomegalovirus and varicella zoster virus does not require disease development in pediatric recipients of umbilical cord blood transplantation[J]. J Immunol, 2012, 189(10): 5016-5028. |
| [20] | Albano MS, Taylor P, Pass RF, et al. Umbilical cord blood transplantation and cytomegalovirus: posttransplantation infection and donor screening[J]. Blood, 2006, 108(13): 4275-4282. |
| [21] | Montesinos P, Sanz J, Cantero S, et al. Incidence, risk factors, and outcome of cytomegalovirus infection and disease in patients receiving prophylaxis with oral valganciclovir or intravenous ganciclovir after umbilical cord blood transplantation[J]. Biol Blood Marrow Transplant, 2009, 15(6): 730-740. |
| [22] | Brown J A, Boussiotis VA. Umbilical cord blood transplantation: basic biology and clinical challenges to immune reconstitution[J]. Clin Immunol, 2008, 127(3): 286-297. |
| [23] | Ebihara Y, Takahashi S, Mochizukia S, et al. Unrelated cord blood transplantation after myeloablative conditioning regimen in adolescent and young adult patients with hematologic malignancies: a single institute analysis[J]. Leuk Res, 2012, 36(2): 128-131. |
| [24] | Rocha V, Kabbara N, Ionescu I, et al. Pediatric related and unrelated cord blood transplantation for malignant diseases[J]. Bone Marrow Transplant, 2009, 44(10): 653-659. |
| [25] | Bradley MB, Satwani P, Baldinger L, et al. Reduced intensity allogeneic umbilical cord blood transplantation in children and adolescent recipients with malignant and non-malignant diseases[J]. Bone Marrow Transplant, 2007, 40(7): 621-631. |
| [26] | Jeon T Y, Kim JH, Eo H, et al. Post transplantation lymphoproliferative disorder in children: manifestations in hematopoietic cell recipients in comparison with liver recipients[J]. Radiology, 2010, 257(2): 490-497. |
| [27] | Ramos CA, Saliba RM, de Padua L, et al. Impact of hepatitis C virus seropositivity on survival after allogeneic hematopoietic stem cell transplantation for hematologic malignancies[J]. Haematologica, 2009, 94(2): 249-257. |
 2014, Vol. 16
2014, Vol. 16