原发性 IgA 肾病(IgA nephropathy,IgAN) 是 最常见的原发性肾小球疾病之一,在我国其发病 率占原发性肾小球疾病的 26%~34%。既往认为 该病进展缓慢,为良性病变,但研究显示约 35% ~40% 的 IgAN 患儿在发病 20 年后进展到终末期 肾病(end stage renal disease,ESRD)[1, 2]。肾纤维 化是各种慢性肾脏疾病通往 ESRD 的共同通路, 转化生长因子 β1(transforming growth factor β1, TGF-β1)是目前研究的热点,它是一种多功能的 细胞因子,可促进系膜细胞(mesangial cell,MC) 的增殖及细胞外基质(extracellular matrix ,ECM) 的聚积[3]。其过度表达可通过多种途径,促进肾小 球细胞增生,肾小球硬化,肾小管萎缩和肾间质 纤维化,在肾脏损伤的发展过程中起着重要作用。 无论是肾小球的硬化还是肾小管的纤维化都是反 映肾功能下降严重程度和判断疾病预后的关键指 标[4] 。原发性 IgAN 患儿 TGF-β1 是如何变化的, 以及如何可以阻止肾脏纤维化,进而减少 ESRD 的发生,是基础和临床医学研究面临的共同难题。 本研究拟通过应用酶联免疫吸附法(ELISA)及免 疫荧光的方法对健康儿童、原发性 IgAN 患儿血浆、 尿液和肾组织中 TGF-β1 进行检测和分析,结合 其病理结果进行分级,旨在探讨 TGF-β1 在 IgAN 患儿肾脏损伤的发生、发展过程中的临床意义, 以期为临床预测原发性 IgAN 肾脏损害提供实验室 依据。 1 资料与方法 1.1 研究对象
2008 年 5 月至 2012 年 10 月我院儿科共收治 IgAN 患儿 30 例,其中男 15 例,女 15 例;年龄 6~14 岁,平均 10.4±2.4 岁。IgAN 的病理诊断参 照 2008 年 IgAN 牛津分型[5]。另选取同期我院儿 童保健门诊体检健康的 30 例儿童为对照组,其中 男 16 例,女 14 例;年龄 2~14 岁,平均 6.4± 4.1 岁。两组间性别、年龄比较差异均无统计学意义 (P>0.05)。研究对象均排除合并其他自身免疫性 疾病、变应性疾病、肿瘤或其他原发及继发性肾 小球疾病。 1.2 标本的采集
IgAN 组于入院后第 2 天清晨空腹抽取肘前静 脉血 3 mL,经 3 000 r/min 离心 20 min 后,收集血 清置于 -80℃ 冰箱内保存;并留取清洁中段晨尿, 置于普通试管内,经 3 000 r/min 离心 20 min 后, 仔细收集上清液 2 mL 于试管内,置于 -80℃ 冰箱 内保存。30 例 IgAN 组患儿 B 超定位下肾穿刺活检, 每例肾穿刺活检组织取出后分成 2 份,分别甲醛 中固定及低温保存送检。肾活检组织标本均送至 南京军区福州总医院病理科进行 WHO 病理分级。 IgAN 组患儿均在未治疗前留取血液、尿液及肾组 织标本。对照组儿童于清晨空腹抽取肘前静脉血 3 mL,并留取清洁中段晨尿,采集方法同前。本 研究获得我院医学伦理委员会批准和家长知情同 意。 1.3 血浆和尿液 TGF-β1 浓度的测定
采用 ELISA 法测定血浆、尿液中 TGF-β1 浓 度,测定试剂盒购自上海西唐生物科技有限公司, 检测方法按说明书进行。 1.4 肾组织 TGF-β1 蛋白的测定
采用组织免疫组织化学链霉素抗生物素蛋白-过 氧 化 物 酶 法(streptavidin peroxidase conjugated method,SP)检测肾组织 TGF-β1 蛋白的表达。免 疫组化染色方法应用兔 TGF-β1 多克隆抗体,购 自美国 Proteintech Group Inc 公司。具体操作方法 如下:将肾组织常规包埋并制成石蜡切片,每例 留取 2~4 张,常规脱蜡水化后,微波进行抗原修复, 3%过氧化氢灭活 30 min;磷酸盐缓冲液(PBS) 冲洗,加封闭液室温孵育 30 min 后弃去,滴加适 当稀释的抗 TGF-β1 一抗(抗 TGF-β1 1 : 50),4℃ 过夜。PBS 冲洗后,5 min×3 次,滴加非生物素标 记的二抗,室温孵育 60 min;PBS 冲洗后滴加酶标 亲和素,室温孵育 30 min;PBS 冲洗后滴加 DABH2O2显色液,显微镜下检测显色,最后苏木素对 比染色,常规脱水,二甲苯透明,中性树胶封片。 以 0.01 mol/L PBS 代替一抗、二抗和 SP 试剂作阴 性对照。 1.5 图像分析
阳性结果染色呈棕黄色,用 Image-Pro-Plus 5.0 图象分析软件进行图象定量分析。对获取的免疫 组化标本通过光学显微镜放大 400 倍摄取图像, 每例肾小球数大于 8 个,肾小管随机视野 10 个, 肾小管数均大于 50 个,对所选视野中的阳性信号 进行图像分析。在免疫组化标本中,计算每个肾小球阳性着色的面积及整个肾小球面积,其比值 为 TGF-β1 在肾小球中的含量,并计算各例含量 的均值,以此值代表其在肾小球中的相对含量[6]。 1.6 统计学分析
采用 SPSS 17.0 统计软件进行统计学分析,计 量资料集中趋势描述采用均数 ± 标准差(x±s) 表示,两独立样本比较采用t检验;方差齐的多组 间比较采用方差分析,多组间两两比较用 SNK-q 检验,方差不齐的多组间比较采用 Kruskal-Wallis H法,多组间两两比较用 Mann-Whitney U检验; 相关分析用直线相关及 Spearman 等级相关分析。 P<0.05 为差异有统计学意义。 2 结果 2.1 IgAN 组和对照组血和尿 TGF-β1 水平的比较
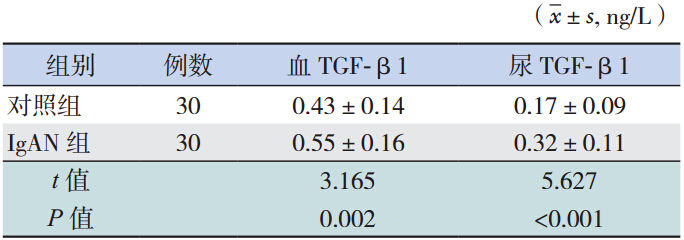
IgAN 患儿血 TGF-β1 水平显著高于对照组 (P=0.002);尿液 TGF-β1 水平亦显著高于对照 组(P<0.001),见表 1。
|
|
表 1 IgAN 组与对照组血浆和尿液 TGF-β1 水平的比较 |
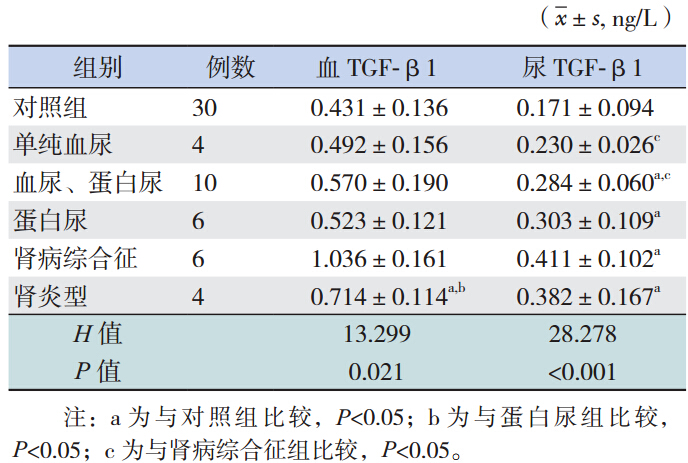
肾炎型组血 TGF-β1 水平高于对照组(U=3.0, P<0.001),其余各亚组与对照组相比差异均无统 计学意义(P>0.05)。尿液中 TGF-β1 除单纯性 血尿组与对照组比较差异无统计学意义(P>0.05) 外,其余各组的表达与对照组比较差异均有统 计学意义(P<0.05)。 血 TGF-β1组间两两比 较:除蛋白尿组与肾炎组间差异有统计学意义外 (P=0.038)外,其余各组间比较差异均无统计学 意义。尿 TGF-β1 组间两两比较结果示肾病综合征组与单纯血尿组(P=0.010),肾病组合征组与 血尿、蛋白尿组(P=0.003)间 TGF-β1 水平差异 有统计学意义,其余各组间比较差异均无统计学 意义,见表 2。
|
|
表 2 IgAN 不同临床分型亚组间血和尿液 TGF 水平的比较 |
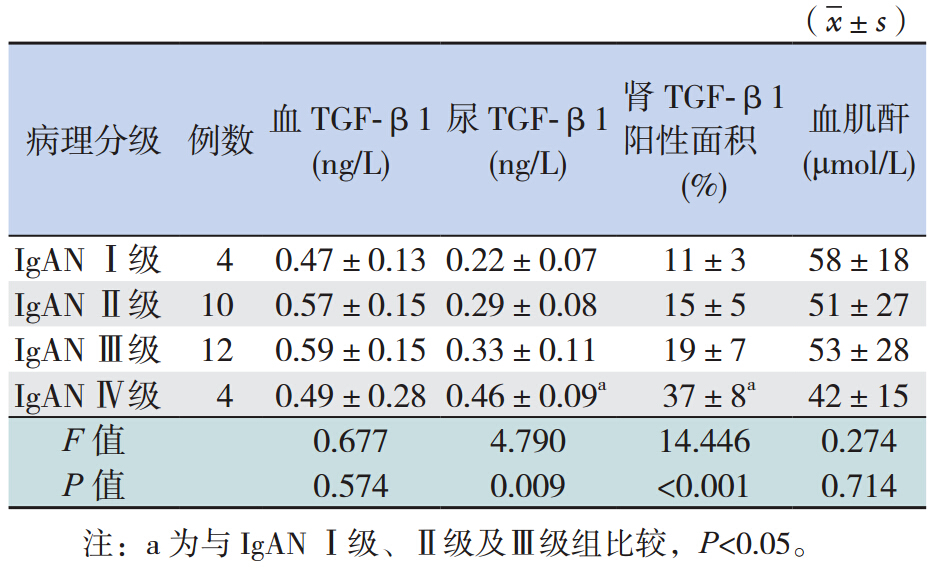
患 儿 血 TGF-β1与肾组织中TGF-β1 蛋 白 的表达无明显相关(r=0.038,P=0.844); 血 TGF-β1 水平与肾脏病理的严重程度(r=0.045, P=0.814)和临床进展指标血肌酐亦无明显相关 (r=-0.062,P=0.637)。不同病理分级患儿血 TGF-β1 与血肌酐水平比较各组间差异无统计学 意义(P>0.05);而尿 TGF-β1 与肾组织 TGF-β1 表达阳性面积比较各组间差异有统计学意义(均 P<0.001),其中 IgAN Ⅳ级组尿和肾组织 TGF-β1 表达均高于其他 3 组(P<0.05),而其他 3 组间比 较差异均无统计学意义(P>0.05),见表 3 。
|
|
表 3 不同病理分级患儿 TGF-β1 和血肌酐水平的比较 |
IgAN 患儿肾组织 TGF-β1 蛋白的表达在肾小 球内呈散在分布,主要见于系膜细胞、内皮细胞 胞浆和毛细血管壁,也分布于肾小球细胞性新月 体、部分肾间质细胞。如图 1A~D 所见,随着病 理分级的加重,TGF-β1 在肾小球内的表达逐渐增 强,肾组织 TGF-β1 阳性面积百分比逐渐增加。 肾活检病理分级与尿TGF-β1 水平 (r=0.557, P=0.001)及肾组织中的 TGF-β1 蛋白表达均呈显 著正相关(r=0.682,P<0.001),见图 2 和图 3。
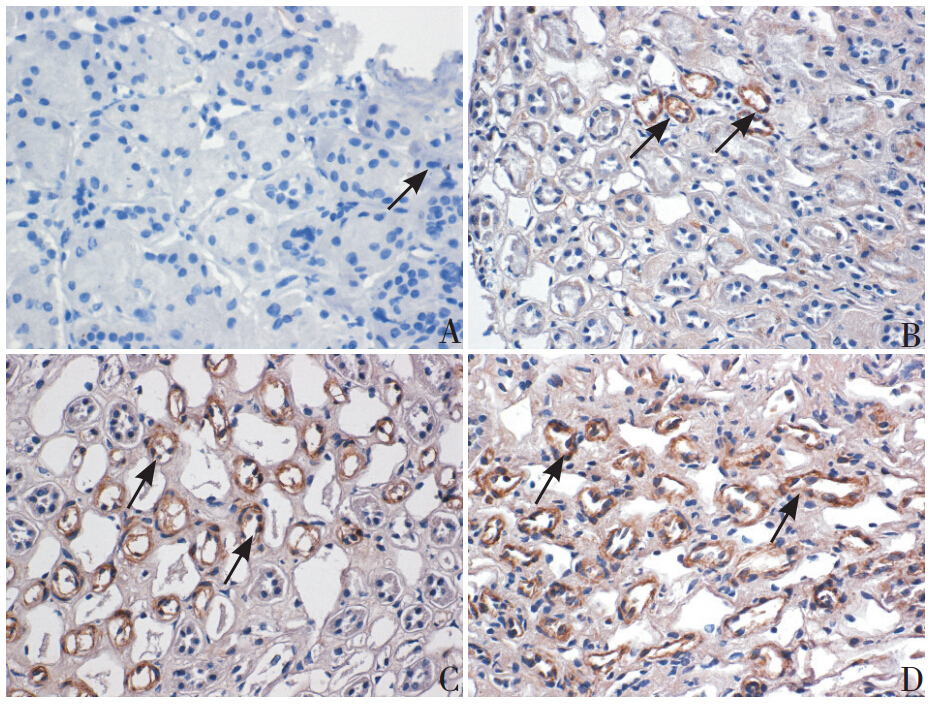 |
图 1 肾组织 TGF-β1 表达(×400) A~D 分别为 IgAN Ⅰ级、IgAN Ⅱ级、IgAN Ⅲ级 和 IgAN Ⅳ级,随着病理分级 的加重,肾组织 TGF-β1 表达逐渐增强。箭头所示为 TGF-β1 阳 性表达细胞 |
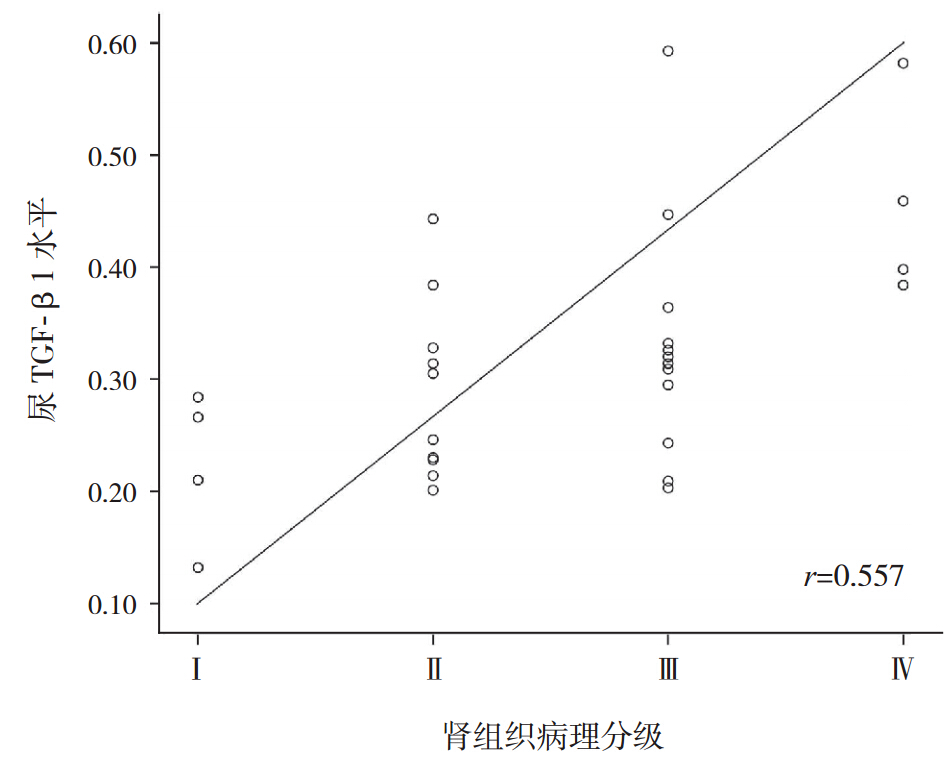 |
图 2 IgAN 患儿肾组织病理分级与尿中 TGF-β1 水 平之间的相关性 |
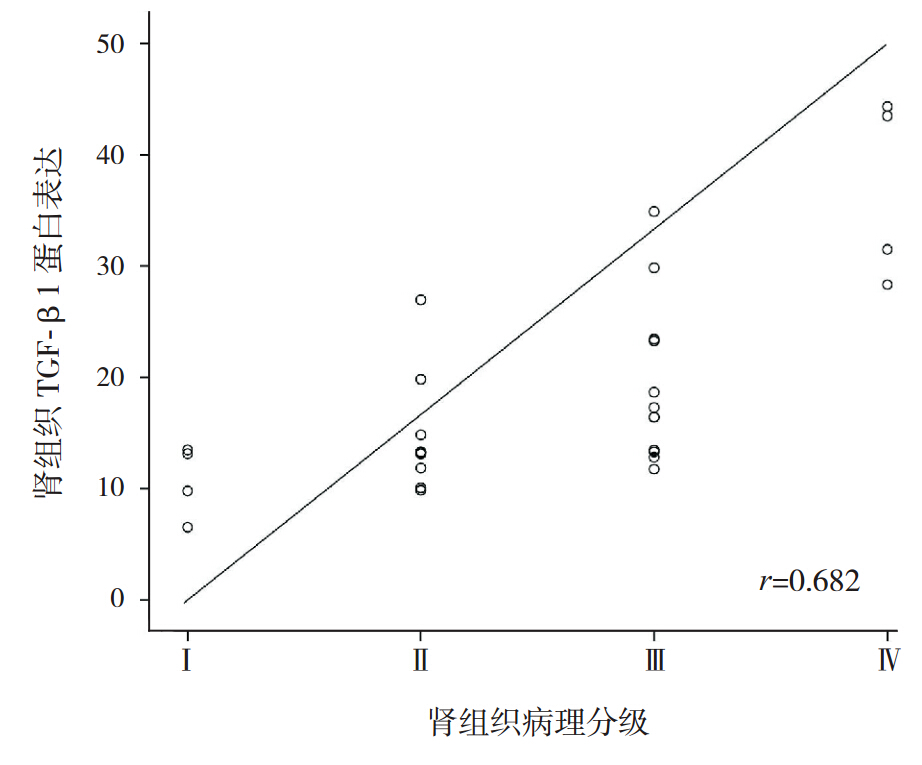 |
图 3 IgAN 患儿肾组织病理分级与肾组织中 TGF-β1表达之间的相关性 |
IgAN 是一组不伴系统疾病、在肾小球系膜区 IgA 或以 IgA 为主沉积的原发性肾小球疾病,其 终末期表现为肾小球的硬化和肾间质的纤维化。 有研究显示肾小球硬化的病理特征是 MC 增殖和 ECM 增多,MC 具有产生 ECM 的功能,而 ECM 对 MC 增殖具有反馈调节作用。ECM 的聚积又受 到 TGF-β1 调节,TGF-β1 具有促进 MC 增殖和促 进 ECM 蛋白的合成和沉积,刺激肾小球硬化[3]。 TGF-β1 的持续表达可导致慢性肾纤维化和肾小球 硬化。国内研究显示 TGF-β 随着 FSGS 的发展, 在肾组织中表达量不断增加,促使肾小管间质向 纤维化发展[7]。本研究检查 IgAN 患儿血液和尿液 中 TGF 表达,结果显示原发性 IgAN 患儿血液、尿 液中 TGF-β1 的表达水平与对照组有显著性差异, 说明 IgAN 患儿伴随着 MC 和系膜基质的集聚就可 能伴随有 TGF-β1 的产生。
由于 IgAN 是一种缓慢进展的疾病,在临床 研究中发现高血压、肾功能损害、大量蛋白尿和 肾小球硬化是 IgAN 发展的独立危险因素[3]。尤 其是蛋白尿的出现往往预示着疾病的进展。本研 究检测 IgAN 不同临床分型血液和尿液中 TGF-β1 的表达,发现血液中 TGF-β1 仅在肾炎型组高于 正常对照组,其他各组均无统计学意义。而尿液 中 TGF-β1 水平仅单纯血尿组与对照组比较无显 著性差异,而其他各组都有统计学意义,尤其是 有蛋白尿的患儿,无论是临床分型是少量的有蛋白尿还是肾病综合征型的大量蛋白尿的患儿尿液 TGF-β1 水平与对照组比较均有显著性差异,这与 文献报道相符合[8] 。血液 TGF-β1 仅在肾炎型组 高于正常对照组,而肾病综合征型组与正常对照 组无显著性差异,与既往研究不符,考虑原因可 能为:(1)本研究病例数过少,需要扩大样本量 进一步研究证实;(2)肾脏受到损伤,可诱导肾 组织局部细胞因子的增加,这些细胞因子经尿液 排出,因此,尿液较血液更能反映肾组织局部细 胞因子的状况及肾脏病变程度。研究显示在正常 情况下,肾小球有微弱的 TGF-β1 表达,IgAN 时, TGF-β1 mRNA 及蛋白质的表达均增加。IgAN 患 儿 TGF-β1 基因的多态性表达与大量的蛋白尿和 MC 的增生有密切的关系 [9] 。还有文献报道 IgAN 伴随着蛋白尿的患儿,尿 TGF-β1 的水平是增加 的,其原因为持续性蛋白尿的滤过致肾小管上皮 细胞产生细胞因子从而刺激肾小管上皮 TGF-β1 的产出。因此,尿 TGF-β1 的水平与蛋白尿有一 定的关系[8] 。本研究显示尿 TGF-β1 要敏感于血 TGF-β1 的检测,尿 TGF-β1 的表达也随着临床 表现的加重而增加,提示尿 TGF-β1 有助于判断 治疗的效果及预后。
有关 IgAN 的研究显示,严重的病理分级也 是预示疾病进展的独立危险因素[10]。本研究显示 伴随着病理分级的增加,IgAN 肾组织 TGF-β1 阳 性表达面积也逐渐增加,肾组织 TGF-β1 的表达 与病理分级有显著的相关性。肾活检病理分级与 尿及肾组织中的 TGF-β1 蛋白表达均呈显著正相 关。尿中 TGF-β1 的水平与肾脏病理改变的严重 性和肾组织的TGF-β1 表达有相关性,提示尿 TGF-β1 表达水平可作为判断 IgAN 组织学损害 程度和预后的重要指标。研究显示 IgAN 组中尿 TGF-β1 水平高于正常对照组,其中以系膜增生型 和局灶节段型中的尿 TGF-β1 水平升高明显,且 随着 IgAN 系膜细胞增加和细胞外基质增加的程度 加重,肾脏局部 TGF-β1 的表达也增加[11] 。Wang 等[12] 对 IgAN 大鼠模型的研究显示洛沙坦治疗组 的尿 TGF-β1 表达低于未治疗组。Song 等[13] 研 究显示尿 TGF-β1 的表达可反映患者治疗后肾纤 维化改善情况,可用于监测 IgAN 的治疗效果。在 IgAN 患儿肾组织 MC 的胞质中 TGF-β1 的表达随 着病理分级的增加而逐渐增加,但 V 级 IgAN 患儿 肾组织中几乎没有 TGF-β1 的表达。本研究未发现 病理改变是 V 级的患儿,可能是因为 IgAN 在儿童 病理改变相对成人要轻。本研究中患儿发病时肾功 能均基本正常,肾小球硬化和大量新月体形成的病 例明显要少,是本研究的不足之处。
综上所述,原发性 IgAN 的患儿伴随肾脏病理 改变的加重,肾脏组织中 TGF-β1 的表达逐渐增 加;尿液 TGF-β1 的水平与肾脏病理分级相关, 尿 TGF-β1 水平是评价 IgAN 组织学损害程度和预 后的重要指标。
| [1] | Shen P, He L, Li Y, et al. Natural history and prognostic factors of IgA nephron pathy presented with isolated microscopic hematuria in Chinese patients [J]. Nephron Clin Pract, 2007, 106(4): c157-c161. |
| [2] | Yata N, Nakanishi K, Shima Y, et al. Improved renal survival in Japanese children with IgAN[J]. Pediatr Nephrol, 2008, 23(6): 905-912. |
| [3] | Pohl M. Risikofaktoren für den Verlauf der IgA-Nephropathie[J]. Der Nephrologe, 2011, 6(4): 340-341. |
| [4] | Strutz F, Okada H, Neilson EG. The role of the tubular epithelial cell in renal fibrogenesis[J]. Clin Exp Nephrol, 2001, 5(2): 62-74. |
| [5] | Cattran DC, Coppo R, Cook HT, et al. The Oxford classification ofIgAN: rationale, clinicopathological correlations, and classification[J]. Kidney Int, 2009, 76(5): 534-545. |
| [6] | 周莹. IgAN 患儿血、尿和肾组织中的TGF-β1 与临床病理的 相关性研究[D]. 温州医学院硕士学位论文, 2009. |
| [7] | 卫敏江, 吴伟岚, 陈敏怡. TGF-β 与肝细胞生长因子在儿童 原发性局灶节段性肾小球硬化肾组织中的表达[J]. 中国当代 儿科杂志, 2010, 12(8): 630-633. |
| [8] | Kalliakmani P, Nakopoulou L, Tsakas S, et al. Urinary interleukin-6 (IL-6) and transforming growth factor (TGF-β) levels in corticosteroidtreated patients withIgAN[J]. Clin Nephrol, 2011, 76(2): 144-150. |
| [9] | Goumenos DS, Tsakas S, El Nahas AM, et al. Transforming growth factor-beta(1) in the kidney and urine of patients with glomerular disease and proteinuria[J]. Nephrol Dial Transplant, 2002, 17(12): 2145-2152. |
| [10] | Shin GT, Kim SJ, Ma KA, et al. ACE inhibitors attenuate expression of rena l transforming growth factor-beta1 in humans[J]. Am J Kidney Dis, 2000, 36(5): 894-902. |
| [11] | D'Amico G. Natural history of idiopathicIgAN and factors predictive of disease outcome[J]. Sem Nephrol, 2004, 24(3): 179-196. |
| [12] | Wang H, Fu W, Jin Z, et al. Advanced IgAN with impaired renal function benefits from losartan treatment in rats[J]. Ren Fail, 2013, 35(6): 812-818. |
| [13] | Song JH, Lee SW, Suh JH, et al. The effects of dual blockade of the renin-angiotensin system on urinary protein and transforming growth factor-beta excretion in 2 groups of patients with IgA and diabetic nephropathy[J]. Clin Nephrol, 2003, 60(5): 318-326. |
 2014, Vol. 16
2014, Vol. 16