2. 苏州大学儿科医学研究所, 江苏 苏州 215003
女童性早熟发生的病因很多,环境污染的 影响受到越来越多的关注。双酚 A(bisphenol A, BPA)是环境内分泌干扰物中的一种,1993 年 Krishnan 首次提出 BPA 具有类雌激素样作用后 [1], BPA 对人类生长发育的影响受到了广泛关注。 虽然美国政府将每日 50 mg/kg 暴露作为 BPA 的可观察到有害作用的最低剂量,每日 50 μg/kg 暴露作为人类 BPA 暴露“安全剂量”[2]。但这仅 是成人暴露剂量,在儿童乃至婴幼儿 BPA“安全 剂量”尚不明确。文献报道 BPA 具有“U”效应[3], 即在一定的剂量范围内,剂量 - 效应曲线的斜率 可发生正负的转换。大剂量的 BPA 暴露(每日 >50 mg/kg)可能导致肝、肾功能或者体重改变 [4], 低剂量 BPA 暴露对人类的影响尚不清楚,故 BPA 低剂量暴露对儿童性发育的影响需进一步探讨。
青春期是由下丘脑 - 垂体 - 性腺轴启动引起,下 丘脑 Kisspeptin-Kiss-1R-GnRH 信号系统的激活, 雌激素受体的表达增多并反馈调节GnRH 神经元, 再通过靶器官的雌激素受体(estrogen receptor, ER),从而启动青春发育 [5],环境内分泌干扰物 可能干扰此过程。本研究拟通过不同剂量 BPA 干 预新生大鼠,了解其是否可能引起大鼠青春期启 动提前,如提前是否与下丘脑 Kiss-1 基因表达改 变相关及对外周性腺 ER 表达的影响。 1 材料与方法 1.1 主要试剂
BPA( 美 国 Sigma 公 司),E2( 美 国 Sigma 公司),玉米油(金龙鱼,益海嘉里投资有限公 司),无水乙醇(江苏强盛功能化学股份有限公 司)。DEPC(上海华舜生物工程公司);随机引 物(上海生工生物工程公司合成);Trizol、RNase Inhibitor(Invitrogen 公司);RNase Inhibitor、M-MLV、 dNTP MIX(10mM)(Promega 公司);设计引物 采用 Primer 5 软件,经 GenBank Blast 进行同源检 索后合成。引物由上海生工生物工程公司合成。 实验药物溶剂为无水酒精:玉米油以 1 : 9 比例制 成的混合溶液[6] 。E2与BPA均溶于上述混合溶剂中, E2组溶液化学物浓度为 2×10-4 g/mL,低剂量 BPA 组溶液化学物浓度为 5×10-6g/mL,中剂量 BPA 组 溶液化学物浓度为 1×10-5g/mL,高剂量 BPA 组溶 液化学物浓度为 5×10-5g/mL。 1.2 试验动物及饲养条件
清洁级雌性 Spuague-Dawley(SD)大鼠 8 只, 体重 150 g 左右;雄性 4 只,体重 120 g 左右,购 自上海斯莱克实验动物有限责任公司。饲养环境 为昼夜 12 h 交替,室内温度控制在 18~22℃之间, 湿度 50%~60%,食物和水自由摄取。新生仔鼠母 乳喂养,生后 21 d 断奶。1.3 动物分组和观察指标
雌雄鼠分开喂养,适应性饲养至雌雄鼠均约 200 g,按雌雄比 2 : 1 合笼交配,每日进行阴道涂 片检查,查到精子存在即为妊娠,雌雄鼠分笼。 孕鼠单独喂养,每日观察孕鼠情况。记录分娩时间, 设分娩当天为仔鼠生后 0 d(postnatal day 0,PND 0)。仔鼠以交叉培育方式喂养,每只母鼠喂养 12 只仔鼠,雌雄比为 1 : 1。为排除大鼠新生儿期玉米 油与无水酒精混合物暴露对机体生长发育的影响, 本实验特设溶剂组。48 只雌性仔鼠随机分为 6 组: 空白对照组(只观察不干预)、溶剂组(于 PND 0~6 皮下注射上述混合溶剂,约 0.05 mL/ 只)、E2 组(PND 0~6 皮下注射 E2组溶液,约 0.05 mL/ 只)、 低剂量 BPA 组(于 PND 0~6 皮下注射低剂量 BPA 溶液约0.005 mL/g,即25 μg/kg)、中剂量BPA 组(于 PND 0~6 皮下注射中剂量 BPA 溶液约 0.005 mL/g, 即 50 μg/kg)、高剂量 BPA 组(于 PND 0~6 皮下 注 射 高 剂 量 BPA 溶 液 约 0.005 mL/g,即 250 μg/ kg)。给药期间每天称重,根据体重调整药量。 仔鼠在 PND 21 断奶,断奶后每日观察雌性仔鼠是 否阴道开口并记录阴道开口时间(vaginal opening day,VOD)。在阴道开口当天颈椎脱臼法处死仔鼠, 称重,立刻取出卵巢、下丘脑,称取其湿重后投 入液氮,-80℃低温保存用于 RT-PCR 检测。下丘 脑取材范围为头侧至视交叉前 3 mm、尾侧至乳头 体、两侧至下丘脑沟,深度为 3 mm。卵巢取材范 围为与子宫角紧密相连的两侧肾脏外下方呈淡粉 色的卵巢,体积约为 3 mm×4 mm×4 mm 大小, 仔细剥离其周围的脂肪组织,双侧对称剥离。 1.4 脏器系数计算
取出下丘脑及卵巢后,迅速称取其湿重,计 算下丘脑脏器系数(下丘脑湿重 / 体重)。卵巢脏 器系数(双侧卵巢湿重 / 体重)。 1.5 RT-PCR 检测 1.5.1 总 RNA 的提取
TRIzol 一步法提取总 RNA。紫外分光光度计测定 RNA 浓度及纯度, A260/A280 比值在 1.8~2.0 之间。1.5.2 合成 cDNA
按 42℃,60 min ;95℃, 5 min 将 RNA 逆转录成 cDNA,-20℃保存。1.5.3 PCR 反应
引物序列为Kiss-1 上游引 物:5'-GATCTCGCTGGCTTCTTGGC-3',下游引 物:5'-GGACTGTTGGCCTGCGGGTT-3'(产物长度 112 bp)。ERα 上游引物:5'-TGAAGCACAAGCGTCAGAGA-3',下游引物:5'-CGTAGCCAGCAACATGTCAA-3'(产物长度 501 bp)。ERβ 上游引物: 5'-GAA-GCTGAACCACCCAATGT-3',下游引物: 5'-CAGTCCCACCATTAGCACCT -3'(产物长度 210 bp)。内参上游引物:5'-CCCA TCTATGAGGGTTACGC-3',下游引物:5'-TTTAATGTCACGCACGATTTC-3'( 产 物 长 度 150 bp)。 反 应 条 件 为: 95 ℃,10 min;95 ℃,15 s;60 ℃,15 s;72 ℃, 30 s,72℃收集荧光,共 50 个循环。 1.6 统计学分析
采用参照基因的 ΔCT 法计算目的基因 mRNA 的相对表达量,用相对定量法计算各基因 mRNA 表达水平(Q),直接用管家基因来校正样品初始 量,定量公式为:Q = 2-△△ Ct,△△Ct=(待测 样品目的基因平均 Ct 值 - 待测样品管家基因平均 Ct 值 )-( 标准品目的基因平均 Ct 值 - 标准品管家 基因平均 Ct 值 ),Ct 值为每个反应管内的荧光信 号到达设定的域值时所经历的循环数。采用 SPSS 16.0 统计软件对数据进行统计学分析。计量资料 采用均数 ± 标准差(x±s)表示,多组间比较用 单因素方差分析,多个样本均数的两两比较采用 SNK 检验。P<0.05 为差异有统计学意义。 2 结果 2.1 动物一般情况
各组间PND 0 体重差别无统计学意义 (F=0.264,P=0.930);各组间 PND 6 体重差异亦 无统计学意义(F=0.063,P=0.997)。见表 1。
|
|
表 1各组仔鼠 PND 0 和 PND 6 体重的比较 (x±s,g) |
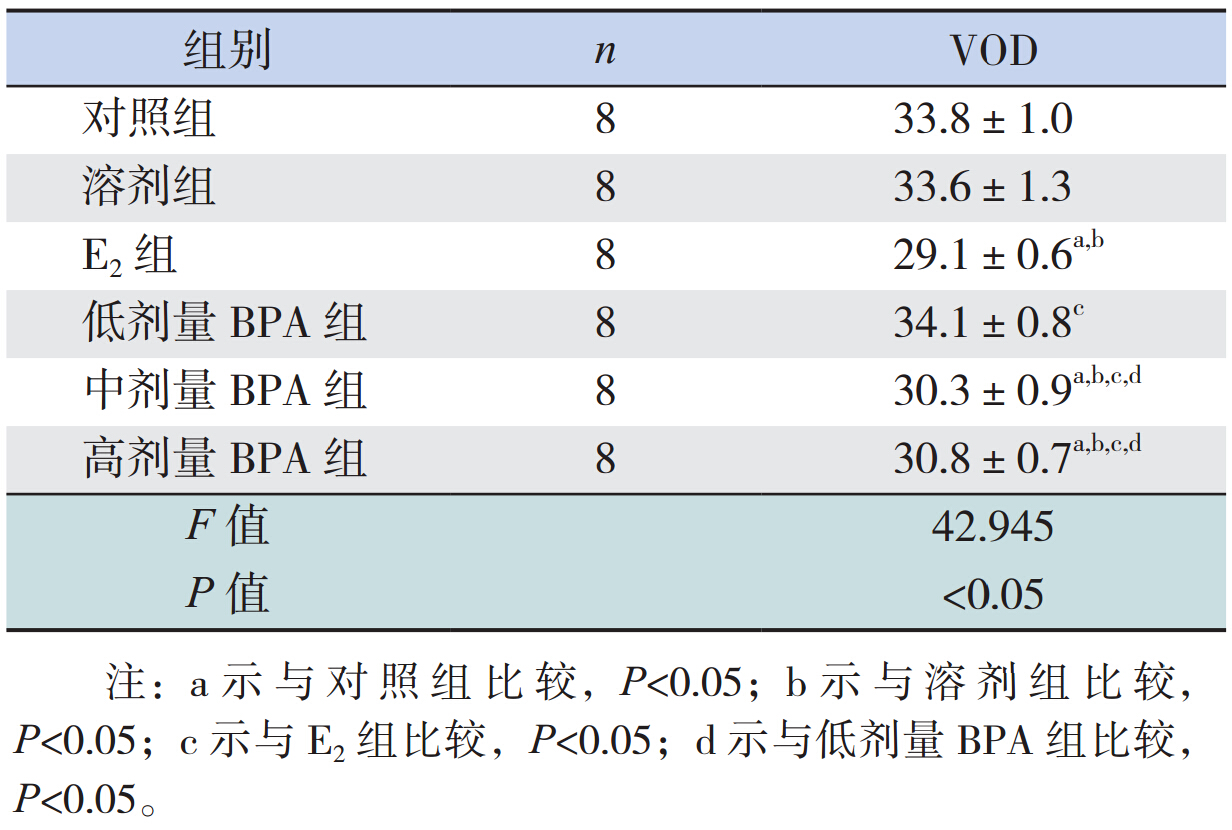
E2组 VOD 较其余各组均提前,差别具有统计 学意义(P<0.05);中、高剂量 BPA 组 VOD 较对 照组、溶剂组、低剂量 BPA 组提前,差异有统计 学意义(P<0.05)。见表 2。
|
|
表 2 各组 VOD 比较 (x±s,d) |
各组下丘脑脏器系数的差异无统计学意义 (F=0.231,P=0.947),见表 3。
|
|
表 3 下丘脑、卵巢脏器系数比较 (x±s,%) |
E2组卵巢脏器系数较其余各组降低明显,差 异有统计学意义(P<0.05),见表 3。 2.5 各组下丘脑 Kiss-1 mRNA 相对表达量比较
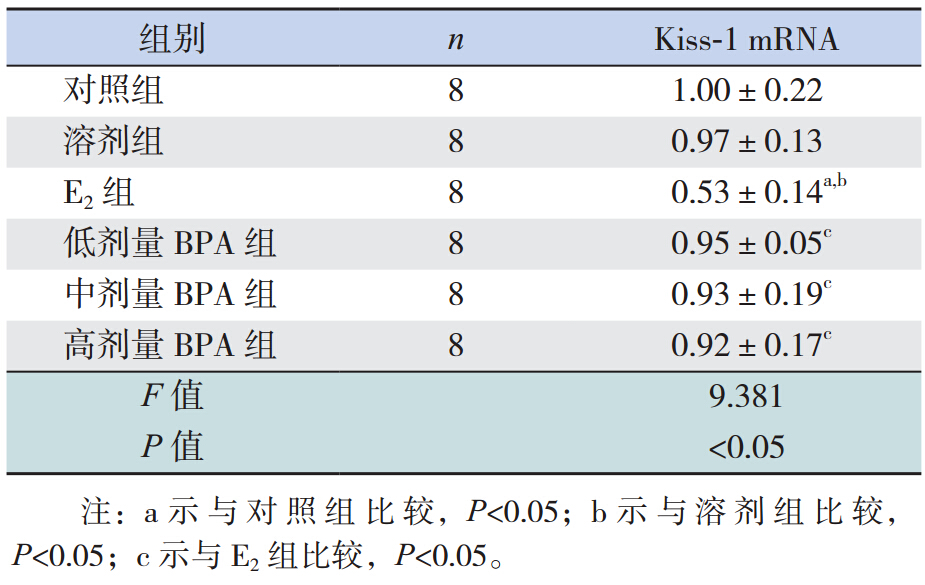
E2组下丘脑 Kiss-1 mRNA 相对表达量较其余 各组降低明显,差异有统计学意义(P<0.05),见 表 4。
|
|
表 4下丘脑 Kiss-1 mRNA 相对表达量比较 (x±s) |
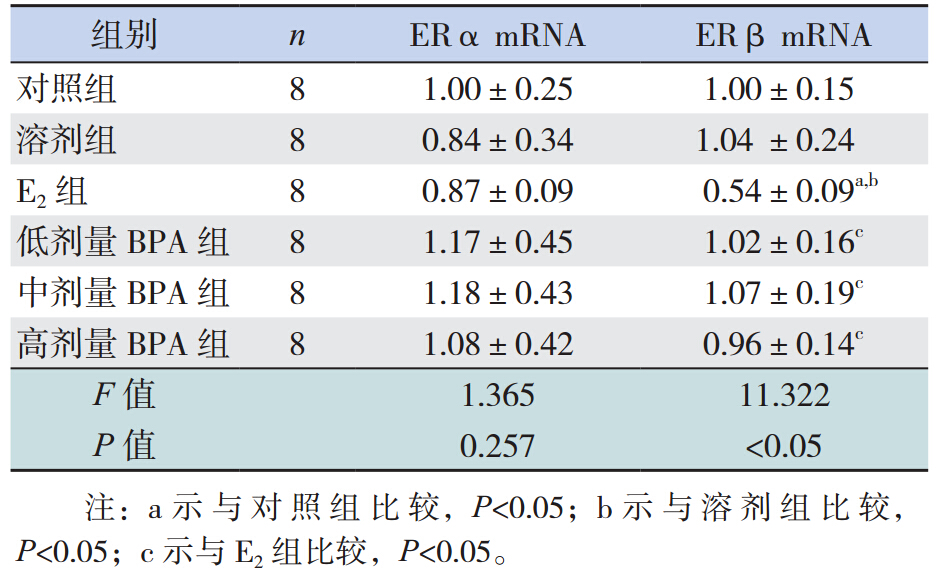
各组间卵巢 ERα mRNA 相对表达量差异无统 计学意义(F=1.365,P=0.257);E2 组卵巢 ERβ mRNA 相对表达量较其余各组降低明显,差异有 统计学意义(P<0.05)。见表 5。
|
|
表 5 卵巢 ER mRNA 相对表达量(x±s) |
青春期启动一般认为是由下丘脑 - 垂体 - 性 腺轴启动引起,即性激素通过其受体正反馈作用 于下丘脑导致Kiss-1 基因编码产物 kisspeptin 与 其受体 GPR54 结合,引起促性腺激素释放激素 (GnRH)的表达增加,刺激垂体前叶分泌促性腺 激素、黄体生成素(LH)及卵泡刺激素(FSH), 引起外周性腺甾体类激素分泌增多,促进外周性 腺发育。由此可知Kiss-1 基因在青春期启动中发挥重要作用[7, 8]。ER 主要有两种类型—α 受体 (ERα)和 β 受体(ERβ),卵巢 ERα 主要作 用是引起卵泡细胞增殖,ERβ 是性激素在卵巢组 织上发挥作用的重要途径[9]。脏器系数又称脏体比, 是实验动物某脏器的重量与其体重之比值。正常时 各脏器与体重的比值比较恒定。染毒后受损脏器重 量可以发生改变,故脏器系数也随之而改变[10]。
Navarro 等 [11] 研究结果显示,E2在 PND 0 单 次暴露和 BPA 以每只 100 μg、500 μg 剂量在 PND 1~5 d 染毒大鼠即可导致PND 30 时大鼠下丘脑 Kiss-1 mRNA 水平下降。有研究显示在 PND 5 至 PND 11,经母乳染毒 BPA 可引起雌性 SD 大鼠在 PND 70 时其卵巢 ERα、ERβ 表达下降 [12],推测 BPA 在上述剂量及作用时间条件下,可影响大鼠 下丘脑 Kiss-1 基因及卵巢 ERα、ERβ 表达。但 上述 BPA 剂量均较大,正常生存环境中较难发生, 目前对 BPA 少量暴露对青春发育及外周性腺影响 的研究较少,因此本研究着重关注新生大鼠少量 BPA 暴露对其青春期启动及下丘脑 Kiss-1 基因、 卵巢 ER 表达影响。
0~6 月婴儿若使用塑料奶瓶喂养,其 BPA 暴 露量 95% 参考值范围上限约为每日 4.5 μg/kg [13]。 按照等效药物剂量换算,大鼠药物剂量约为人类 5~6 倍 [14]。因此本研究中采用的 BPA 低剂量约为 每日 4.5 μg/kg 的 6 倍,即 25 μg/kg,中剂量选择 人类暴露“安全剂量”(每日 50 μg/kg),高剂 量选择高于人类“安全剂量”5 倍的剂量(每日 250 μg/kg),旨在模拟人类在婴儿期可能存在的 潜在 BPA 暴露。将 E2暴露作为可以引起大鼠阴道 VOD 提前和卵巢发育异常的阳性对照 [6]。
本研究结果显示,在干预起始及结束当天测 仔鼠体重,各干预组与对照组相比未见明显差异, 可推测本实验所选用药物剂量未对动物基本生长 产生影响。溶剂组各实验结果与对照组均无明显 差异,可排除溶剂本身对大鼠青春期启动及卵巢 发育的影响。而各干预组与对照组的下丘脑脏器 系数差异无统计学意义,说明新生儿期 BPA、E2 暴露未对下丘脑重量产生明显影响。
本研究显示,E2组、中、高剂量 BPA 组与对 照组相比 VOD 提前,其中 E2组最早,此结果与 Losa-Ward 等 [6] 的研究基本一致。说明新生儿期中、 高剂量 BPA 暴露可以引起大鼠 VOD 提前。下丘脑Kiss-1 基因 RT-PCR 结果显示,青春期启动时,E2 组的 Kiss-1 mRNA 表达水平较对照组明显降低,推 测其原因可能是大鼠新生儿期 E2暴露后,其下丘 脑 Kiss-1 基因神经元应对性激素正反馈通路遭到破 坏导致[15] 。虽 然 E2组的 Kiss-1 mRNA 表达降低,中、 高剂量 BPA 暴露 Kiss-1 mRNA 表达水平与对照组 相比无明显差异,但中、高剂量 BPA 组及 E2组 VOD 均提前,提示大鼠 VOD 提前可能与下丘脑中 对 GnRH 有抑制作用的基因破坏相关,而非 Kiss-1 表达增加导致[6],该结果有待进一步实验验证。
本研究中E2 组卵巢脏器系数及卵巢ERβ mRNA 较对照组明显下降,但 BPA 组与对照组相 比无明显差异。因卵巢发育及其 ER 表达与外周 血浆中FSH、LH、外周性腺甾体类激素相关。 而 Kiss-1 编码合成的 kisspeptin 与其受体 GPR54 结合可以引起 GnRH 分泌增加,从而进一步导致 FSH、LH 分泌增加,甾体类激素分泌增多,外周 性腺发育[7, 8] 。因此可以推测由于本研究中 E2组 下丘脑 Kiss-1 表达较对照组明显下降,导致其 GnRH、LH、FSH 也随之下降,甾体类激素分泌 减少,而卵巢 ERα 主要作用仅是引起卵泡细胞增 殖,ERβ 才是性激素在卵巢组织上发挥作用的重 要途径[9] ,因此 E2 组卵巢脏器系数及卵巢 ERβ mRNA 较对照组明显下降。根据 E2组下丘脑 Kiss-1 mRNA 及卵巢脏器系数、卵巢 ERβ mRNA 均下 降,可推测新生儿期高浓度 E2暴露可对雌性大鼠 下丘脑及卵巢发育造成严重影响。本研究中,中、 高剂量 BPA 组与对照组相比,VOD 时间提前,但 下丘脑、卵巢脏器系数及下丘脑 Kiss-1 mRNA、卵 巢 ER mRNA 与对照组相比无差异,可知新生儿期 每日 50 μg/kg、250 μg/kg BPA 持续暴露可以引起大 鼠 VOD 提前,但并没有对下丘脑 Kiss-1 基因表达 及外周卵巢 ERα、ERβ 表达产生明显影响。可 以推测新生大鼠每日 50 μg/kg、250 μg/kg BPA 暴 露引起 VOD 提前可能不是通过影响下丘脑 Kiss-1 基因表达变化来实现,且上述两种剂量 BPA 暴露 未对大鼠下丘脑 Kiss-1 基因主导的性发育产生严 重影响;而更小剂量(每日 25 μg/kg)BPA 暴露不 会引起大鼠 VOD 提前 。
| [1] | Krishnan AV, Stathis P, Permuth SF, et al. Bisphenol-A: an estrogenic substance is released from polycarbonate flasks during autoclaving[J]. Endocrinology, 1993, 132(6): 2279-2286. |
| [2] | Adewale HB, Jefferson WN, Newbold RR, et al. Neonatal bisphenol-a exposure alters rat reproductive development and ovarian morphology without impairing activation of gonadotropin-releasing hormone neurons[J]. Biol Reprod, 2009, 81(4): 690-699. |
| [3] | Bouskine A, Nebout M, Brucker-Davis F, et al. Low doses of bisphenol A promote human seminoma cell proliferation by activating PKA and PKG via a membrane G-protein-coupled estrogen receptor[J]. Environ Health Perspect, 2009, 117(7): 1053-1058. |
| [4] | Tyl RW, Myers CB, Marr MC, et al. Three-generation reproductive toxicity study of dietary bisphenol A in CD Sprague-Dawley rats[J]. Toxicol Sci, 2002, 68(1): 121-146. |
| [5] | Roa J, Vigo E, Castellano JM, et al. Follicle-stimulating hormone responses to kisspeptin in the female rat at the preovulatory period: modulation by estrogen and progesterone receptors[J]. Endocrinology, 2008, 149(11): 5783-5790. |
| [6] | Losa-Ward SM, Todd KL, McCaffrey KA, et al. Disrupted organization of RFamide pathways in the hypothalamus is associated with advanced puberty in female rats neonatally exposed to bisphenol A[J]. Biol Reprod, 2012, 87(2): 28. |
| [7] | Navarro VM, Castellano JM, Fernandez-Fernandez R, et al. Characterization of the potent luteinizing hormone-releasing activity of Kiss-1 peptide, the natural ligand of GPR54[J]. Endocrinology, 2005, 146(1): 156-163. |
| [8] | Lapatto R, Pallais JC, Zhang D, et al. Kiss1-/-mice exhibit more variable hypogonadism than Gpr54-/-mice[J]. Endocrinology, 2007, 148(10): 4927-4936. |
| [9] | Bottner M, Thelen P, Jarry H. Estrogen receptor beta: tissue distribution and the still largely enigmatic physiological function[J]. J Steroid Biochem Mol Biol, 2014, 139: 245-251. |
| [10] | 袁本利. 药物安全评价中脏器系数的意义及不足[J]. 中国新 药杂志, 2003, 12(11): 960-963. |
| [11] | Navarro VM, Sanchez-Garrido MA, Castellano JM, et al. Persistent impairment of hypothalamic Kiss-1 system after exposures to estrogenic compounds at critical periods of brain sex differentiation[J]. Endocrinology, 2009, 150(5): 2359-2367. |
| [12] | 刘兆平, 张晓鹏, 张文众, 等. 大豆异黄酮和双酚A 联合暴 露对雌性大鼠不同组织雌激素受体表达的影响[J]. 中国食品 卫生杂志, 2008, 20(6): 510-514. |
| [13] | Organization WH. Joint FAO/WHO Expert Meeting to Review Toxicological and Health Aspects of Bisphenol A: Summary Report[J]. World Health Organization, Ottawa, CA. 2010. |
| [14] | 孙瑞元, 马越鸣, 洪宗元. 药理实验设计及统计分析 [M]//徐 叔云, 卞如濂, 陈修. 药理试验方法学. 第三版. 北京: 人民 卫生出版社, 2001: 202-204. |
| [15] | Patisaul HB, Todd KL, Mickens JA, et al. Impact of neonatal exposure to the ERalpha agonist PPT, bisphenol-A or phytoestrogens on hypothalamic kisspeptin fiber density in male and female rats[J]. Neurotoxicology, 2009, 30(3): 350-357. |
 2014, Vol. 16
2014, Vol. 16