支气管哮喘是以气道高反应性和嗜酸性粒细 胞(eosinophils,EOS)性气道炎症为特征的免疫紊 乱性疾病,Thl/Th2 失衡、Th2 细胞功能亢进是支 气管哮喘的重要免疫学发病机制[ 1 ]。在哮喘中, Th2 细胞通过释放IL-5、lL-4、IL-6、IL-9、IL-13 以及粒细胞- 巨噬细胞集落刺激因子(granuloeyte macrophage colony stimulating factor,GM-CSF)等多 种细胞因子和趋化因子而促进EOS的聚集和活化、 IgE 的形成,形成气道慢性炎症,气道反应性增 高,从而导致了哮喘发作[ 2 ]。甲磺司特(suplatast tosilate,IPD)是一种新型的选择性Th2 细胞因子抑 制剂。国外有关IPD 的临床应用证实IPD 能降低 哮喘受试者(包括激素依赖性哮喘、咳嗽变异型 哮喘)症状评分、改善肺功能,减少β2 受体激动 剂的用量,具有“节约激素”的作用[ 3 ]。但其具体 作用机制值得进一步探讨。本研究拟通过观察IPD 早期干预与晚期干预后肺组织IL-5 mRNA 表达的 变化,了解该药物对免疫反应的致敏阶段与激发 阶段的影响。 1 材料与方法 1.1 动物分组和试剂用品
4周龄雄性Sprague-Dawley(SD)大鼠50 只, 体重200±20 g,SPF 级(湖南农业大学动物部), 随机分为5 组,每组10 只:对照组、模型组、布 地奈德(BUD)组、IPD(A)组和IPD(B)组。
试剂用品包括卵清蛋白(OVA,美国 Sigma 公司);甲磺司特颗粒(北京兴德通医药科技有 限公司);IL-5 酶联免疫吸附试剂盒(美国RD 公 司);Trizol、IL-5 引物及GAPDH 引物(Invitrogen 公司)。 1.2 动物模型的制备
除对照组以外的4 组大鼠分别于第1 天和 第8 天腹腔注射10% OVA 混合液1 mL(含OVA 100 mg、氢氧化铝100 mg 及灭活百日咳杆菌苗 5×109 个作为免疫佐剂)致敏。2 周后再进行激 发,2% OVA 泵雾化吸入,10 min/ 次,每日1 次, 连续7 d,构建大鼠哮喘模型。对照组致敏和激发 均以生理盐水代替。BUD 组每次激发前用BUD 溶 液0.64 mL/kg(含BUD 0.32 mg)[ 4 ] 加生理盐水至 2 mL 泵雾化吸入,IPD(A)组和 IPD(B)组参照 文献[ 5 ] 的剂量分别从致敏(实验第1 天)和激发 (实验第15 天)阶段开始予IPD [50 mg/(kg · d)] 灌 胃。激发后大鼠出现哮喘症状如躁动不安、 咳嗽、 呼吸急促、紫绀等,证实模型制作成功。其中IPD (A)组大鼠1 只灌胃过程中因灌胃针误入气管而 窒息死亡。 1.3 肺组织苏木精- 伊红染色
各组大鼠于末次激发24 h 内(即第21 天), 腹腔注射10%水合氯醛4 mL/kg 麻醉,心脏采血 后处死大鼠,取右肺上叶浸泡于4% 多聚甲醛中 固定,脱水、透明、浸蜡,常规石蜡包埋、切片 4 μm,用苏木精- 伊红(HE)染色常规病理组织 学检查,观察支气管及肺泡周围炎症细胞浸润、 小血管管壁、支气管平滑肌改变及支气管壁周围 的EOS 浸润等情况。 1.4 肺泡灌洗液炎性细胞计数及EOS 百分比
末次激发24 h 内处死大鼠后,充分暴露气管、 左支气管、左肺,在环状软骨上缘小心切开气管, 用10 mL 注射器针头制成灌洗针向肺组织方向插入 后结扎并固定,匀速注入3 mL 生理盐水至肺尖膨 胀,反复抽洗3 次,回收灌洗液并计量,回收率大 于80%,采集的肺泡灌洗液(BALF),一部分用 于BALF 炎性细胞总数测定,部分离心 10 min(4℃, 3 000 r/min),上清液用于细胞因子IL-5 测定;取 少许离心沉渣涂片经瑞氏染色,镜下计数200 个 细胞,计数EOS 百分比(在高倍显微镜下计数至 少200 个除红细胞和上皮细胞外的有核细胞总数)。 1.5 肺组织IL-5 mRNA 含量的测定
用逆转录- 聚合酶链式反应(RT-PCR) 法,取冷冻的右肺中央组织约50 mg,加入1 mL Trizol 提取总RNA,紫外线分光光度法测定RNA 纯度和含量。取1 μg RNA 在 oligo dT(18) 和 dNTP mixture 存在的情况下进行逆转录反应合 成 cDNA,再以 cDNA 为模板进行 PCR 扩增。 由美国Invitrogen 公司完成IL-5 引物序列、大鼠 GAPDH 内参引物序列合成。大鼠IL-5 引物序列: 上游5'-TGCTTCTGTGCTTGAACGTTCTAAC-3',下 游5'-TTCTCTTTTTGTCCGTCAATGTATTTC-3',预 期扩增产物长298 bp。大鼠GAPDH 内参引物序 列: 上游5'-CAAGGTCCATGACAACTTTG-3',下游 5'-GTCCACCCTGTTGCTGTAG-3',预期扩增产物长 496 bp。PCR 反应条件:94℃ 预变性4 min,94℃ 30 s,55℃ 30 s,72℃ 1 min,共30 个循环,72℃ 延伸 5 min,对扩增后的产物各取10 μL 进行琼脂 糖凝胶电泳(Goodview 显色),电泳后紫外灯光 下观察结果并照相,经凝胶成像分析系统扫描, 进行面积灰度扫描,以密度代表其表达量,计算 出目的基因的相对含量。目的基因的相对含量= 目的基因的密度/GAPDH 基因的密度。 1.6 IL-5 含量的测定
采用大鼠IL-5 ELISA 检测试剂盒检测BALF 中IL-5 含量,按照试剂说明书进行操作,根据光 密度值计算出标本中所含因子的含量。 1.7 统计学分析
数据使用SPSS 16.0 软件进行统计学分析,计
量资料以均数± 标准差(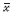 ±s)表示,组间比较
采用单因素方差分析,P<0.05 为差异有统计学意
义。
2 结果
2.1 病理组织学改变
±s)表示,组间比较
采用单因素方差分析,P<0.05 为差异有统计学意
义。
2 结果
2.1 病理组织学改变
肺组织切片HE 染色后,对照组支气管管腔 规则、黏膜上皮整齐,管腔内无炎性渗出物及黏 液栓,管壁无增厚,气道周围未见明显炎性细胞 浸润。模型组支气管周围可见大量炎症细胞浸润, 包括:EOS、中性粒细胞、巨噬细胞和淋巴细胞等; 炎性细胞主要在支气管黏膜下层及黏膜外层、肺 泡壁和小血管周围等处浸润,肺间质及肺泡腔内 可见EOS,支气管内可见黏液栓,气道上皮有损伤、 断裂,基底膜稍增厚且形态不规则,平滑肌有轻 度的增生。与模型组相比,IPD 组气道周围炎症明 显减轻,气道周围炎症细胞浸润、气道分泌物减 少,支气管壁增厚及上皮细胞脱落现象明显改善。 BUD 组气道周围炎症细胞浸润明显减少,气道分 泌物及上皮细胞脱落少见,气道周围炎症较模型 组明显减轻。而BUD 组、IPD(A)组及IPD(B) 组之间气道炎症改变相似。见图 1。
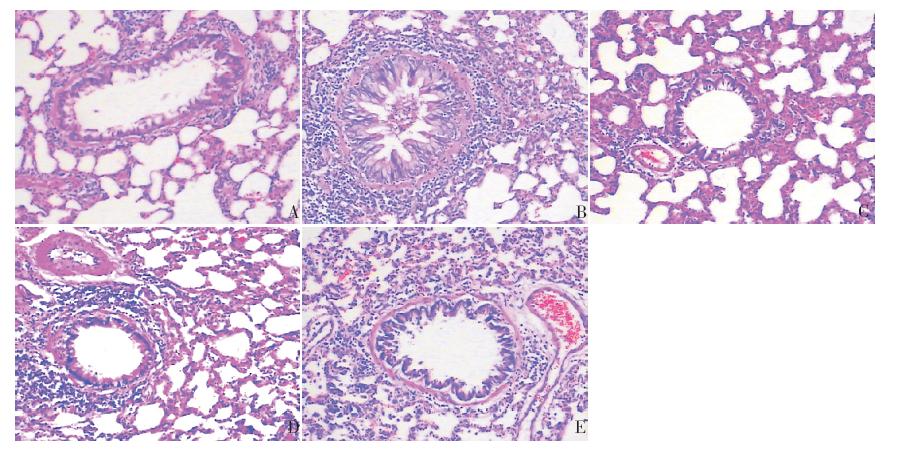 | 图 1 各组肺组织病理变化(HE 染色,×100) A:对照组,支气管管腔规则、黏膜上皮整齐,管腔内无炎性渗 出物及黏液栓,气道周围未见明显炎性细胞浸润;B:模型组支气管周围可见大量炎症细胞浸润,支气管内可见黏液栓,基底 膜稍增厚且形态不规则;C:BUD 组,气道周围炎症细胞浸润明显减少,气道分泌物及上皮细胞脱落少见;D:IPD(A)组, 气道周围炎症明显减轻,气道分泌物减少,支气管壁增厚及上皮细胞脱落现象较模型组明显改善;E:IPD(B)组,与IPD(A) 组类似,气道周围炎症较模型组明显改善。 |
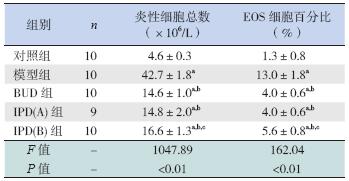
模型组BALF 中炎性细胞总数及EOS 百 分比较对照组明显增高,差异均有统计学意义 (P<0.05);BUD 组、IPD(A)组和IPD(B)组 炎性细胞总数及EOS 百分比较模型组明显降低, 差异均具有统计学意义(P<0.05)。其中,IPD(B) 组与IPD(A)组比较差异无统计学意义(P > 0.05), 但与BUD 组差异有统计学意义(P < 0.05),IPD(A) 组与BUD 组差异无统计学意义(P > 0.05)。见表 1。
|
|
表 1 各组BALF 中炎性细胞总数及EOS 百分比比较 (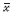 ±s) ±s)
|
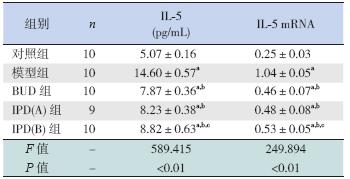
模型组BALF 中IL-5 的含量,肺组织IL-5 mRNA 表达明显高于对照组(P<0.01),差异有统 计学意义;与模型组比较,BUD 组、IPD(A)组 和IPD(B)组均明显降低(P<0.05),差异有统 计学意义。其中,IPD(B)组与IPD(A)组无统 计学差异(P<0.05),但与BUD 组有统计学差异 (P<0.05),IPD(A)组与BUD 组无统计学差异 (P>0.05)。见表 2,图 2。
|
|
表 2 各组大鼠BALF 中IL-5 含量和肺组织IL-5 mRN 的表达量 (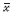 ±s) ±s)
|
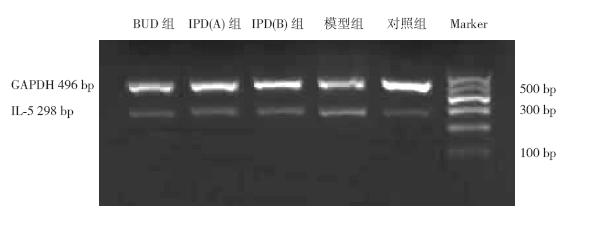 | 图 2 各组大鼠肺组织IL-5 mRNA 的RT-PCR 产物电泳图 |
目前,支气管哮喘的发病机制还不十分清楚, 可能与遗传、免疫、环境等有关。在免疫学上, 一般将哮喘的发病过程分为3 个阶段:初期为致 敏阶段,包括过敏原刺激、T 细胞激活、IL-4 产生、 IgE 合成和效应细胞释放介质;第2 期为慢性过敏 性炎症阶段,以Thl/Th2 细胞比例失衡、IL-5 增多 及EOS 活化、增多和聚集为特征,在哮喘发作过 程中起主要作用;第3 期以气道重构为特征,是 难治性支气管哮喘的重要原因[ 6 ]。因此,早期干预 和治疗是防止哮喘炎症发展的有效措施,对防止 气道重构尤为重要。IPD 是近年新开发治疗支气管 哮喘的一种药物,国外研究证实,IPD 是一种新型 的选择性Th2 细胞因子抑制剂,能抑制EOS 炎症, 进而降低IgE 抗体滴度,抑制肥大细胞脱颗粒和炎 症介质的释放,降低气道高反应性,改善气道炎 症[ 7 ]。另外IPD 能阻断单核细胞向树突状细胞(DC) 的分化、成熟和功能,促使Thl 反应增强[ 8 ]。其作 用靶点可能位于EOS 表面的氯离子通道[ 9 ],使该 药的作用机制受到了一些争论,因此,有必要对 IPD 的作用进行深入研究。本研究观察IPD 早期和 晚期干预对哮喘大鼠肺组织IL-5 mRNA 表达量、 BALF 中IL-5 的含量、BALF 中炎性细胞总数与 EOS 百分比的变化,发现模型组大鼠BALF 中IL-5 的含量增加及肺组织IL-5 mRNA 表达增强,经 IPD 早期和晚期干预后,其肺组织IL-5 mRNA 的 表达显著降低,BALF 中IL-5 含量下降,说明IPD 治疗哮喘的重要机制之一是通过抑制局部肺组织 IL-5 基因转录,减少IL-5 的生物合成,进而抑制 IL-5 对EOS 在气道的浸润、聚集和活化,降低气 道高反应性(airway hyperresponsiveness,AHR), 从而减轻哮喘气道炎症。
同时,本研究还采用临床上常用的吸入激素 BUD 泵雾化吸入作为阳性对照,将IPD 与BUD 的疗效相比较,发现BUD 同样能降低哮喘大鼠 BALF 中IL-5 的含量,抑制肺组织IL-5 的基因转录, 与IPD 有类似的作用。罗光伟等[ 10 ] 通过建立豚鼠 哮喘模型,发现地塞米松能抑制IL-5 基因转录, 进而抑制IL-5 对EOS 的聚集和活化,从而发挥其 抗气道炎症的作用,本研究结果与之一致。临床 上大多数患者已经呈Th2 优势反应,给予IPD 干 预能否逆转已经确立的Th2 优势反应的研究就显 得尤为重要。因此,本研究还设立了(晚期干预组) IPD(B)组,即在OVA 激发的第1 天(实验第15 天) 开始予IPD 灌胃干预。结果表明晚期给予IPD 也 可以抑制肺组织IL-5 的基因转录,降低BALF 中 IL-5 的含量,降低BALF 中炎性细胞总数,并且抑 制外周血EOS 的聚集。因此,本研究提示IPD 对 哮喘不仅有预防作用而且有治疗作用,为IPD 的 临床应用提供了进一步的理论依据。
| [1] | Wegmann M, Hauber HP. Experimental approaches towards allergic asthma therapy-murine asthma models[J]. Recent Pat Inflamm Allergy Drug Discov, 2010, 4(1):37-53. |
| [2] | Umetsu DT. Revising the immunological theories of asthma and allergy[J]. Lancet, 2005, 365(9454): 98-100. |
| [3] | Yoshihara S, Fukuda H, Arisaka O. Usefulness of suplatast tosilate, a Th2 cytokine inhibitor based on the Th1/Th2 ratio for allergic disease in children: a retrospective study[J]. Arzneimittelforschung, 2011, 61(7): 421-424. |
| [4] | 尹志勤, 曲书强, 张凤蕴, 等. 布地奈德对哮喘大鼠肺部炎 症及血清白细胞介素5 水平的影响[J]. 实用儿科临床杂志, 2006, 21(22): 1572-1573. |
| [5] | Matsumoto K, Hayakawa H, Ide K. Effects of suplatast tosilate on cytokine profile of bronchoalveolar cells in allergic inflammation of the lung[J]. Respirology, 2002, 7(3): 201-207. |
| [6] | 李文开, 李云, 钟礼立. 全反视黄酸对哮喘大鼠气道反应性和气道重塑的影响[J]. 中国当代儿科杂志, 2009, 13(10) : 827-831. |
| [7] | Takahior S, Go S, Wu MH, et al. Suplatast tosilate inhibits eosinophil production and recruitment into the skin in murine contact sensitivity[J]. Clin Immunol, 2003, 108 (3): 257-262. |
| [8] | Tanaka A, Minoguchi K, Samson KT, et al. Inhibitory effects of suplatast tosilate on the differentiation and function of monocyte-derived dendritic cells from patients with asthma[J]. Clin Exp Allergy, 2007, 37(7): 1083-1089. |
| [9] | Agrawal DK, Cheng G, Kim MJ, et al. Interaction of suplatast tosilate (IPD) with chloride channels in human blood eosinophils: a potential mechanism underlying its anti-allergic and anti-asthmatic effects[J]. Clin Exp Allergy, 2008, 38(2): 305-312. |
| [10] | 罗光伟, 孙洁民, 陈菁. 地塞米松对哮喘豚鼠气道白介素-5、 白介素-10 mRNA 表达及嗜酸性粒细胞凋亡的影响[J]. 中国 临床药理学与治疗学, 2006, 11(10): 1119-1121. |
 2014, Vol. 16
2014, Vol. 16