2. 青海省妇女儿童医院 院感科, 青海 西宁 810007;
3. 青海省妇女儿童医院 微生物室, 青海 西宁 810007
我院位于海拔2 260 米的高原地区,气候寒冷 干燥,紫外线强、风沙大。日温差约15℃ ~20℃, 空气氧含量约为平原的70%,人体处于缺氧代偿 状态。呼吸系统疾病发病率较高,常易并发急、慢性呼吸衰竭[1],机械通气是其关键的急救手段。 呼吸机相关性肺炎(ventilator associated pneumonia, VAP)是机械通气过程中常见并发症和重要的致死 原因之一,其病原菌对抗生素均有较高的耐药性。 病原菌的构成和耐药性的形成可能与高原的特殊 气候环境和细菌本身的生物学特性及抗生素的应 用有密切关系。本研究以VAP 患儿作为研究对象, 回顾性分析高原地区气候条件下VAP 病原菌的分 布特征与耐药情况,为临床治疗提供依据,并制 定相应有效的防治策略,现将结果总结如下。 1 资料与方法 1.1 研究对象
2011 年6 月至2013 年6 月我院儿童重症监护 室(PICU)收治的机械通气患儿364 例,其中发 生VAP 94 例(25.8%)。VAP 患儿中男58 例,女 36 例,年龄1~ 11 月48 例,1~3 岁27 例,4 ~15 岁19 例。原发疾病:重症肺炎38 例,急性呼吸 窘迫综合征24 例,格林- 巴利综合征2 例,中枢 神经系统感染18 例,颅内出血10 例,中毒2 例。 机械通气时间3~30 d,平均8 d,症状出现时间分 别为机械通气后的4~25 d。 1.2 VAP 诊断标准
(1)因非肺部感染和原有肺部感染性病变, 行机械通气治疗48 h 后,气管分泌物培养阳性或 出现新的病原菌;(2)X 线胸片出现新的浸润阴 影,伴有肺部罗音增多;(3)出现发热,外周血 白细胞>10×109/L。符合上述3 项标准者可诊断 VAP [2, 3]。 1.3 病原菌分离鉴定和药敏试验
使用一次性无菌吸痰管通过气管插管吸取患 儿下呼吸道分泌物。在进行接种之前先对标本进 行细胞筛选,以涂片镜下低倍视野检查鳞状上皮 细胞<10 个,白细胞>25 个为合格标本[4]。连续2 次培养出同一菌株被确定为病原菌,细菌占总数 60% 以上的优势菌或纯培养的细菌判为阳性菌, API 系统鉴定细菌。药敏测试用纸片扩散法,根据 美国临床实验室标准化委员会(NCCLS)制定的 药敏实验参考标准进行判断[5, 6]。 质控菌株分别为: 肺炎克雷伯菌(ATCC7OO6O3)、铜绿假单胞菌(ATCC27853)、大肠埃希菌(ATCC25922)、 金黄色葡萄球菌(ATCC25923)、白色念珠菌 (ATCC90028)。 2 结果 2.1 病原菌分布情况
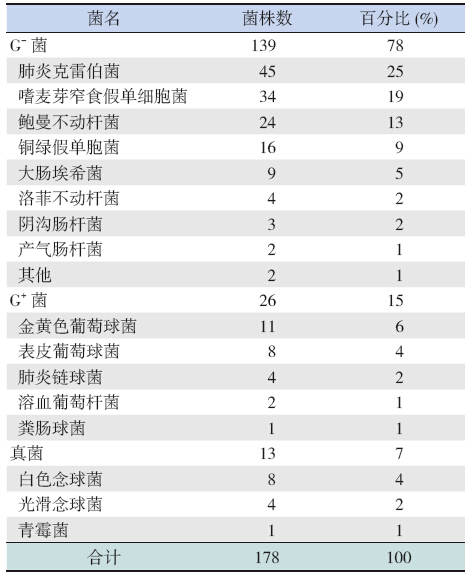
94 例VAP 患儿下呼吸道分泌物中,单一细菌 感染22 例(23%),72 例(77%)为混合感染, 63 例(88%)为2 种菌株感染,混合感染菌株中 以肺炎克雷伯菌与鲍曼不动杆菌最为常见(17 例, 27%),9 例(13%)患儿为3 种或3 种以上菌株 感染。94 例VAP 患儿共分离出178 株病原菌。G- 菌139 株(78%),其中以肺炎克雷伯菌(45 株, 25%)、嗜麦芽窄食假单胞菌(34 株,19%)、 鲍曼不动杆菌(24 株,13%)、铜绿假单胞菌(16 株,9%)为主。G+ 菌26 株(15%),以金黄色 葡萄球菌(11 株,6%)、表皮葡萄球菌中(8 株, 4%)为主。真菌感染分离出13 株(7%),主要 为白色念珠菌(8 株),其次为光滑念珠菌(4 株)、 青霉菌(1 株)。见表 1。
| 表 1 178 株病原菌分布 |
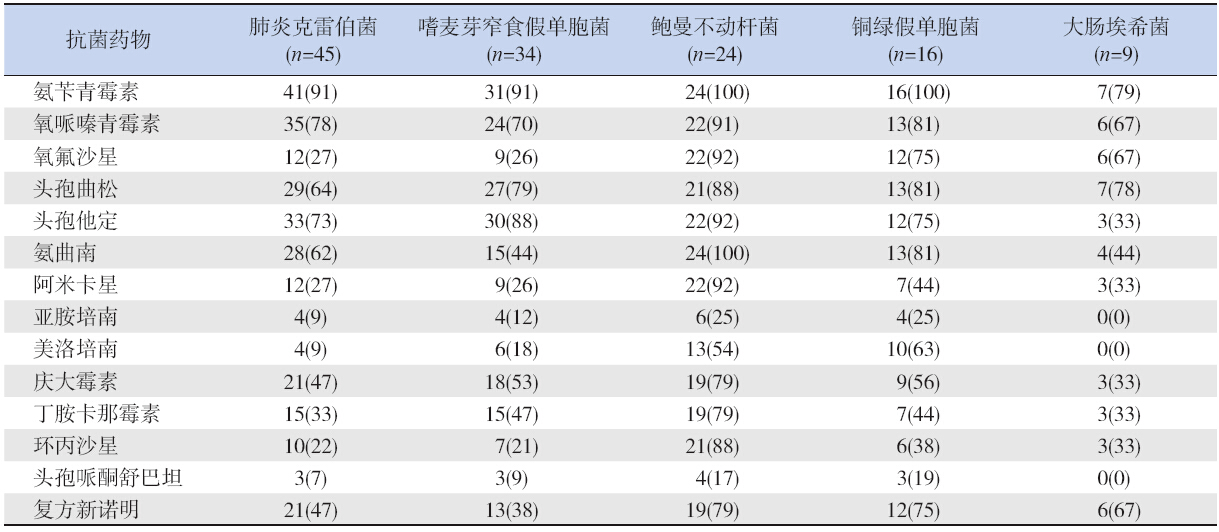
药敏结果显示,G- 菌中的肺炎克雷伯菌、鲍 曼不动杆菌、嗜麦芽窄食假单胞菌对大多数抗生 素耐药率均超过50% ,存在严重的多重耐药性。 铜绿假单胞菌、鲍曼不动杆菌广泛耐药,仅对亚 胺培南和头孢哌酮舒巴坦敏感;肺炎克雷伯菌、 嗜麦芽窄食假单胞菌、大肠埃希菌对喹诺酮、氨 基糖苷类、亚胺培南、美罗培南等抗生素均显示 出较高的敏感性。见表 2。
| 表 2 G- 菌耐药情况 |
分离出G+ 菌26 株,其中11 株金黄色葡葡球 菌中5 株耐甲氧西林,8 株表皮葡萄球菌中4 株耐 甲氧西林,且均为多重耐药,但对万古霉素、利 奈唑胺、替考拉宁敏感。 2.4 真菌耐药率监测情况
分离所得真菌13 株,以白色念珠菌为主的真 菌8 株中,2 株对氟康唑耐药,对两性霉素B 均敏感。 3 讨论
VAP 病原菌分布因地区、感染途径等不同而 有所差异[7]。我院地处高原地区,年平均温湿度远 远低于海平面。气候条件呈现高寒、干燥、低氧 以及医疗卫生水平相对落后等因素,使得VAP 病 原菌分布、耐药菌特点,与平原地区比较不尽相同。 本研究VAP 病原菌中G- 菌的构成与平原地区相似, 但与多数平原地区报告VAP 病原菌以铜绿假单胞 菌居首位有所不同[7, 8]。94 例VAP 患儿共分离出 178 株病原菌。G- 菌中铜绿假单胞菌(16 株,9%) 居第4 位;G+ 菌26 株(15%),以金黄色葡萄球 菌(11 株,6%)为主。这可能与高原的特殊气候 环境和细菌本身的生物学特性有密切关系。铜绿 假单胞菌与水源关系密切,在4℃潮湿环境中可长 期生存,分裂相细胞易发生冷休克而死亡[9],而高 原地区气候干燥可能成为铜绿假单胞菌并非G- 菌 的主要病原菌的原因之一。金黄色葡萄球菌的营 养要求不高,对环境抵抗力强,寒冷的环境中可 生存2 年以上[9],这就有可能形成了高原寒冷条件 下,金黄色葡萄球菌成为VAP 中G+ 菌中的主要病 原菌。
本研究还发现VAP 病原菌中的G- 菌以肺炎 克雷伯菌(45 株,25%)为首位,72 例(77%) 为混合感染,混合菌株中以肺炎克雷伯菌与鲍曼不 动杆菌混合最为常见(17 例,27%),分析这与 高原环境特征性因素有一定的关系。高原小儿正 常人体血氧饱和度为85%,肺泡氧分压为7.2 kPa。 缺氧造成代偿性呼吸频率增加,呼出水分增多, 痰液黏稠而不易咯出。这些高原的外环境—干燥、 低氧同时也促使血液黏稠、血流缓慢而导致缺氧 加剧,血管扩张,小儿呼吸系统屏障功能下降, 机械通气时空气及氧气直接进入气管,失去上呼吸道的湿化、温化、过滤的生理功能,使呼吸道 黏膜及纤毛运动功能障碍,加之无菌操作不严、 吸痰过频、负压过大、湿化不足、插管等机械性 创伤,使呼吸道黏膜屏障功能进一步降低,诸如 肺炎克雷伯菌、鲍曼不动杆菌等一些以往被认为 无致病力或致病力较弱的条件致病菌对气道黏膜 上皮黏附性增强并形成生物膜(biofilm),并导致 生物膜病(biofilm desease)而发生VAP。高原寒 冷、缺氧、空气干燥、紫外线强的特殊气候有利 于某些细菌的生长繁殖,而使之成为优势菌。因此, 控制调整重症监护室的温度、湿度,加强气道湿化, 避免过频吸痰应成为高原地区小儿VAP 防控重点。
本研究发现,G- 菌存在普遍的耐药性,常见 致病菌对大多数抗生素的耐药率均超过50%。由 于PICU 中往往长期大剂量应用广谱抗菌药物,常 导致正常菌群发生改变,大量的耐药致病菌在体 内定植,分离出的VAP 菌株具有广泛的多重耐药 性,且混合感染(77%)严重,导致临床抗菌药物 选择困难。本研究中肺炎克雷伯菌占25% ,在G- 菌中所占比例最高。肺炎克雷伯菌和大肠埃希菌 是产生ESBLs 的主要细菌,该酶除可水解青霉素 类、第1、2 代头孢菌素类抗菌药物,还能水解头 孢噻肟、头孢他啶等第3 代头孢菌素和氨曲南等 单环β- 内酰胺抗菌药物使之失活,从而产生耐药 性[10]。肺炎克雷伯菌、嗜麦芽窄食假单胞菌对于 喹诺酮类药物、氨基糖苷类药物等均有较高的敏 感性。有报道环丙沙星对革兰阴性杆菌有较高的 敏感性[11],可能是由于此两类抗生素因对小儿毒 性作用严重,临床很少应用的结果。鲍曼不动杆 菌仅对头孢哌铜/舒巴坦、亚胺培南高度敏感, 除此以外耐药性均>50%。以往认为头孢他啶以及 亚胺培南是治疗铜绿假单胞菌的高效药物,但是 本研究发现其同样具有一定程度的耐药性。G+ 菌 也存在多重耐药,耐甲氧西林的金黄色葡葡球菌 及表皮葡萄球菌仅对万古霉素、利奈唑胺、替考 拉宁耐药率较低。而以白色念珠菌为主的真菌部 分对氟康唑均产生耐药性,对两性霉素B 均敏感。 这可能与危重患儿儿抵抗力低以及广谱抗生素的 大量应用有关。
综上所述,本研究认为小儿VAP 的发生是多 因素的综合,既有外在的条件如高原地理及气候 环境、医疗与护理因素,也有患儿机体内在因素。 因此临床医师应分析、掌握VAP 流行菌株及其耐 药性特点,制定VAP 的重点防控措施,认真执行 无菌原则,避免滥用抗生素。而对于已经发生感 染的患儿可根据VAP 流行特点、细菌培养和药敏 试验,合理选用敏感抗生素,做到早期、足量及 个体化用药。
| [1] | 姚庆镛, 卢秀英, 韩锦玲, 等. 高原地区小儿急性呼吸衰竭 的临床研究[J]. 高原医学, 1993, 3(4): 24-26. |
| [2] | 许峰, 罗雁红. 呼吸机相关肺炎的诊断及治疗[J]. 小儿急救 医学, 2002, 9(4): 202. |
| [3] | 肖小六. 呼吸机相关肺炎的研究进展[J]. 临床内科杂志, 2012, 29(3): 209-211. |
| [4] | 虞燕波, 段美丽, 李昂, 等. VAP 诊疗进展[J]. 中国全科医学, 2007, 10(1): 72-74. |
| [5] | Wilke M, Grube RF, Bodmann KF. Guideline adherent initial intravenous antibiotic therapy for hospital-acquired, ventilatorassociated pneumonia is clinically superior, saves lives and is cheaper than non guide line adherent therapy[J]. Eur J Med Res, 2011, 16(7): 315-323. |
| [6] | Lagamayo EN. Antimicrobial resistance in major pathogens of hospital-acquired pneumonia in Asian countries[J]. Am J Infect Control, 2008, 36(4 Supp1): S101-S108. |
| [7] | 葛怡. 重症监护病房呼吸机相关肺炎的病原菌耐药性分析及 防治策略[J]. 临床肺科杂志, 2012, 17(12): 2271-2272. |
| [8] | 邓阳彬, 武海滨, 常文毅. 儿童重症监护室呼吸机相关肺炎 病原学分析[J]. 陕西医学杂志, 2008, 37(1): 53-54. |
| [9] | 王洪斌, 何代平, 蒋红梅, 等. 高原地区医院感染的细菌学 研究[J]. 西南军医, 2005, 7(2): 1-2. |
| [10] | 陈群英, 黄明海. 大肠埃希菌与肺炎克雷伯菌超广谱β 内 酰胺酶的临床分布及药敏分析[J]. 中华医院感染学杂志, 2008, 9(8): 1000-1002. |
| [11] | 周北燕, 卢光进. 环丙沙星治疗新生儿呼吸机相关肺炎的疗 效观察[J]. 中国当代儿科杂志, 2002, 4(5): 407-408. |
 2014, Vol. 16
2014, Vol. 16