支气管肺发育不良(bronchopulmonary dysplasia,BPD)是引起持续性呼吸窘迫的慢性肺 部疾病,近年来成为新生儿重症监护病房最为棘 手的问题之一。研究表明不同高浓度氧吸入导致 的BPD 的病理变化并不相同,大于80% 高氧吸入 所引起的肺组织病变以渗出、大量炎症细胞浸润、 胶原生成、严重纤维化为主。当吸入氧浓度在 60% 左右时肺组织的病变却是以肺泡简单化、间 隔变厚、发育迟滞为主要表现,炎症渗出和纤维 化较为轻微[1]。BPD 患儿肺组织中出现成纤维细 胞增生、细胞外基质(extracellular matrix,ECM) 沉积、肺组织纤维化[2]。肺纤维化是由多种原因引 起的,研究表明生长转化因子β(TGF-β)可影 响肺发育,同时也在不成熟肺高氧性肺损伤及纤 维化发生发展过程中扮演十分重要的角色,其中 TGF-β1 在体细胞系中所占的比例最高,活性最强, 致纤维化作用最突出[3]。纤溶酶原激活物抑制剂-1 (PAI-1)是纤维蛋白溶解系统的主要抑制剂, 其主要作用是抑制尿激酶型纤溶酶原激活剂 (urokinase type plasminogen activator,u-PA) 和组 织型纤溶酶原激活剂(tissue-type plasminogen activator,t-PA),纤溶酶原通过 t-PA 和 u-PA 转 化为纤溶酶,降解ECM 或纤维蛋白。近年来动物 实验研究表明,转基因大鼠肺组织内PAI-1 的密 度与肺纤维化的程度呈正相关,气管内滴入重组 u-PA 可以降低肺纤维化发生和病死率[4]。故推测 TGF-β1、PAI-1 可能参与了 BPD 中肺纤维化的病 理过程。本研究通过对早产儿血液中TGF-β1、 PAI-1 的蛋白表达进行检测,探讨两种因子在 BPD 发病中的变化,从而在其复杂的发病环节中找寻 新靶点,为今后临床治疗提供依据。 1 资料与方法 1.1 研究对象
2010 年1 月至2012 年12 月我院收治胎龄 ≤ 32 周、出生体重≤ 1 500 g 并存活28 d 以上的 早产儿96 例,其中男71 例,女25 例,胎龄25~32 周, 出生体重750 ~1 500 g,其中诊断为BPD 21 例(BPD 组),75 例非BPD 组为对照组。本研究经过医院 伦理委员会批准及家长知情同意。 1.2 BPD 诊断标准
2001 年美国国家儿童保健及人类发展研究院 (NICHD)根据末次月经后孕龄(PMA)定义了 BPD 的诊断标准:早产、低出生体重儿,有或无 机械通气治疗史,吸氧时间≥ 28 d 或到纠正胎龄 36 周仍需要氧疗,伴有持续性或进行性呼吸功能 不全及肺部典型影像学表现: 肺部CT 两肺野呈磨 玻璃状改变、多灶充气过度,如小囊状影(薄壁) 或网格状影(壁厚),纹理增粗、紊乱,条状密 度增高影和胸膜增厚等。病变多发生在两下肺, 常呈对称性。 1.3 标本采集
所有入选患儿分别于生后7 d、14 d、21 d 取 静脉血1 mL,注入促凝管,室温静置30 min 后 1 200 rpm 离心15 min,取上清转移至消毒后1.5 mL EP 管,标记后-20℃冰箱保存备用,ELISA 方法 检测TGF-β1 及 PAI-1 蛋白表达水平。 1.4 临床治疗
临床上尽早根据生后气促、发绀、呻吟及肺 部影像学等表现选择应用肺表面活性物质,必要 时应用呼吸机或选择性应用鼻塞持续气道正压通 气(nCPAP),有感染指征者控制感染,适当限制 液体量,反复呼吸暂停者给予氨茶碱。 1.5 统计学分析
采用SPSS l6.0 统计软件包处理,计量资料用
均数± 标准差(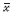 ±s)表示,两独立样本组间比
较采用成组t 检验;不同时间点的组间比较采用重
复测量多因素方差分析。P<0.05 为差异有统计学
意义。
2 结果
2.1 两组间TGF-β1 蛋白表达的比较
±s)表示,两独立样本组间比
较采用成组t 检验;不同时间点的组间比较采用重
复测量多因素方差分析。P<0.05 为差异有统计学
意义。
2 结果
2.1 两组间TGF-β1 蛋白表达的比较
BPD 组TGF-β1 于生后7 d、14 d、21 d 表 达逐渐增高,且明显高于同时间点非BPD 组,差 异有统计学意义(P<0.01);各时间点非BPD 组 TGF-β1 蛋白表达差异无统计学意义(P>0.05)。 见表 1 和图 1。
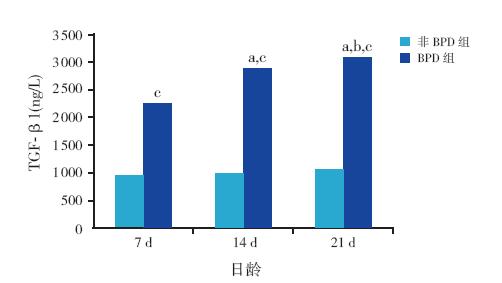 |
图 1 两组TGF-β1 蛋白的表达比较 注:a 示与同 组7 d 比较,P<0.01;b 示与同组14 d 比较,P<0.01;c 示与同时 间非BPD 组比较,P<0.01。 |
BPD 组PAI-1 蛋白表达于生后7 d、14 d、 21 d 逐渐增高,且明显高于同时间点非BPD 组,差异有统计学意义(P<0.01); 非BPD 组 PAI-1 蛋白表达在各个时间点差异无统计学意义 (P>0.05)。见表 1 和图 2。
| 表 1 两组TGF-β1 和PAI-1 蛋白的表达比较 |
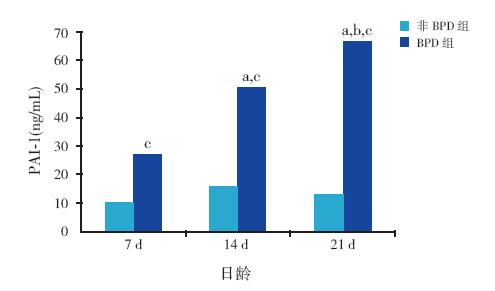 |
图 2 两组PAI-1 蛋白的表达比较 注:a 示与同组 7 d 比较,P<0.01;b 示与同组14 d 比较,P<0.01;c 示与同时间 非BPD 组比较,P<0.01。 |
新生儿处于特定的肺发育时期,对于各种刺 激具有独特的反应。早产儿出生时肺刚脱离小管期 进入囊泡期,由于肺发育不成熟,早产儿出生后比 足月儿更多暴露于机械通气、高浓度氧、炎症损伤 等不利环境之中。且早产儿本身对氧化应激易感, 抗氧化酶活性及维生素C、E 等自由基清除剂水平 均低[5]。因此新生儿肺损伤和肺纤维化中的机制可 能与成人不尽相同。氧中毒、气压伤或容量伤以及 感染或炎症等各种不利因素对发育不成熟的肺导 致的急性肺损伤,以及损伤后异常修复损伤是引起 “经典型”BPD 的主要原因[6]。胎龄<28 周的早产 儿宫内感染和(或)炎症发生率高达90%[7],体重 ≤ 1 250 g,呼吸机使用≥ 10 d,痰培养阳性3 次以 上是发生BPD 的独立危险因素[8]。
TGF-β1 不仅可以促进细胞外基质沉积,同 时影响其他纤维化细胞因子,导致纤维化发生。刘 冬云等[9] 在BPD 患儿肺灌洗液中检测到有IL-8、 SPA 及TGF-β1 的过高表达,孙永强等[10] 通过免 疫组织化学及免疫荧光技术发现死亡的BPD 患儿 肺组织内TGF-β1 表达明显增高,提示BPD 的发 生与炎症、TGF-β1 的高表达有着密切的关系。 本研究结果也显示在BPD 患儿血液中TGF-β1 表 达明显高于非BPD 组,与文献结果一致[7,8]。唐 仕芳等[11] 在新生大鼠高氧暴露同时给予外源性抗 TGF-β1 抗体干预,发现高氧引起的急性肺损伤明 显减轻,有效阻断了肺纤维化的发生、发展,提 示TGF-β1 蛋白的过度表达在BPD 患儿肺间质纤 维化中发挥着重要作用。
PAI-1 是内皮细胞型PAI,是PA 快速、专 一有效的生理抑制因子。u-PA 和PAI-1 作为纤溶 家族的主要成员,二者之间的比例和平衡决定着 ECM 转换的结局。正常肺泡腔内由于存在着u-PA 而保持着“净纤维蛋白溶解活性”,如果u-PA/ PAI-1 失衡,肺泡腔内渗出物不能清除,成纤维细 胞和其他细胞侵入、增殖并产生新的基质蛋白引 起瘢痕形成[12]。在脂多糖诱导的大鼠急性肺损伤 的动物模型的研究显示,高氧暴露24 h、48 h PAl- 1 mRNA 有上升的趋势,与正常空气组对比持续时 间延长[13]。本研究对象为≤ 32 周,体重≤ 1 500 g 的早产儿,肺组织发育不成熟,存在应用呼吸机、 肺部感染等所致的急性肺损伤的高危因素,BPD 组在7~21 d 的病程中PAl-1 的表达呈上升趋势, 提示PAI-1 参与了BPD 的发病过程。
动物试验发现新生大鼠高氧暴露早期u-PA 的 表达增多,与早期肺炎性细胞浸润等病理改变相 平行,随着高氧暴露时间延长,肺血管发育障碍 和内皮细胞受损,PAI-1 表达增强,肺组织u-PA/ PAI-1 表达的动态变化趋势与病理改变相平行,提 示u-PA/PAI-1 失衡参与了高氧致慢性肺疾病的发 生发展[12]。BPD 组患儿血液中生后7 d TGF-β1、 PAI-1 表达已增高,提示早产儿出生后不久已经有 了肺损伤的倾向。
研究显示肌成纤维细胞能分泌无活性 TGF-β1 和PAI-1,而后者与TGF-β 结合蛋白在 纤溶酶的作用下从基质中释放的过程有关[14]。 BPD 组在TGF-β1 增高的同时,PAI-1 的表达也 明显高于非BPD 组。因此,推测两种因子在BPD 的发病过程中可能起到了协同作用。目前已有文 献报道通过以慢病毒介导的小分子干扰RNA 技 术(siRNA)沉默TGF-β1 基因,可以达到对高 体积分数氧致新生小鼠肺损伤的保护作用[15]。关 于抑制PAI-1 基因表达的研究较少,有人认为干 扰素、一氧化氮、尿钠排泄因子和降脂药有抑制 PAl-1 表达的作用[16]。如果从不同的环节阻断或抑 制TGF-β1 及PAI-1 的表达,有可能阻断BPD 的 发病过程。
对于活体肺组织内TGF-β1、PAI-1 蛋白或 mRNA 表达方面的组织病理学研究仍有很大的局 限性。由于本研究仅从血液中检测到TGF-β1、 PAI-1 的高表达,有待于多中心、大样本及组织病 理学的研究论证,如能从不同的环节干预肺组织 EMC 的沉积,对BPD 的发病将起到明显的阻碍作 用。
| [1] | 付红敏, 许峰, 黄波, 等. 高氧暴露对早产鼠ACEII 生长增 殖的影响及CGRP 的干预作用 [J]. 第四军医大学学报, 2009, 30(5): 389-392. |
| [2] | Li LF, Liao SK, Ko YS, et al. Hyperoxia increases ventilator induced lung injury via mitogen-activated protein kinases: A prospective, controlled animal experiment[J]. Crit Care, 2007, 11(2): 126-140. |
| [3] | 张志梅, 封志纯. 转化生长因子-β1 在中浓度氧致新生鼠 支气管肺发育不良模型中的作用[J]. 山西职工医学院学报, 2010, 20(2): 1-4. |
| [4] | 张彦萍, 曹书颖. PAI-1 与肺纤维化[J]. 国外医学呼吸系统分 册 , 2005, 25(5): 343-344. |
| [5] | 常立文, 李文斌. “新型”支气管肺发育不良—超低出生体 重儿常见呼吸系统疾病[J]. 中国实用儿科杂志, 2012, 27(1): 7-10. |
| [6] | Bry K, Hogmalm A, Bäckström E. Mechanisms of inflammatory lung injury in the neonate: lessons from a transgenic mouse model of bronchopulmonary dysplasia[J]. Semin Perinatol, 2010, 34(3): 211-221. |
| [7] | Viscardi RM. Perinatal inflammation and lung injury[J]. Semin Fetal Neonatal Med, 2012, 17(1): 30-35. |
| [8] | 陈幽, 韩玉昆, 叶贞志, 等. 呼吸窘迫综合症并发支气管肺 发育不良危险因素分析[J]. 中国当代儿科杂志, 2007, 9(1): 15-18. |
| [9] | 刘冬云, 吴静, 张小英, 等. 支气管肺发育不良新生儿支气 管肺泡灌洗液IL-8, SPA 和TGF-β1 的表达[J]. 中国当代儿 科杂志, 2010, 12(6): 444-446. |
| [10] | 孙永强, 李秋平, 封志纯. 支气管肺发育不良患儿TGF-β1 蛋白表达的研究[J]. 中国妇幼健康研究, 2010, 21(4): 402- 405. |
| [11] | 唐仕芳, 朱洪春, 李华强, 等. 转化生长因子-β1 在新生 大鼠高浓度氧致肺损伤中的作用研究[J]. 重庆医学, 2009, 38(4): 438-440. |
| [12] | 刘雪雁, 薛辛东. 高氧致慢性肺疾病新生大鼠肺组织尿激酶 型纤溶酶原激活因子和纤溶酶原激活物抑制因子1 表达的 动态改变及意义[J]. 中华儿科杂志, 2008, 46(6): 458-463. |
| [13] | 陈扬, 陆铸金, 杨毅, 等. 一氧化氮和高氧吸入对大鼠急性肺 损伤PAI-1 表达的影响[J]. 中国小儿急救医学, 2008, 15( 会 议专辑): 174-177. |
| [14] | 王金星, 魏裔君, 李慧. TGF-β1 与慢性肺疾病研究进展[J]. 当代医学, 2009, 15(3): 40. |
| [15] | 段江, 陈洪清, 李然, 等. 慢病毒介导TGF-Bl siRNA 对高体 积分数氧致新生小鼠肺损伤的影响[J]. 第四军医大学学报, 2009, 30(9): 785-788. |
| [16] | Cho SH, Ryu CH, Oh CK. Plasminngen activator inhibitor-1 in the pathogenesis of asthm[J]. Exp Bid Med, 2004, 229(2): 138- 146. |
 2014, Vol. 16
2014, Vol. 16