2. 首都医科大学附属北京儿童医院 放射科, 北京 100045
近年来,中枢神经系统真菌感染病例有逐渐 增多的趋势[1, 2],2009~2011 年北京儿童医院共收 治5 例中枢神经系统白色念珠菌病(central nervous system candidiasis,CNSC)患儿[3],2012 年10 月至 2013 年7 月间又收治了5 例。本病缺乏特异性临 床表现,血常规、血C- 反应蛋白、脑脊液等检验 结果与化脓性脑膜炎、结核性脑膜炎相似,因此 诊断困难,容易误诊,绝大多数患儿来我院就诊 时病程已超过1 个月,延误了治疗时机,预后差。 尽早诊断,及时针对性的治疗可显著改善预后。 但由于微生物学检查的敏感性低[4, 5, 6],真菌培养耗 时长(至少2 周时间),且目前尚缺乏其他特异 性诊断手段,因此很难根据病原培养及时诊断, 尽早开展抗真菌治疗。在临床诊治过程中,我们 发现本病头颅影像学特征的改变,尤其增强头颅 磁共振成像(MRI)的改变有可能为及时诊断和评 估治疗效果提供客观依据,因此本研究对诊治病 例的临床资料进行了总结分析,现报道如下。
1 资料与方法 1.1 研究对象研究对象为2009~2013 年北京儿童医院收治 的CNSC 患儿10 例。患儿入院后根据临床表现及 MRI 改变怀疑为CNSC,均行血、脑脊液真菌培养 及1,3-B-D- 葡聚糖抗原(G 试验)、真菌细胞壁 成分曲霉菌半乳甘露聚糖抗原(GM 试验),后均 经脑脊液培养(2 次以上)确诊,其中1 例血培养 白色念珠菌阳性。
1.2 研究方法回顾性分析患儿的病历资料,收集发病年龄、 性别、临床表现、辅助检查、治疗、转归及预后 等资料,其中主要辅助检查包括:血常规、CRP、 血沉、脑脊液常规、生化、真菌培养、药敏试验、 G 试验、GM 试验、头颅MRI 等。9 例患儿于入 院后8 d 内首次行MRI 扫描,其中5 例同时行增 强MRI,治疗2~3 周后第1 次复查MRI 了解颅内 病变变化、评估治疗效果,以后根据病情2 周至3 个月监测头颅MRI,了解病变恢复情况及评估预 后。
2 结果 2.1 一般资料10 例患儿中,男、女各5 例,年龄3 个月至8 岁, 其中≤ 5 个月 8 例,1 例11 个月,1 例8 岁。9 例 入院诊断为化脓性脑膜炎,1 例(病例3)诊断为 可疑CNSC。1 例存在新生儿缺血缺氧性脑病病史, 1 例存在新生儿期败血症、肺炎病史,均经治疗后 痊愈;2 例为早产儿;1 例同时合并巨细胞病毒感染。 10例患儿均无原发性或继发性免疫缺陷病家族史。
2.2 临床表现10 例患儿均表现为反复发热,中高热为主, 热型不规则;1 例以脑梗死起病,表现为局限性抽 搐、偏瘫;1 例以发现脑积水起病,1 例病程中伴 反复头痛,3 例伴反复腹泻,5 例病程中有抽搐发作。 阳性体征主要包括:2 例患儿颈项强直,1 例患儿 右侧眼裂稍大、右侧鼻唇沟变浅、且存在四肢肌 张力偏高,1 例患儿病理征可疑阳性,1 例患儿病 程中逐渐出现脑梗死体征(右侧肢体偏瘫)。
2.3 实验室检查结果血常规检查:WBC 4.9~15.68×109/L, N 0.21~0.81,Hb 74~111 g/L;CRP 均正常; 血 沉2 例未检查,其余8 例均正常;脑脊液常规: WBC 58~3 584×106/L,多核48%~90%; 葡萄糖 0.72~2.0 mmol/L,蛋白782~4 012 mg/L。血G 试验 阳性2 例,2 例未做此项检查,血GM 试验除2 例 未检查外均呈阴性(其中2 例患儿先后2 次检查G、 GM 试验);免疫功能检查:Ig 系列、CD 系列均 未见明显异常。10 例患儿均经脑脊液真菌培养发 现白色念珠菌(2 次以上)生长,获得阳性结果时 间为入院后14~23 d。
2.4 头颅MRI 检查情况及其动态变化4 例患儿入院前曾行头颅MRI 检查(表 1), 其中3 例在病程第7 天首次检查:病例4 和7 未 见异常;病例3 和5 同时进行了增强MRI 检查: 病例3 呈脑积水、脑脓肿、脑膜脑炎,据此疑诊 CNSC,并行脑脊液真菌培养(标本送检后2 周获 得阳性结果),同时予抗真菌治疗(静脉注射氟 康唑10 mg/kg);病例5 呈脑膜脑炎改变。外院诊 疗过程中均未复查MRI。10 例患儿入院后9 例于8 d 内(约病程的9~67 d)行首次头颅MRI 检查, 其中5 例同时行增强MRI;另1 例头颅CT 检查显 示脑膜脑炎改变,基底节区低密度改变,后放弃 治疗。
| 表 1 9 例CNSC患儿头颅MRI动态变化 |
9 例患儿中,1 例MRI 未见异常,其余均有 脑膜脑炎改变。6 例患儿头颅MRI 出现感染后脑 血管受累表现,包括脑梗死(2 例)、静脉窦栓塞(3 例)及Moyamoya 样改变(1 例)。3 例患儿经增 强头颅MRI 证实存在感染性肉芽肿病变(MRI 平 扫均未能提示相应病变),表现为颅底多发小团块、 小结节影,不规则强化。1 例(病例3)增强MRI 显示脑脓肿,表现为左额叶类圆形异常信号周边 环形强化。
根据患儿临床表现及上述MRI 特征性改变, 患儿临床疑诊CNSC,分别于MRI 检查报告后第2 天行血、脑脊液真菌培养,血、脑脊液G 试验和 GM 试验,其中7 例患儿同时给予了抗真菌治疗。 另3 例患儿于脑脊液培养结果回报后予抗真菌治 疗。10 例患儿均为静脉给药。其中2 例单用氟康唑; 1 例联用氟康唑和氟胞嘧啶;7 例联合应用两性霉 素B、氟胞嘧啶和氟康唑,其中2 例因疗效欠佳后 期更换为伏立康唑。1 例患儿因重度脑积水,请神 经外科会诊后行Omaya 囊植入术,定期抽取侧脑 室液缓解颅高压。10 例患儿均未行鞘内注射治疗。 疗程至少2 个月。全部病例抗真菌治疗后2 周、4 周、 出院后复诊过程中定期复查头颅MRI,结果显示, 6 例患儿于治疗3~4 周后脑膜强化及肉芽肿等病变 逐渐缩小,脑梗死范围减小并出现脑软化、胶质增生,但治疗4~6 周后复查上述病变变化不显著, 复查中脑萎缩改善不明显。10 例患儿头颅MRI 检 查具体情况见表 1,典型MRI 改变见图 1~2。
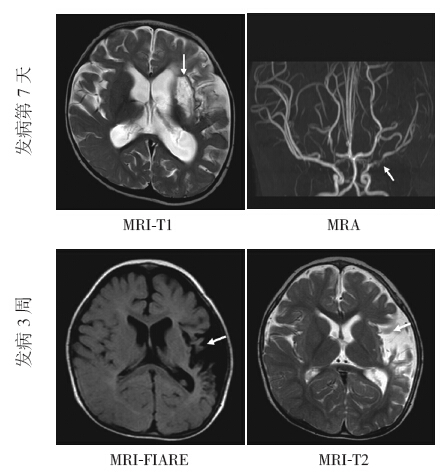 |
图 1 病例5 MRI检查结果的动态变化发病后第7天,左侧大脑中动脉梗死,MRI-T1 示左侧大脑中动脉走行区高信号(箭头所示);MRA示左侧大脑中动脉主干狭窄,分支减少、狭窄(箭头所示)。发病后3周,上述病变部位形成脑软化灶,MRI-FlARE 示左颞叶大脑中动脉走行区脑实质片状低信号(箭头所示);MRI-T2示同一部位脑实质呈高信号(箭头所示),左侧侧脑室扩大。 |
 |
图 2 病例1 治疗前后增强MRI的变化治疗前视交叉、鞍上池、脑干周围可见感染性肉芽肿病变,呈小结节、小条状强化(箭头所示)。经抗真菌治疗后2 周,上述各部位感染性肉芽肿病变较前减少,强化程度减低。 |
CNSC 的尽早诊断、合理治疗、减少中枢神经 系统不良结局一直是困扰儿科医生的重要问题之 一。近年来,血液标本中GM 试验和G 试验的检测, 成为诊断侵袭性真菌感染的参考依据之一。有报 道显示血清特异性抗原检测成功应用于粒细胞缺 乏患者的深部真菌感染早期诊断[7],其结果与组织 活检有着很好的一致性[8],人们期望它在非粒细胞 缺乏的重症患者中也有一定作用,但未能得出相 对一致的结论[9]。本研究中的全部病例以脑脊液培 养确诊,但真菌培养耗时长,不能用于早期诊断, 不利于及时抗真菌治疗;只有2 例患儿G 试验阳性, 亦提示这两项检测指标可能在诊断非中性粒细胞 缺乏的CNSC 方面敏感性欠佳。
CNSC 病理改变主要有以下几种类型:脑膜脑 炎型、脑脓肿型和原发性肉芽肿型及血管并发症 型[10, 11, 12]。这些病理改变常同时存在并可体现在影 像学特征上。脑膜脑炎型及脑脓肿型很难与细菌 性脑膜炎、脑脓肿相鉴别,但CNSC 的脑脓肿型 主要表现为多发微小脓肿,MRI 上呈多发、弥漫 性粟粒样结节,分布广泛,增强MRI 可有环形强 化[13, 14, 15]。本研究中病例3 病程第7 天时行头颅增强 MRI,显示脑膜脑炎、左额叶单发小类圆形异常信 号影,周边环形强化,而非多发粟粒样结节(MRI 平扫未提示此病变),与报道不同[13],可能与患 儿年龄及免疫功能状态有关。这例患儿据此疑诊 为CNSC,并加用抗真菌治疗,后经脑脊液培养证 实为本病。
肉芽肿主要为巨噬细胞和异物巨细胞形成, 增强MRI 上常表现为团块状、不规则状、小结节 影,不规则强化,是真菌感染的特征性改变之一。 本组病例1、2、5 患儿MRI 平扫无明显阳性表现 或表现为局部小斑片状短T2 等T1 信号,而增强 MRI 显示多发感染性肉芽肿病变,表现为明显小 结节、小团块、不规则形强化等,这3 例患儿根 据临床表现和上述MRI 特征疑诊CNSC[16],并及时 加用了抗真菌治疗。
CNSC 肉芽肿病变有时具有结核样结节或干酪 样坏死,易误诊为结核性脑膜脑炎。结核性脑膜 炎系结核分枝杆菌经血行播散至脑组织,发生以T 淋巴细胞为主的变态反应,最终导致肉芽肿的形 成;此病主要经历脑膜炎期、脑炎期和肉芽肿形 成期,与其颅内病理改变相对应;脑膜炎期即我 们所说的结核性脑膜炎,后两期称之为脑结核瘤。 结核性脑膜炎的MRI 可出现脑膜脑炎(包括结核 瘤)、脑梗死与脑积水等主要改变[17],其脑膜强 化表现为脑膜线形强化,主要强化的脑膜位于脑 底部的脑池内[18],呈“五角星”状,多数病例脑 膜出现多发的大小不等的结节样和环形强化,可 出现脑基底池闭塞,脑积水;肉芽肿型病变增强 后病灶均匀强化,周围脑组织水肿较重,若出现 干酪样坏死,增强后呈环状强化,表现为典型的“环 靶征”,其部位相对于CNSC 更局限,而并发脑积 水更为常见。晚期结核瘤周围的包膜还可发生钙 化。根据结核性脑膜炎的发病机理,本病患者常 同时存在其他脏器结核灶,最常见的为肺内结核 灶。上述特征可以与CNSC 相鉴别,但遗憾的是增 强MRI 很难在基层医院推广,且与影像科医生的 诊断水平相关。
CNSC 常常合并颅内血管并发症,MRI 也有 相应改变。本组病例中6 例出现血管炎并发症, 其影像学改变主要表现为静脉窦栓塞、脑梗死和 Moyamoya 样改变。这在其他类型的中枢神经系统 感染、脑膜瘤、颅内转移瘤中极为少见。但有些 学者认为,结核性脑膜炎亦可合并脑梗死,出现 脑梗死对结核性脑膜炎的诊断有重要意义[19, 20], 但这常出现在中晚期患者,常伴有结核瘤、钙化, 可以鉴别。
本研究中,病例1、2、5 治疗极困难,这些 患儿均存在颅内感染性肉芽肿病变,后2 例同时 存在颅内血管病变,治疗2 周后复查头颅MRI 示 病变较前加重,其中1 例放弃治疗,另2 例调整 为伏立康唑治疗,患儿病情逐渐改善,2 周后监测 头颅MRI 较前好转。
综上所述,头颅MRI 检查,尤其增强头颅 MRI 对疑似诊断CNSC 和评估治疗效果有重要意 义,建议临床医师对怀疑本病的患儿尽早行增强 头颅MRI 检查,对早期无特征性病变的、抗感染 治疗效果欠佳的应定期复查MRI(2~3 周复查1 次 较为合适),以及时提供诊断依据,即使脑脊液 还没有明确的真菌感染依据,仍可尝试诊断性抗 真菌治疗。值得进一步开展更多病例的病例对照 研究,以明确CNSC 和其他感染头颅MRI 特征性变化,及其对诊断、治疗和预后的指导意义。必 须指出的是,CNCS 病例的MRI 改变有时很难与其 他中枢神经系统感染明确鉴别,确诊仍需结合其 病例临床特征[3] 和微生物学检查结果。
志谢:北京儿童医院儿科研究所微生物室姚 开虎副研究员对本文的撰写和修改提出了宝贵意 见,在此表示感谢。
| [1] | Raparia K, Powell SZ, Cernoch P, et al. Cerebral mycosis: 7-year retrospective series in a tertiary center[J]. Neuropathology, 2010, 30(3): 218-223. |
| [2] | Rajshekhar V. Surgical management of intracranial fungal masses[J]. Neurol India, 2007, 55(3): 267-273. |
| [3] | 胡冰, 陈荷英, 刘钢, 等. 婴儿中枢神经系统白色念珠菌病5 例并文献复习[J]. 中国循证儿科杂志, 2011, 6(5): 386-390. |
| [4] | Sánchez-Portocarrero J, Pérez-Cecilia E, Corral O, et al. The central nervous system and infection by Candida species[J]. Diagn Microbiol Infect Dis, 2000, 37(3): 169-179. |
| [5] | Moylett EH. Neonatal candida meningitis[J]. Semin Pediatr Infect Dis, 2003, 14(2): 115-122. |
| [6] | Faix RG, Chapman RL. Central nervous system candidiasis in the high-risk neonate[J]. Semin Perinatol, 2003, 27(5): 384-392. |
| [7] | Park SY, Kim SH, Choi SH, et al. Clinical and radiological features of invasive pulmonary aspergillosis in transplant recipients and neutropenic patients[J]. Transpl Infect Dis, 20l0, 12(4): 309-315. |
| [8] | Torelli R, Sanguinetn M, Moody A, et a1. Diagnosis of invasive aspegillosis by a commercial real-time PCR assay for aspergillus DNA in bronchoalveolar lavage fluid samples from high-risk patients compared to a galactomaonnan enzyme immunoassay[J]. J Clin Microbiol, 201l, 49 (12): 4273-4278. |
| [9] | 许攀峰, 周建英, 周华, 等. 血清抗原检测联合肺部CT 诊断 侵袭性肺曲霉病的探讨[J]. 浙江大学学报( 医学版), 2012, 41(3): 332-338. |
| [10] | Chen TL, Chen HP, Fung CP, et al. Clinical characteristics, treatment and prognostic factors of candial meningitis in a teaching hospital in Taiwan[J]. Scand J Infect Dis, 2004, 36(2): 124-130. |
| [11] | Sanchez-Portoacarrero J, Perez-Cecilia E, Corral O, et al. The central nervous system and infection by candida species[J]. Diagn Microbiol infect Dis, 2000, 37(3): 169-179. |
| [12] | Pappas PG, kauffman CA, Andes D, et al. Clinical practice guidelines for the management of candidiasis, 2009 update by the Infectious Disease Society of Ameriea[J]. Cin Infect Dis, 2009, 48(5): 503-535. |
| [13] | 毛健, 李娟, 陈丹, 等.核磁共振成像在早产儿白色念珠菌感染脑脓肿诊断中的意义[J]. 中国当代儿科杂志, 2011,13(8): 621-626. |
| [14] | Lai PH, Lin SM, Pan HB, et al. Disseminated miliary cerebral candidiasis[J]. AJNR Am J Neuroradiol, 1997, 18(8): 1303- 1305. |
| [15] | Huang CC, Chen CY, Yang HB, et al. Central nervous system candidiasis in very low-birth-weight premature neonates and infants: US characteristics and histolopathologic and MR imaging correlates in five patients[J]. Radiology, 1998, 209(1): 49-56. |
| [16] | 中华医学会“念珠菌病诊治策略高峰论坛专家组. 念珠菌病 诊断与治疗: 专家共识中国感染与化疗杂志, 2011, 11(2): 81- 95. |
| [17] | 彭如臣, 沈秀芝, 高焕峰, 等. 粟粒性脑结核病的MR 特征[J]. 中华放射学杂志, 2006, 40(12): 1254-1255. |
| [18] | Haris M, Gupta RK, Husain M, et al. Assessment of therapeutic response in brain tuberculomas using serial dynamic contrastenhanced MRI[J]. Clin Radiol, 2008, 63(5): 562-574. |
| [19] | Kim HJ, Shim KW, Lee MK, et al. Tuberculous encephalopathy without meningitis: pathology and brain MRI findings[J]. Eur Neurol, 2011, 65(3): 156-159. |
| [20] | Chatterjee S, Saini J, Kesavadas C, et al. Differentiation of tubercular infectionand perfusion magnetic resonance imaging[J]. J Neororadiol, 2010, 37(3):167-171. |
 2014, Vol. 16
2014, Vol. 16