出生缺陷(birth defect)是指存在于婴儿或 出生前的胚胎发育紊乱引起不同器官的结构性畸 形[1]。美国报道最常见的出生缺陷有先天性心脏病 (CHD)、神经管缺陷(NTD)及颅面畸形等,其 中包括带或不带腭裂的唇裂(CL/P)和单纯的腭裂 (CPO)[2]。1987 年中国945 所医院出生缺陷调查 结果表明,全国住院围产儿出生缺陷发生率为131/ 万,其中以山西省最高(204/ 万)[3]。2002~2004 年北大人口所流行病学在我国山西发现出生缺陷 发生率为537.2/ 万,常见的类型为无脑畸形(Ane)、 CHD、脊柱裂(SB)、先天性脑积水(Hyd)和脑 膨出(Enc)[4]。而出生缺陷除了单发外,部分表现 为复杂畸形[5, 6]。但是他们是否存在发病的共同形 态学基础或者共同分子机制,目前不能十分确定。
目前研究表明,遗传和环境因素都参与了出 生缺陷的发生[1]。叶酸在维持胚胎正常发育方面起 着非常重要的作用[2],人类叶酸缺乏可引起多种出 生缺陷的发生率升高[7]。动物孕期叶酸缺乏可导致 流产、死产及子代多发畸形[8, 9]。研究表明孕期补 充叶酸可以预防NTD 和其他先天畸形的发生[10]。
叶酸参与核苷酸的合成和甲基转移反应,对 DNA 和蛋白质的甲基化修饰非常重要。研究表明 叶酸和同型半胱氨酸代谢途径相关的基因单核苷 酸多态性(SNP)位点与出生缺陷相关[11, 12, 13, 14]。其中 常见的包括5,10 甲基四氢叶酸还原酶(MTHFR) SNP 位点rs1801133(c.677C>T)和蛋氨酸合成酶 还原酶(MTRR)SNP 位点rs1801394(c.66A>G)。 研究表明rs1801133 与唇腭裂、NTD 及CHD 等 相关[11, 12, 15, 16, 17, 18],rs1801394 与CHD 及NTD 相 关[13, 14, 19]。而这些畸形来源于胚胎早期的不同胚层,以往文献均从单个表型研究叶酸与疾病的相 关性,对于单个病例同时具有来源于多个器官的 畸形的研究少见报道,因此本研究拟研究是否多 发畸形的发生与叶酸相关,进一步探讨rs1801133 和rs1801394 与胚胎发育的某个胚层相关。
1 资料与方法 1.1 研究对象病例组为中国山西省因死胎或畸形引产的出 生缺陷胚胎250 例,标本库的建立见本课题组以 往文献[20]。已登记信息的孕妇由当地经过培训的 临床医生经B 超检查确诊,然后在数据库中注册。 在250 例出生缺陷病例中包括CHD、NTD 和颅面 畸形等复杂畸形,胎龄均为13 周以上。另选取 420 例相关地区内健康受试者作为正常对照。本研 究通过首都儿科研究所伦理委员会批准,并获得 父母知情同意。
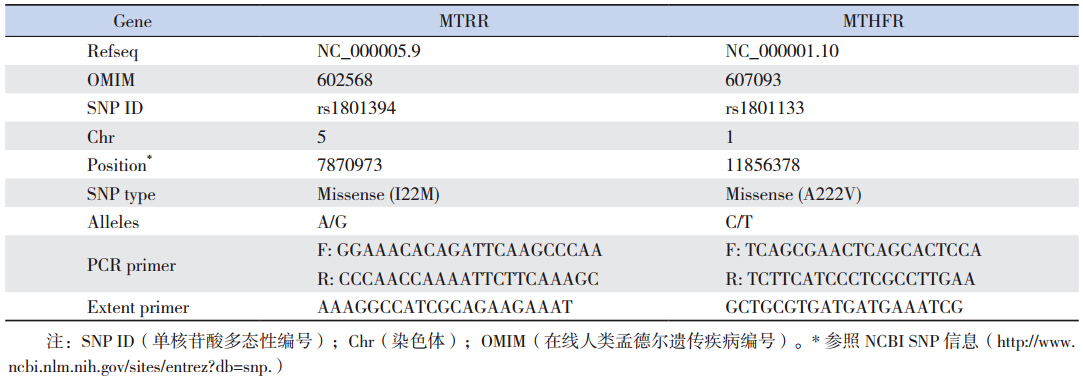
1.2 SNP 鉴定和基因分型选择病例组和对照组肌肉组织提取基因组 DNA,用血液和组织DNA 提取试剂盒(QIAGEN, 德国)提取,操作按照说明书进行。 DNA 的浓度 和纯度通过260 nm 和280 nm 吸光值进行测定。 SNPs 利用SNaPshot 分析(ABI)基因分型。简言之, 基因组DNA,通过使用表 1 中所列的引物扩增。 然后纯化,得到模板,其中包括靶SNP 位点。根 据说明书,延伸引物(表 1)和多重快照加入到模 板和热循环反应完成。随后基因在ABI3730(GE, 美国)自动测序仪上进行分型样品的运行,并通 过Peakscan 软件进行分析。
| 表 1 MTRR rs1801394 与MTHFR rs1801133 的SNP 信息 |
正常对照的Hardy-Weinberg 平衡(HWE)由 χ2 检验测试,OR 值和95%置信区间(CI)之间的 关联的计算与调整使用SNPStats 网站进行年龄校 正后的logistic 回归分析(http://bioinfo.iconcologia. net/snpstats/start.htm)。对每个SNP 位点进行共显 性模式,显性模式,隐性模式和对数模式的分析。 并采用SPSS 15.0 软件(SPSS) 进行统计分析, P<0.05 为差异有统计学意义。
2 结果 2.1 疾病表型描述与分类本研究根据2010 公布的疾病和有关健康问 题的国际统计分类第10 次修订(ICD-10)版本 (图 1A)为病例组的出生缺陷分型。根据表型发 育来源分成外胚层、中胚层和内胚层(图 1B)。 并将具有2 个或多个不相关的主要结构性畸形、 不能由1 个基本综合征来解释的定义为复杂先天 畸形[5, 21]。本研究病例组单个样本最多存在8 种畸形。
 |
图 1 来源于3 个胚层的出生缺陷分型注:A 图表示正常情况下3 个胚层来源的组织和器官;B 图表示来源于不同胚层的畸形分类,分为外胚层、内胚层和中胚层。Ane: 无脑儿;SB:脊柱裂;Enc:脑膨出;Hyd:先天性脑积水;Cra:颅面畸形;Cle:唇裂和腭裂;CMAG:肾上腺先天畸形;CMRS:呼吸系统先天畸形;CHD:先心病;CMSBT: 脊柱和骨性胸廓的先天畸形;CFS:短颈综合征;LM:四肢畸形;CMS:脾脏先天畸形;CMUS:泌尿系统先天畸形;Cel:腹裂;CMRS:呼吸系统先天畸形;SMDS:消化系统先天畸形。 |
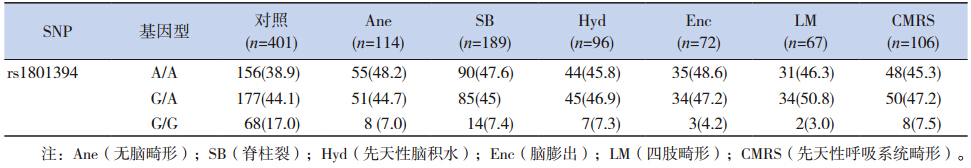
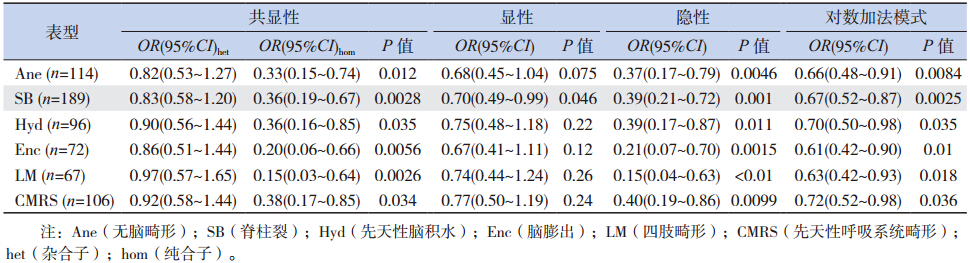
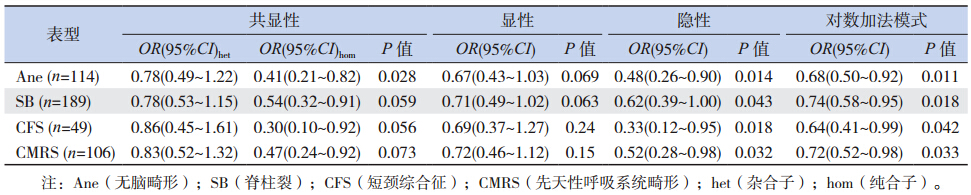
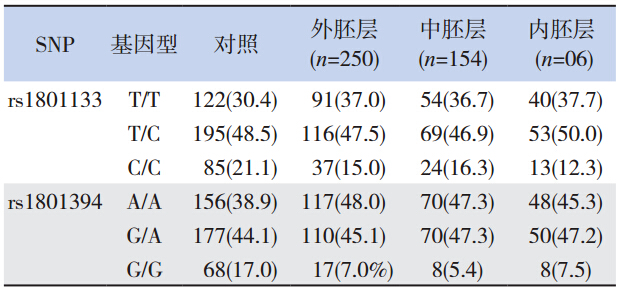
为研究SNP 位点rs1801394 和rs1801133 是 否与出生缺陷和胚层发育相关,用SNaPshot 方 法对这2 个SNP 位点进行基因分型。结果表明, rs1801394 对照组病例共401 例,其中GG 基因型 为68 例(17.0%)。GG 基因型在Ane 中占7.0%, 在SB 中占7.4%,在Hyd 中占7.3%,在Enc 中 占4.2%,在四肢畸形(LM)中占3.0%,在先天 性呼吸系统畸形(CMRS) 中占7.5%( 表 2)。 rs1801394 的隐性纯合的OR 和95% CI 在Ane 样 本中为0.37(0.17~0.79),SB)为0.39(0.21~0.72), Hyd 为0.39(0.17~0.87),Enc 为0.21(0.07~0.70), LM 为0.15(0.04~0.63)和CMRS 为0.40(0.19~0.86)(表 3)。表明在隐性模型下,携带GG 基因型 的个体发生先天缺陷的概率低。提示MTRR 的 rs1801394 隐形纯合是复杂先天畸形的保护性因素。
| 表 2 MTRR rs1801394 在各畸形分型和对照中的基因型分布 |
| 表 3 病例组和对照组 MTRR rs1801394 多态性分析 |
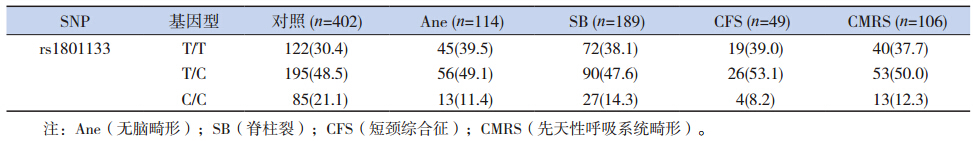
rs1801133 的CC 基因型为85 例(21.1%)。 CC 基因型在Ane 中占11.4%,在SB 中占14.3%, 在短颈综合征(CFS)中占8.2%,在CMRS 中占 12.3%(表 4)。rs1801133 隐性纯合的OR 和95% CI 在Ane 中为0.48(0.26~0.90),在SB 为0.62 (0.39~1.00),在CFS 中为0.33(0.12~0.95), 在CMRS 中为0.52(0.28~0.98)(表 5)。表明在 隐性模型下,携带CC 基因型的个体发生先天缺陷 的概率低。提示MTHFR 的rs1801133 隐性纯合是 复杂先天畸形的保护性因素。
| 表 4 MTHFR rs1801133 在各畸形分型和对照中的基因型分布 |
| 表 5 病例组和对照组 MTHFR rs1801133 多态性分析 |
rs1801394 和rs1801133 与多种胚层来源不同 的先天性畸形相关,提示rs1801394 和rs1801133 可能与胚胎早期发育相关,胚胎早期发育为3 个 胚层(图 1B),多发畸形可能起因于一个共同的 早期营养因素叶酸的缺乏。因此,本研究进行了 rs1801394 和rs1801133 与3 个胚层(图 1B)风险 的关联分析。结果表明,rs1801133 CC 基因型在对 照中的比例是21.1%,在外胚层、中胚层和内胚层 中分别是15%,16.3%,12.3%。而rs1801394 GG 基因型在对照、外胚层、中胚层和内胚层中的比 例分别为17%、7%、5.4% 和7.5%(表 6)。在内、 外胚层组,rs1801133 的隐性纯合子OR 和95% CI 分别为0.52(0.28~0.98) 和0.67(0.44~1.02), 其中rs1801133 在外胚层缺陷组中隐性模式比较P 值为0.057,经对数加法模型的校正分析,其OR 和95% 可信区间为0.77(0.61~0.97),P 值为0.024,差异有统计学意义。而rs1801394 的隐性 纯合子OR 和95% CI 分别为0.37(0.21~0.64)和 0.40(0.19~0.86)。在中胚层组只有rs1801394 的 隐性纯合子比值比(OR)和95%可信区间为0.28 (0.13~0.60)(表 7)。提示rs1801133 隐性纯合 作为保护性因素与内、外胚层来源复杂先天畸形 相关,rs1801394 隐性纯合作为保护性因素与3 个 胚层来源的先天畸形相关。
| 表 6 MTRR rs1801394 和MTHFR rs1801133 在对照和 3 个胚层来源的畸形中的基因型分布 |
| 表 7 MTRR rs1801394 与MTHFR rs1801133 与三胚层缺陷之间的相关性 |
本研究发现,在中国山西复杂先天畸形人群 中,MTRR GG 型和MTHFR CC 型是复杂先天畸形 的保护性因素。MTHFR 的rs1801133 和MTRR 的 rs1801394 隐性纯合都是外胚层来源和内胚层来源 器官发育的保护性因素。而MTRR 的rs1801394 隐 性纯合是中胚层来源器官发育的保护因素。
本研究提示在人类样本中,出生缺陷与环 境营养因素叶酸相关,这与以往的研究一致[22]。 以往的研究表明在小鼠模型上,编码铁转运的 Ferroportin(Slc40a1)基因敲除可导致原肠胚发育 形成的内胚层缺陷,Ferroportin 基因突变的胚胎可 见发育迟缓、露脑畸形、小眼畸形和全身性水肿 等表型[23]。Tao 等[24] 对小鼠的研究表明,平面细 胞极性通路(PCP)核心基因- PRICKLE1 基因缺 失导致内胚层迁移和原条形成异常,从而引起内 胚层发育缺陷。Bassuk 等[25] 发现纯合PRICKLE1 突变可以引起常染色体隐性渐进性肌阵挛癫痫, 共济失调综合征,而且这一突变也是通过导致原 肠胚发育缺陷而产生相应的表型。这些证据表明, 在胚胎发育的早期阶段,突变可引起胚层发育异 常而导致胚胎的发育缺陷。此外,Ferroportin 基因 和PRICKLE1 基因突变均导致内胚层发育缺陷也 给本研究提供了一个早期基因的异常能导致发育 中的三胚层发育异常的线索。
叶酸是一种重要的环境营养因素,其代谢对 维持正常胚胎发育非常重要,异常水平的叶酸可 增加发生NTD 的风险,而补充0.4~4.0 mg/d 的叶 酸能预防约50%~70% 的神经管畸形的发生[10]。叶 酸作为一碳供体,参与核苷酸的合成和甲基转移反应,对DNA 和蛋白质的甲基化修饰非常重要。 所以本研究推测在发育的初期,叶酸代谢紊乱影 响了胚胎发育,进而导致三胚层发育异常,最后 产生胎儿的复杂畸形。研究表明,叶酸代谢相关 rs1801394 和rs1801133 SNP 是与包括NTD 在内的 复杂畸形风险相关的重要的生物标记,提示其可 能为NTD 等复杂畸形的病因之一[11, 13, 14, 17]。在胚胎 发育过程中,MTRR 在胚胎植入前,卵母细胞发育 到囊胚过程中开始表达[26],并随后分布在神经管 和其他组织[27]。小鼠中MTRR 基因敲除导致胚胎 死亡和出生缺陷[27, 28]。这表明MTRR 正常水平对 胚胎发育至关重要,而MTRR rs1801394 突变致病 机理可能是由于SNP 位点位于MTRR 基因的功能 结构域,MTRR 突变影响MTRR 与蛋氨酸合成酶 MTR 的结合从而影响叶酸和一碳代谢[29]。MTHFR 从卵母细胞发育开始表达,小鼠MTHFR 基因敲除 导致S- 腺苷甲硫氨酸表达水平显著降低,同时伴 有S- 腺苷高半胱氨酸水平显著增加。S- 腺苷高半 胱氨酸水平升高可引起广泛的DNA 甲基化水平降 低从而导致小脑发育畸形和脂质沉积[30]。这与本 课题组以往报道的在中国山西人群中,神经管畸 形病例整体DNA 低甲基化水平是一致的[31, 32]。这 些研究都提示MTRR 和MTHFR 在整个胚胎发生 过程中表达,并且它们的SNP 可能影响胚胎发育 的早期阶段,因此导致复杂畸形的表型。
本研究表明在我国出生缺陷高发山西人 群样本中,叶酸代谢相关基因多核苷酸多态性 rs1801394 和rs1801133 与多发出生缺陷风险相关, 并与胚层发育相关,本研究结果将有助于为出生 缺陷病因研究提供新的线索,为今后预防出生缺 陷提供实验证据。
| [1] | Wallingford JB, Niswander LA, Shaw GM, et al. The continuing challenge of understanding, preventing, and treating neural tube defects[J]. Science, 2013, 339(6123): 1222002. |
| [2] | Zhu H, Kartiko S, Finnell RH. Importance of gene-environment interactions in the etiology of selected birth defects[J]. Clin Genet, 2009, 75(5): 409-423. |
| [3] | 中国出生缺陷监测协作组. 中国出生缺陷地图集[M]. 成都: 成都地图出版社, 1992. |
| [4] | 郑晓瑛, 宋新明, 陈功. 中国出生缺陷高发地区出生缺陷 的发生水平和流行病学特征[J]. 中国流行病学杂志, 2007, 28(1): 5-9. |
| [5] | Ooki S. Maternal age and birth defects after the use of assisted reproductive technology in Japan, 2004-2010[J]. Int J Womens Health, 2013, 5: 65-77. |
| [6] | North K, McCredie J. Neurotomes and birth defects: a neuroanatomic method of interpretation of multiple congenital malformations[J]. Am J Med Genet Suppl, 1987, 3: 29-42. |
| [7] | 孙淑娜. 叶酸缺乏导致人类先天性异常的机制研究进展[J]. 中国当代儿科杂志, 2006, 8(6): 527-530. |
| [8] | Nelson MM, Asling CW, Evans HM. Production of multiple congenital abnormalities in young by maternal pteroylglutamic acid deficiency during gestation[J]. J Nutr, 1952, 48(1): 61-79. |
| [9] | Nelson MM, Baird CD, Wright HV, et al. Multiple congenital abnormalities in the rat resulting from riboflavin deficiency induced by the antimetabolite galactoflavin[J]. J Nutr, 1956, 58(1): 125-134. |
| [10] | Bower C, D'Antoine H, Stanley FJ. Neural tube defects in Australia: trends in encephaloceles and other neural tube defects before and after promotion of folic acid supplementation and voluntary food fortification[J]. Birth Defects Res A Clin Mol Teratol, 2009, 85(4): 269-273. |
| [11] | Brouns R, Ursem N, Lindemans J, et al. Polymorphisms in genes related to folate and cobalamin metabolism and the associations with complex birth defects[J]. Prenat Diagn, 2008, 28(6): 485-493. |
| [12] | Yu X, Liu J, Zhu H, et al. Synergistic association of DNA repair relevant gene polymorphisms with the risk of coronary artery disease in northeastern Han Chinese[J]. Thromb Res, 2014, 133(2): 229-234. |
| [13] | Relton CL, Wilding CS, Pearce MS, et al. Gene-gene interaction in folate-related genes and risk of neural tube defects in a UK population[J]. J Med Genet, 2004, 41(4): 256-260. |
| [14] | Cai B, Zhang T, Zhong R, et al. Genetic variant in MTRR, but not MTR, is associated with risk of congenital heart disease: an integrated meta-analysis[J]. PLoS One, 2014, 9(3): e89609. |
| [15] | Huang J, Mei J, Jiang L, et al. rs1801133 C>T polymorphism is associated with an increased risk of tetralogy of Fallot[J]. Biomed Rep, 2014, 2(2): 172-176. |
| [16] | Blanton SH, Henry RR, Yuan Q, et al. Folate pathway and nonsyndromic cleft lip and palate[J]. Birth Defects Res A Clin Mol Teratol, 2011, 91(1): 50-60. |
| [17] | Pangilinan F, Molloy AM, Mills JL, et al. Evaluation of common genetic variants in 82 candidate genes as risk factors for neural tube defects[J]. BMC Med Genet, 2012, 13: 62. |
| [18] | Etheredge AJ, Finnell RH, Carmichael SL, et al. Maternal and infant gene-folate interactions and the risk of neural tube defects[J]. Am J Med Genet A, 2012, 158A(10): 2439-2446. |
| [19] | Shaw GM, Lu W, Zhu H, et al. 118 SNPs of folate-related genes and risks of spina bifida and conotruncal heart defects[J]. BMC Med Genet, 2009, 10: 49. |
| [20] | Gu X, Lin L, Zheng X, et al. High prevalence of NTDs in Shanxi Province: a combined epidemiological approach[J]. Birth Defects Res A Clin Mol Teratol, 2007, 79(10): 702-707. |
| [21] | Garne E, Dolk H, Loane M, et al. Paper 5: Surveillance of multiple congenital anomalies: implementation of a computer algorithm in European registers for classification of cases[J]. Birth Defects Res A Clin Mol Teratol, 2011, 91 Suppl1: S44-S50. |
| [22] | 孙淑娜. 叶酸缺乏导致人类先天性异常的机制研究进展[J]. 中国当代儿科, 2006, 8(6): 527-530. |
| [23] | Mao J, McKean DM, Warrier S, et al. The iron exporter ferroportin 1 is essential for development of the mouse embryo, forebrain patterning and neural tube closure[J]. Development, 2010, 137(18): 3079-3088. |
| [24] | Tao H, Suzuki M, Kiyonari H, et al. Mouse prickle1, the homolog of a PCP gene, is essential for epiblast apical-basal polarity[J]. Proc Natl Acad Sci U S A, 2009, 106(34): 14426-14431. |
| [25] | Bassuk AG, Wallace RH, Buhr A, et al. A homozygous mutation in human PRICKLE1 causes an autosomal-recessive progressive myoclonus epilepsy-ataxia syndrome[J]. Am J Hum Genet, 2008, 83(5): 572-581. |
| [26] | Zhang P, Zucchelli M, Bruce S, et al. Transcriptome profiling of human pre-implantation development[J]. PLoS One, 2009, 4(11):e7844. |
| [27] | Elmore CL, Wu X, Leclerc D, et al. Metabolic derangement of methionine and folate metabolism in mice deficient in methionine synthase reductase[J]. Mol Genet Metab, 2007, 91(1): 85-97. |
| [28] | Deng L, Elmore CL, Lawrance AK, et al. Methionine synthase reductase deficiency results in adverse reproductive outcomes and congenital heart defects in mice[J]. Mol Genet Metab, 2008, 94(3): 336-342. |
| [29] | Olteanu H, Wolthers KR, Munro AW, et al. Kinetic and thermodynamic characterization of the common polymorphic variants of human methionine synthase reductase[J]. Biochemistry, 2004, 43(7): 1988-1997. |
| [30] | Chen Z, Karaplis AC, Ackerman SL, et al. Mice deficient in methylenetetrahydrofolate reductase exhibit hyperhomocysteinemia and decreased methylation capacity, with neuropathology and aortic lipid deposition[J]. Hum Mol Genet, 2001, 10(5): 433-443. |
| [31] | Wang L, Wang F, Guan J, et al. Relation between hypomethylation of long interspersed nucleotide elements and risk of neural tube defects[J]. Am J Clin Nutr, 2010, 91(5): 1359-1367. |
| [32] | Chen X, Guo J, Lei Y, et al. Global DNA hypomethylation is associated with NTD-affected pregnancy: A case-control study[J]. Birth Defects Res A Clin Mol Teratol, 2010, 88(7): 575-581. |
 2014, Vol. 16
2014, Vol. 16