近年来的研究发现了一种新的原发性免疫缺 陷综合征— MonoMAC 综合征(monocytopenia and mycobacterial infection syndrome),由GATA-2 基 因突变所致,为常染色体显性遗传或散发,发病 年龄为7~60 岁,平均发病年龄31 岁,临床上以 严重的单核细胞、NK 细胞、树突状细胞(DC) 和B 淋巴细胞减少,以及鸟结核分枝杆菌复合物 (MAC)感染为特征,伴有播散性人乳头瘤病毒 (HPV)感染或(和)真菌感染,部分伴有肺泡 蛋白沉积症(PAP),如果不予治疗,患者一般会 出现难治性感染、呼吸衰竭或转化为白血病[1]。本 文将简述该病的临床特征、免疫表型及诊断、治 疗等。
1 临床表现 1.1 非结核分枝杆菌病非结核分枝杆菌病是MonoMAC 综合征最主 要的临床特征,97% 的患者患有或者曾经患有非 结核分枝杆菌病[2]。MonoMAC 综合征患者检测到 的非结核分枝杆菌包括缓慢生长型(M. avium、 M. kansasii、M. scrofulaceum) 和快速生长型(M. fortuitum、M. abscessus),超过50% 为M. avium, 可存在缓慢型和快速型混合感染。鸟分枝杆菌病 是MAC 感染引起的人兽共患性传染病。MAC 感染 后可侵害多种组织器官,包括肺、骨髓和淋巴结等。 临床病症主要包括单一的结节、结节状的支气管扩张、结节样的浸润和在免疫力低下患者中的扩 散性浸润4 种类型。痰培养和支气管肺泡灌洗可 找到细菌。MAC 在体内传播时,它可以导致血液 播散、肝炎、肺炎等严重感染。MonoMAC 综合征 患者对分枝杆菌的易感性增强,或许与单核细胞 及NK 细胞缺陷,以及细胞缺陷所致IL-12/IFN-γ 分泌减少有关[3]。
1.2 病毒和真菌感染97% 的患者有HPV 的感染,表现为播散性或 顽固性皮肤疱疹,或者为生殖器疱疹。其他病原 体有单纯疱疹病毒(10%)、水痘- 带状疱疹病毒 (10%)、EB 病毒(10%)[2]。所有患者血清巨细 胞病毒(CMV)检测都为阳性,但是几乎没有患 者有CMV 感染临床症状,血清检测CMV 滴度也 无升高[2]。部分患者也可有细小病毒B19 的感染。 免疫缺陷及反复感染导致的免疫力下降致使患者 易发生真菌感染,16.7% 患者出现荚膜组织胞浆菌 感染,16% 的患者有霉菌感染[2]。
1.3 PAP33% 的患者可并发PAP,PAP 平均发病年龄 为42 岁(发病年龄25~60 岁)。表现为限制性通 气障碍和弥散障碍,高分辨率CT 及活检可明确 诊断。若同时有肺部感染,患者可发生呼吸困难 或者呼吸衰竭。患者体内抗粒- 巨细胞集落刺激 因子(GM-CSF)抗体阴性,GM-CSF 治疗效果不 佳,肺泡灌洗疗效比较肯定[4]。MonoMAC 综合征 患者肺泡巨噬细胞数量与正常人相比无明显的减 少,但是肺泡巨噬细胞的功能缺陷,导致易于发 生PAP[5, 6]。
1.4 脂膜炎脂膜炎或肉芽肿性炎症见于50% 的患者,临 床表现为四肢远端的皮肤损害,炎性结节、硬性 结节、红斑丘疹等,一般症状较轻,病理组织学 检测没有微生物感染迹象,皮肤活检有巨噬细胞 和浆细胞浸润,有多种炎性渗出物[2]。
1.5 骨髓增生异常综合征/ 急性髓细胞白血病50% 的MonoMAC 综合征患者有渐进发展为 骨髓增生异常综合征/ 急性髓细胞白血病(MDS/ AML)的趋势,但一般多见于晚期患者,平均诊断 年龄为32 岁(7~54 岁)。发生MDS 或者AML 的 患者多有染色体异常,一般为7 号染色体单倍、 8 号染色体三倍或者6 号染色体双着丝粒等[2]。Ostergaard 等[7] 报道GATA-2 基因突变是导致患者 易患白血病的一个重要原因。
1.6 原发性淋巴水肿30% 患者除了非结核分歧杆菌病外,还可 伴有原发性淋巴水肿,表现为反复感染后皮下纤 维结缔组织增生,脂肪硬化,也可表现为肢体增 粗。GATA-2 已被证明有调节内皮细胞基因增强子 (PECAM1、Kdr、ANGPT2 和EMCN) 活性的作 用[8, 9],也有研究发现GATA-2 缺失导致淋巴管发 育异常,从而引起原发性淋巴水肿[10]。
2 实验室检查 2.1 骨髓异常MonoMAC 患者骨髓细胞结构变化范围较大, 骨髓活检多系发育不良,均显示单核祖细胞发育 不良,CD38+ CD10+ B/NK 祖细胞几乎完全缺失, 72% 的患者有粒- 巨噬系祖细胞(GLP)的发育不 良[2, 3, 4]。已发展为MDS 的患者,72% 骨髓象显示低 增生并伴有网状纤维化,78% 的患者有异常红细 胞造血(双核形成、核碎裂、巨幼变),11% 的 患者出现再生障碍性贫血,61% 患者外周血小板 减少,但没有明显出血症状。33% 的患者巨核祖 细胞减少,67% 的患者巨核祖细胞形态异常[4]。 10% 的患者红系祖细胞减少,但40% 患者有红系 祖细胞不典型增生[2]。免疫学检测显示中性粒细胞 等在发育成熟过程中伴有形态发育不良或颗粒异 常,或者同时伴有免疫表型表达异常[2, 4]。
2.2 免疫细胞异常单核细胞明显减少是MonoMAC 综合征的显著 特征。患者外周血单核细胞计数在0~29 个/μL(平 均13.3 个/μL),正常值为210~660 个/μL。但在 皮肤和肺组织内,可有数量大致正常的朗格汉斯 细胞(LC)和肺泡巨噬细胞,可能与局部环境内 自我更新有关[11]。另有证据表明,皮肤和肺泡的 巨噬细胞寿命极长,循环中祖细胞缺失的情况下 仍可持续存在[12, 13],另一种可能是由其他前体细 胞发育而来。多发性皮肤损害及PAP 的发生提示 LC 及肺泡巨噬细胞功能受损。体外PHA 刺激单核 细胞显示细胞因子产生和细胞增殖均受损[2]。
NK 细胞显著减少也是本病的特征。患者外周 血NK 细胞计数0~69 个/μL(平均13.3 个/μL), 正常值为87~505 个/μL。NK 细胞具有抗肿瘤、 抗感染、免疫调节功能。NK 细胞数量减少,导致 患者易于感染细菌、真菌和病毒[4]。研究发现, GATA-2 是NK 细胞发育和成熟所必须的,GATA-2 突变致外周血NK 细胞明显减少[14]。NK 细胞介导 的细胞毒作用也需要GATA-2 的参与[14]。
MonoMAC 患者B 淋巴细胞除了数量明显减少, 同时有表面抗原表达异常[4]。患者外周血B 淋巴 细胞计数0~51 个/μL(平均9.4 个/μL),83% 的 患者低于30 个/μL(正常值49~424 个/μL)。虽 然B 淋巴细胞显著减少,但患者体内丙种免疫球 蛋白水平基本正常,10% 的患者IgA 水平可减少。 患者骨髓B 淋巴细胞明显减少,但44% 的患者有 骨髓浆细胞增多(≥ 5% 骨髓细胞总数),免疫学 检测为CD19-CD56+ 阳性的异常浆细胞。
MonoMAC 患者体内T 细胞变异度较大,50% 患者CD4+ 细胞减少(37~345 个/μL,正常范围 362~1725 个/μL),50% 患者CD8+ 细胞减少(64~330 个/μL,正常范围344~911 个/μL),38.9% 的患 者可同时有CD4+ T 细胞和CD+8 细胞的减少[2, 4]。
Bigley 等[3] 对4 例MonoMAC 患者进行了 免疫功能研究,发现树突状细胞(DC)细胞在 MonoMAC 患者外周血和骨髓中几乎检测不到, 并伴有功能缺陷,故将这种免疫缺陷病命名为 DMCL。DC 细胞在维持免疫功能中,诱导单核- 巨噬细胞发挥作用。DC 细胞减少与骨髓祖细胞减 少、Flt3 配体增多相关[15]。
此外,MonoMAC 患者可有中性粒细胞形态学 发育不良、细胞内颗粒数目异常、伴有表面抗原 表达异常[4]。晚期患者转化为MDS 后可伴红细胞、 血小板减少[4]。
3 发病机制和遗传学研究进展MonoMAC 综合征是2010 年Vinh 等首先描述 和报道的一类免疫缺陷病,关于MonoMAC 的发病 机制和遗传学研究已经取得了部分进展,但具体 的机制仍在探索当中。Vinh 等[2] 通过对5 个无亲 缘关系的家族进行分析,总结出MonoMAC 综合征 为常染色体显性遗传,也可见散发病例[16, 17]。
GATA 转录因子一般结合于染色体上含有 WGATTA 序列的顺式作用元件的位点,通过调节基因的转录和表达来调节细胞的生成及调节细胞 功能。GATA 家族包括GATA-1、GATA-2、GATA- 3、GATA-4、GATA-5、GATA-6,GATA-1 主要高 表达于红系细胞、肥大细胞、巨核细胞,GATA-1 对红系细胞的发育有重要的作用。GATA-3 主要表 达于T 淋巴细胞,影响T 淋巴细胞的生长发育。 GATA-4、GATA-5、GATA-6 主要表达于心肌细胞。 GATA-2 包含两个高度保守的锌指结构,该基因 编码一种474 个氨基酸组成的转录因子,故其亦 属于锌指结构家族的成员,具有识别和结合DNA 序列所需的高度稳定的蛋白结构域,该结构域由 两个同源的指状区组成。每一个指状结构区由两 个[Cys-X-Cys](Cys 为半胱氨酸,X 为可变氨基 酸)结构组成,中间有17 个氨基酸间隔,即Cys- X-Cys-X17-Cys-X-Cys,其中4 个半胱氨酸与1 个 锌离子组成四面体结构即锌指结构[18],能够调节 DNA- 蛋白质相互作用以及蛋白质- 蛋白质之间的 相互作用[17]。
GATA-2 主要表达造血干细胞(HSCs)、祖 细胞及肥大细胞中,在造血干/ 祖细胞的增殖和分 化中起着重要的作用[19, 20, 21],GATA-2 缺失可致严重 造血缺陷和胚胎死亡。在胚胎细胞(ES 细胞)中, 定位敲除GATA-2 基因后,出现整个造血系统的 发育障碍。GATA-2 在早期的造血干/祖细胞中表 达,骨髓和脐血来源的CD33+CD34+ 细胞和CD33- CD34+ 细胞中都有GATA-2 高度表达[22],并随着造 血细胞的分化、发育成熟表达下调。在血细胞分 化中存在着GATA-2 剂量依赖效应。GATA-2 表达 下调对于体内干细胞促成血细胞生成十分重要。 过量表达GATA-2 可以阻止多潜能造血细胞的扩增 和分化[23]。GATA-2 还表达于内皮细胞、胎盘、前 列腺、脑垂体及部分神经元内。GATA-2 单倍剂量 不足的小鼠,其淋巴细胞和单核细胞缺如[24]。也 有研究发现GATA-2 通过HES-1 信号通路影响粒- 巨核系祖细胞的自我更新[25],另外GATA-2 可通 过与C/EBP-α 结合,影响粒细胞的形成[26]。
GATA-2 基因突变除了导致单核、NK、B 和树 突状细胞减少,还导致患者易患MDS 和AML[19]。 Hahn 等[27] 研究发现,GATA-2 基因突变是导致 MDS 和AML 的新的易患病基因,Ostergaard 等[7] 同样报道GATA-2 基因突变导致淋巴水肿,并导致 患者易于发生AML。MonoMAC 患者有免疫缺陷及
反复的感染,从而刺激HSC 增殖,因为GATA-2 基因突变,祖细胞功能同样出现缺陷,长期的增 殖刺激导致HSC 耗竭和MDS 的发生。动物实验中, GATA-2 单倍剂量不足的小鼠HSC 减少,且凋亡 增加[23]。MonoMAC 患者发生AML,同时多伴有染 色体异常提示除了GATA-2 突变,可能需要其他基 因突变诱发AML 的发生,这也是AML 在GATA-2 突变发病较晚的缘故。但另一方面,在AML 中 GATA-2 表达上调常提示预后不良[28]。GATA-2 表 达上调还可能通过调节雄激素受体和调节雄激素 主要调节基因,促进前列腺癌的发生[29]。转录因 子基因往往具有原癌基因的一般特点,即正常情 况下,它参与细胞正常的生长代谢过程,维持细 胞在某一发育阶段的正常功能,在细胞增殖与分 化过程中不可缺少;但在某些内源性或外源性因 素作用下,当它在不适当的空间或时间被激活, 导致异常表达或突变时,可通过不同的途径或方 式改变细胞的生长和分化程序,以渐进的方式诱 发细胞的癌变[30]。另外,GATA-2 过量表达还可以 导致异型巨核细胞生成[31]。
MonoMAC 患者中现已报道的GATA-2 基因突 变中,点突变c.1192 C → T(R398W)、c.1061 C → T( T354M)、c.1113 C → G(N371K)、c. 751 C → T(P254L)、c. 1018-1 G → A(D340- 381) c.1186 C → T(R396W),c.1187 G → A (R396Q),也有插入/ 缺失突变 c.1083_1094del 12 bp(R361delRNAN),c.1-200_871 _ 527del 2 033 bp(M1del290) c.778_779ins 10 bp(D259fs), c. 951_952ins 11 bp N317fs ,c.243_244delAinsGC G81fs,见图 1。c.1061 C → T( T354M) 在已报 道患者中出现频率较高,可能为高频突变。c.1061 C → T( T354M)突变可能与MDS/AML 的发病相 关,分子模型表明T354 能够稳定GATA-2 C 端锌 指结构,T354W 突变导致GATA-2 与DNA 的亲和 力降低,转录活性降低[19]。Hsu 等[32] 的研究发现, GATA-2 保守内含子的突变也可致单倍剂量不足, 导致MonoMAC 综合征的发病。
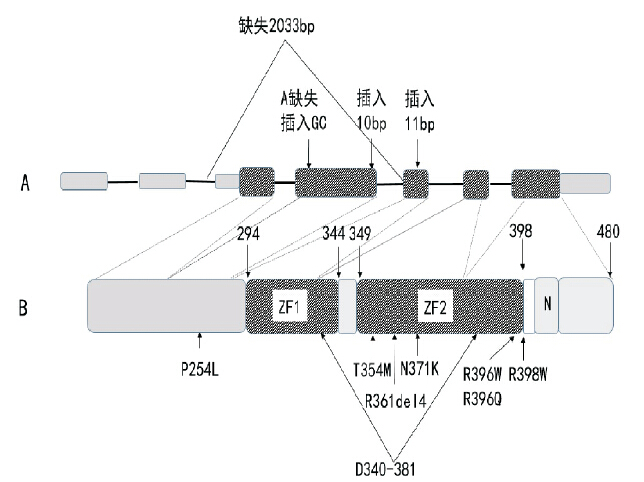 |
图 1 GATA2 分子模式图A:GATA2 基因结构显示有2 个5’端非翻译外显子和5 个编码外显子,阴影方块代表编码区,插入或缺失突变导致的无效等位基因在图中标出。B:蛋白结构示意图,包括2 个锌指结构ZF1 和ZF2,错义突变和缺失突变位置由黑色箭头标示。 |
综上所述,GATA-2 突变或者缺失导致 MonoMAC 免疫缺陷病的发生,同时又可以使患 者患MDS 和AML 以及其他肿瘤的几率增加,故 GATA-2 可能是导致免疫缺陷患者发生恶性肿瘤的 重要基因,而GATA-2 突变在免疫缺陷和恶性肿瘤 及两者间的具体细胞和分子机制需要进一步研究。
4 诊断和治疗MonoMAC 综合征临床特征比较明显:反复的 呼吸和消化道感染,非结核分枝杆菌病、播散性 HPV 感染等,即可初步疑诊,结合进一步的实验 室检测(特征性的实验室检测为严重的单核细胞、 NK 细胞减少,DC 减少,B 淋巴细胞减少但免疫 球蛋白水平基本正常,T 淋巴细胞正常或者轻微减 少)和GATA-2 序列分析可以确诊。但是由于患者 之间个体差异较大,患者可表现为骨髓发育不良 或急性白血病,有的患者只表现为持续性感染。 目前尚无统一诊断标准,而且没有特异性治疗方 案[2],只有针对患者的临床表现进行对症治疗。最 近Cuellar-Rodriguez 等[33] 对6 名MonoMAC 患者进 行了非清髓异基因造血干细胞移植,移植后所有 患者都有较高水平造血功能和免疫功能恢复,临 床症状也有很大改善。除1 名患者死于急性急性 移植物抗宿主病(GVHD)外,其他5 名患者生存, 已经随访平均生存时间17.4 个月(10~25 个月), 提示在短期随访中,移植效果较好,远期效果则 尚进一步随访。未来的研究中,随着MonoMAC 综 合征的发病机制逐步被阐明,针对MonoMAC 综合 征的诊断及初筛标准会被明确,相对应的治疗也 会具体化和个体化。
| [1] | Hsu AP, Sampaio EP, Khan J, et al. Mutations in GATA2 are associated with the autosomal dominant and sporadic monocytopenia and mycobacterial infection (MonoMAC) syndrome[J]. Blood, 2011, 118(10): 2653-2655. |
| [2] | Vinh DC, Patel SY, Uzel G, et al. Autosomal dominant and sporadic monocytopenia with susceptibility to mycobacteria, fungi, papillomaviruses, and myelodysplasia[J]. Blood, 2010, 115(8): 1519-1529. |
| [3] | Bigley V, Haniffa M, Doulatov S, et al. The human syndrome of dendritic cell, monocyte, B and NK lymphoid deficiency[J]. J Exp Med, 2011, 208(2): 227-234. |
| [4] | Calvo KR, Vinh DC, Maric I, et al. Myelodysplasia in autosomal dominant and sporadic monocytopenia immunodeficiency syndrome: diagnostic features and clinical implications[J]. Haematologica, 2011, 96(8): 1221-1225. |
| [5] | Randolph GJ, Jakubzick C, Qu C. Antigen presentation by monocytes and monocyte-derived cells[J]. Curr Opin Immunol, 2008, 20(1): 52-60. |
| [6] | Villadangos JA. Hold on, the monocytes are coming![J]. Immunity, 2007, 26(4): 390-392. |
| [7] | Ostergaard P, Simpson MA, Connell FC, et al. Mutations in GATA2 cause primary lymphedema associated with a predisposition to acute myeloid leukemia (Emberger syndrome)[J]. Nature Genet, 2011, 43(10): 929-931. |
| [8] | Gumina RJ, Kirschbaum NE, Piotrowski K, et al. Characterization of the human platelet/endothelial cell adhesion molecule-1 promoter: identification of a GATA-2 binding element required for optimal transcriptional activity[J]. Blood, 1997, 89(4): 1260-1269. |
| [9] | Kappel A, Schlaeger TM, Flamme I, et al. Role of SCL/Tal-1, GATA, and ets transcription factor binding sites for the regulation of flk-1 expression during murine vascular development[J]. Blood, 2000, 96(9): 3078-3085. |
| [10] | Kazenwadel J, Secker GA, Liu YJ, et al. Loss-of-function germline GATA2 mutations in patients with MDS/AML or MonoMAC syndrome and primary lymphedema reveal a key role for GATA2 in the lymphatic vasculature[J]. Blood, 2012, 119(5): 1283-1291. |
| [11] | Merad M, Manz MG. Dendritic cell homeostasis[J]. Blood, 2009, 113(15): 3418-3427. |
| [12] | Murphy J, Summer R, Wilson AA, et al. The prolonged life-span of alveolar macrophages[J]. Am J Resp Cell Mol Biol, 2008, 38(4): 380. |
| [13] | Haniffa M, Ginhoux F, Wang XN, et al. Differential rates of replacement of human dermal dendritic cells and macrophages during hematopoietic stem cell transplantation[J]. J Exp Med, 2009, 206(2): 371-385. |
| [14] | Mace EM, Hsu AP, Monaco-Shawver L, et al. Mutations in GATA2 cause human NK cell deficiency with specific loss of the CD56bright subset[J]. Blood, 2013, 121(14): 2669-2677. |
| [15] | McKenna HJ, Stocking KL, Miller RE, et al. Mice lacking flt3 ligand have deficient hematopoiesis affecting hematopoietic progenitor cells, dendritic cells, and natural killer cells[J]. Blood, 2000, 95(11): 3489-3497. |
| [16] | Ishida H, Imai K, Honma K, et al. GATA-2 anomaly and clinical phenotype of a sporadic case of lymphedema, dendritic cell, monocyte, B-and NK-cell (DCML) deficiency, and myelodysplasia[J]. Eur J Pediatr, 2012, 171(8): 1273-1276. |
| [17] | Dickinson RE, Griffin H, Bigley V, et al. Exome sequencing identifies GATA-2 mutation as the cause of dendritic cell, monocyte, B and NK lymphoid deficiency[J]. Blood, 2011, 118(10): 2656-2658. |
| [18] | Pedone PV, Omichinski JG, Nony P, et al. The N-terminal fingers of chicken GATA-2 and GATA–3 are independent sequence-specific DNA binding domains[J]. EMBO J, 1997, 16(10): 2874-2882. |
| [19] | Rodrigues NP, Tipping AJ, Wang Z, et al. GATA-2 mediated regulation of normal hematopoietic stem/progenitor cell function, myelodysplasia and myeloid leukemia[J]. Int J Biochem Cell Biol, 2012, 44(3): 457-460. |
| [20] | Tsai FY, Keller G, Kuo FC, et al. An early haematopoietic defect in mice lacking the transcription factor GATA-2[J]. Nature, 1994, 371(6494): 221-226. |
| [21] | Tsai FY, Orkin SH. Transcription factor GATA-2 is required for proliferation/survival of early hematopoietic cells and mast cell formation, but not for erythroid and myeloid terminal differentiation[J]. Blood, 1997, 89(10): 3636-3643. |
| [22] | Ikonomi P, Noguchi CT, Miller W, et al. Levels of GATA-1/GATA-2 transcription factors modulate expression of embryonic and fetal hemoglobins[J]. Gene, 2000, 261(2): 277-287. |
| [23] | Persons DA, Allay JA, Allay ER, et al. Enforced expression of the GATA-2 transcription factor blocks normal hematopoiesis[J]. Blood, 1999, 93(2): 488-499. |
| [24] | Rodrigues NP, Janzen V, Forkert R, et al. Haploinsufficiency of GATA-2 perturbs adult hematopoietic stem-cell homeostasis[J]. Blood, 2005, 106(2): 477-484. |
| [25] | Rodrigues NP, Boyd AS, Fugazza C, et al. GATA-2 regulates granulocyte-macrophage progenitor cell function[J]. Blood, 2008, 112(13): 4862-4873. |
| [26] | Tong Q, Tsai J, Tan G, et al. Interaction between GATA and the C/EBP family of transcription factors is critical in GATAmediated suppression of adipocyte differentiation[J]. Mol Cell Biol, 2005, 25(2): 706-715. |
| [27] | Hahn CN, Chong CE, Carmichael CL, et al. Heritable GATA2 mutations associated with familial myelodysplastic syndrome and acute myeloid leukemia[J]. Nature Genet, 2011, 43(10): 1012-1017. |
| [28] | Vicente C, Vazquez I, Conchillo A, et al. Overexpression of GATA2 predicts an adverse prognosis for patients with acute myeloid leukemia and it is associated with distinct molecular abnormalities[J]. Leukemia, 2011, 26(3): 550-554. |
| [29] | Böhm M, Locke WJ, Sutherland RL, et al. A role for GATA-2 in transition to an aggressive phenotype in prostate cancer through modulation of key androgen-regulated genes[J]. Oncogene, 2009, 28(43): 3847-3856. |
| [30] | 吴秀丽, 李扬秋.造血转录因子GATA-2 的研究进展[J].现 代临床医学生物工程学杂志, 2003, 9(5): 387. |
| [31] | Huang Z, Dore L C, Li Z, et al. GATA-2 reinforces megakaryocyte development in the absence of GATA-1[J]. Mol Cell Biol, 2009, 29(18): 5168-5180. |
| [32] | Hsu AP, Johnson KD, Falcone EL, et al. GATA2 haploinsufficiency caused by mutations in a conserved intronic element leads to MonoMAC syndrome[J]. Blood, 2013, 121(19): 3830-3837. |
| [33] | Cuellar-Rodriguez J, Gea-Banacloche J, Freeman A F, et al. Successful allogeneic hematopoietic stem cell transplantation for GATA2 deficiency[J]. Blood, 2011, 118(13): 3715-3720. |
 2014, Vol. 16
2014, Vol. 16

