2. 华中科技大学同济医学院附属同济医院儿科, 湖北 武汉 430030
随着现代诊疗技术的进步,极低和超低出生 体重早产儿存活率明显提高,与之相关的并发症 如支气管肺发育不良(bronchopulmonary dysplasia, BPD)的发生率也愈来愈高。长时间高浓度供氧是 导致早产儿 BPD 发生的重要原因,因此,高氧暴 露细胞和动物模型成为了研究 BPD 发病机制的经 典模型[1, 2, 3, 4]。肺泡化受阻和肺泡微血管发育障碍是 BPD 的主要病理特征,肺组织多种细胞的异常增殖、分化和凋亡参与了此病理过程的发生和发展[2]。 与肺泡上皮细胞以及血管内皮细胞一样,肺成纤 维细胞(lung fibroblasts,LFs)也是高氧暴露肺组 织损伤后参与应答反应的主要效应细胞之一[1]。 高氧时,需要间质 LFs 产生多种生物活性物质, 促进Ⅱ型肺泡上皮细胞(type Ⅱ alveolar epithelial cell,AEC Ⅱ)增殖、移行并分化为Ⅰ型肺泡上皮 细胞(type Ⅰ alveolar epithelial cell,AEC Ⅰ)以修 复受损的肺泡结构[1, 2, 4]。p53 基因在调节细胞周期 和细胞增殖过程中发挥重要作用,高氧可通过依 赖 p53 和非依赖 p53 的途径促进 AEC Ⅱ凋亡、抑 制 LFs 增殖并影响其生物学功能,从而导致肺泡 发育受阻[2, 3, 4]。本实验在前期研究基础上,通过观 察延长高氧暴露时间后胎鼠 LFs p53 及增殖细胞核 抗原(proliferating cell nuclear antigen,PCNA)的表 达变化,进一步探讨高氧改变 LFs 增殖及生存状 况的可能机制,为 BPD 的防治提供理论依据。 1 材料与方法 1.1 胎鼠 LFs 原代培养
参照李文斌等[5] 方法进行:无菌条件下取孕 19 d Sprague-Dawley(SD)大鼠胎鼠肺组织,剪 碎,D-Hanks 液漂洗,0.1% 胰蛋白酶(含 0.02% Dnase,按每肺 0.5 mL)室温下消化 15 min,用 等量含 10% 胎牛血清(FCS,浙江三利生物制品 有限公司)的 MEM(GIBCO 公司)终止消化, 过 100 目、200 目 筛 网 各 1 次,4 ℃ 1 500 rpm 离 心 5 min,弃上清,沉淀重悬,调整细胞浓度接种 于 96 孔板或 50 mL 玻璃培养瓶(部分培养瓶中放 有细胞爬片),置 5% CO2培养箱 37℃培养 40 min 至 1 h,换液,贴壁细胞即为原代胎鼠 LFs。 1.2 细胞鉴定及 LFs 纯度计算
Vimentin 是 LFs 胞浆中特征性蛋白。细胞爬 片经 4℃ 丙酮固定 10 min,晾干,粘片。采用免疫 细胞化学 SP 法鉴定(SP Kit 和 DAB Kit,北京中 山生物技术有限公司),操作步骤严格按试剂盒 说明书进行。小鼠抗大鼠 Vimentin(Santa Cruz 公 司)工作液浓度为 1 : 100。在显微镜下(×60 倍) 随机选取同一细胞爬片 3 个视野,计算 Vimentin 阳性细胞占整个视野的百分率,即为 LFs 纯度。 1.3 实验分组
经鉴定后,待 LFs 生长至亚汇合状态时,将 培养瓶中培养液换成含 2% FCS 的 MEM,并随机 分为空气组(n=6)和高氧组(n=6)。空气组置 于 5% CO2培养箱中;高氧组通 95% O2 / 5% CO2高 纯混合气(2 L/min)10 min 后密封,置培养箱中 培养 12 h 和 24 h。其中高氧组在培养结束时均用 测氧仪检测培养瓶中氧浓度,氧浓度低于 90% 的 样本弃去。 1.4 噻唑蓝(MTT)实验检测 LFs 细胞抑制率
待 96 孔板中原代胎鼠 LFs 生长至铺满板底 约 70% 时,分设空白对照组、空气对照组和 90% 高氧组,每组设 6 复孔,分别培养 12 h 和 24 h, 弃去培养液,每孔加入 5 g/L MTT(华美公司) 10 μL,继续孵育4 h,每孔加入100 μL 二甲亚 砜(DMSO) 终 止,振 荡 15 min,450 型 ELISAReader 酶标仪(Bio-Red 公司)570 nm 波长检测吸 光度。以空气对照组细胞活力为 100%,按公式: 细胞抑制率 =1-(高氧组吸光度 - 空白对照组吸光 度)/(空气对照组吸光度 - 空白对照组吸光度) ×100%,计算高氧状态下细胞生长抑制率。 1.5 RT-PCR 检测 p53 mRNA 表达
按Trizol试剂(上海华舜生物工程有限公 司)一步法提取细胞RNA。经紫外分光光度 法定量后,取2 μg RNA 用 M-MLV逆转录酶 (Promega 公司)进行逆转录反应合成 cDNA。 以β-actin 为内参照,分别取 1 μL 模板进行 PCR 反应,相应引物(均由北京赛百盛基因技术有 限公司合成)序列分别为:β-actin(280 bp): 上 游 5'-AACGCAGCTCAGTAACAGTC-3',下 游 5'-ATCCGTAAAAGCCTCTATGC-3';p53(551 bp): 上游 5'-CTACAAGCAGTCACAGCACATGAC-3',下 游 5'-TCATTCAGCTCTCGGAACATCTCG-3'。 反 应 条件为预变性 94℃ 5 min,94℃ 30 s,55℃ 30 s, 72℃ 1 min,30 个循环后 72℃延伸 10 min。产物 经 1.5% 琼脂糖凝胶电泳分离,紫外灯下观察并拍 照,每组实验至少重复 3 次,条带用 GDS-8000 型 凝胶成像分析系统进行分析,比较 p53 与 β-actin 扩增条带灰度比值(A p53/A β-actin)。实验重复 3 次。 1.6 Western blot 检测 p53 和 PCNA 蛋白表达
裂解细胞提取蛋白,按每泳道加总蛋白 50 μg进行 SDS-PAGE 凝胶电泳,半干式电转移至硝酸 纤维素滤膜上,室温封闭 2 h 后,加入相应的小鼠 抗β-actin 单克隆抗体(1 : 500,Neomarks)、兔 抗大鼠 p53 多克隆抗体(1 : 500,abcam)或小鼠 抗大鼠 PCNA 单克隆抗体(1 : 300,Santa Cruz), 4℃孵育过夜,洗膜后加入相应的辣根过氧化物酶 标记的二抗(1 : 2 000),ECL 增强化学发光显色 系统显色。每组实验至少重复 3 次,用 GDS-8000 型凝胶成像分析系统进行扫描,以 p53 或 PCNA 与β-actin 条带面积灰度比值进行比较和半定量分 析。实验重复 3 次。 1.7 统计学分析
采用 SPSS 16.0 软件进行统计分析,数据以均 数 ± 标准差(x±s)表示,组间比较采用方差分析、 t检验,P<0.05 为差异具有统计学意义。 2 结果 2.1 细胞鉴定
经鉴定,细胞爬片上 LFs 纯度为(95±1)% (n=6)表明所获细胞适合研究使用(图 1)。
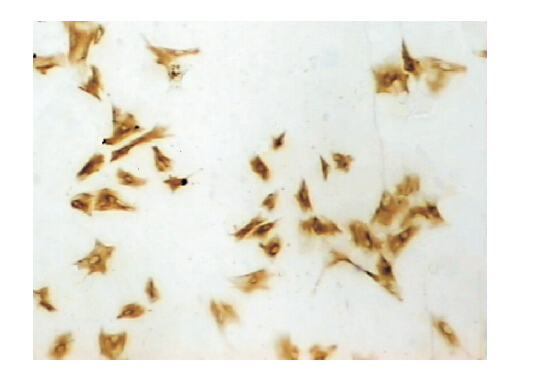 |
图 1 胎鼠 LFs 细胞浆中 Vimentin 表达 (SP 法,×60) |
充氧前倒置相差显微镜下观察,绝大多数细 胞胞体明亮,紧贴瓶底,无悬浮细胞,呈良好生 长状态。随时间延长,高氧组镜下观察可见细胞 胞体折光率降低,细胞生长状态欠佳,悬浮细胞 增多,但大多数细胞仍具有活力。空气组细胞则 无明显改变。MTT 结果显示,高氧 12 h 和 24 h 时, LFs 生长抑制率分别为 8% 和 23%。 2.3 高氧对胎鼠 LFs p53 mRNA 表达的影响
与同时间空气组比较,高氧12 h时,p53 mRNA 表达即显著升高(1.57±0.13 vs 0.85±0.08, t=8.1763,P<0.01);高氧 24 h 时其表达升高更 为 显 著(5.16±0.13 vs 2.52±0.16,t=21.3975, P<0.01)。在空气组,24 h p53 mRNA 表达明显 高 于 12 h(2.52±0.16 vs 0.85±0.08,t=15.8859, P<0.01)。在高氧组,24 h p53 mRNA 表达也明显 高 于 12 h(5.16±0.13 vs 1.57±0.13,t=33.1861, P<0.01)(图 2、3)。
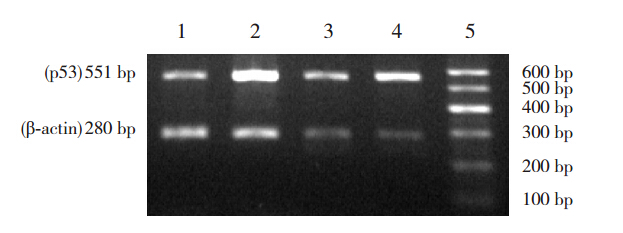 |
图 2 各组胎鼠 LFs p53 mRNA 表达(n=6) 注:1. 空气12 h;2. 高氧12 h;3. 空气24 h;4.高氧24 h;5.DNA Marker。 |
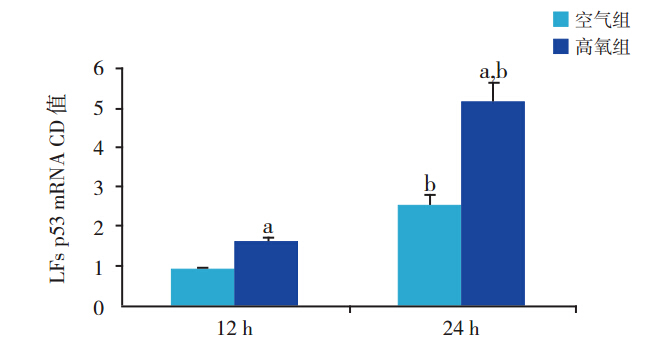 |
图 3 各组胎鼠 LFs p53 mRNA 表达(n=6) 注:a 示与同时间空气组比较, P<0.01;b 示与同组 12 h 比较,P<0.01。 |
与同时间空气组比较,高氧组12 h 和24 h 时 的 p53 蛋 白 表 达 显 著 升 高( 分 别 0.86±0.05 vs 0.54±0.06,t=7.494,P<0.01;0.98±0.05 vs 0.25±0.02,t=23.8476,P<0.01)。 在 空 气 组, 12 h p53 蛋 白 表 达 明 显 高 于 24 h(0.54±0.06 vs 0.25±0.02,t=8.5369,P<0.01); 在 高 氧 组, 12 h p53 蛋 白 表 达 明 显 低 于 24 h(0.86±0.05 vs 0.98±0.05,t=3.0630,P<0.05)。见图 4、5。
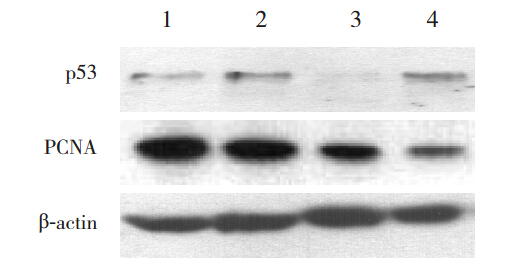 |
图 4 各组胎鼠 LFs p53 和 PCNA 蛋白表达(n=6) 注:1. 空气 12 h;2. 高氧 12 h;3. 空气 24 h;4. 高氧 24 h。 |
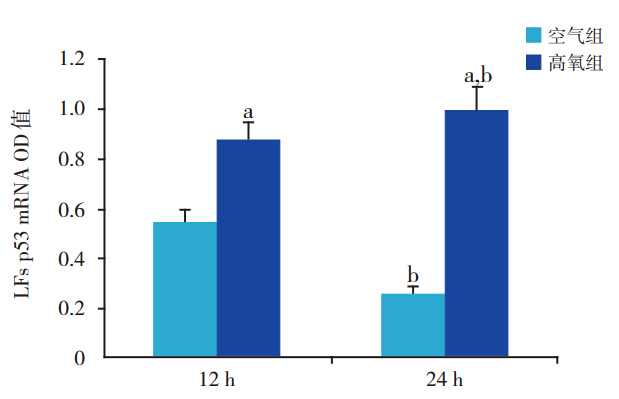 |
图 5 各组胎鼠 LFs p53 表达(n=6) 注:a 示与同时间空气组比较,P<0.01;b 示与同组 12 h 比较,P<0.01。 |
12 h时2组PCNA蛋白表达无明显差异 (0.86±0.07 vs 0.79±0.04,t=1.5284,P>0.05); 但高氧组24 h时PCNA蛋白表达明显低于空 气 组(0.20±0.01 vs 0.53±0.05,t=10.3727, P<0.01)。 2 组 24 h PCNA 表达均明显低于 12 h ( 空 气 组:0.53±0.05 vs 0.86±0.07,t=6.7878, P<0.01; 高 氧 组:0.20±0.01 vs 0.79±0.04, t=27.1402,P<0.01)(图 4、6)。
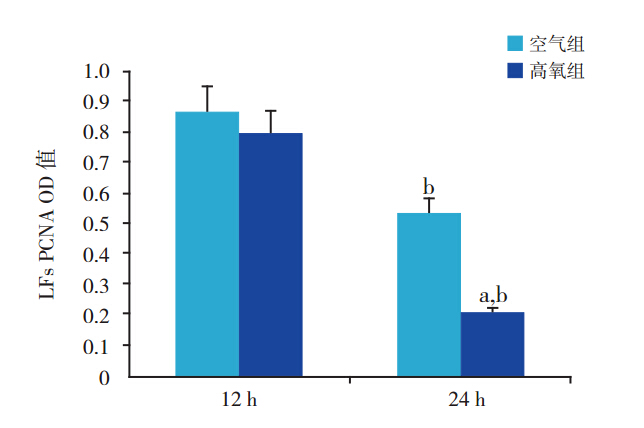 |
图 6 各组胎鼠 PCNA 蛋白表达的影响(n=6) 注:a 示与同时间空气组比较,P<0.01;b 示与同组 12 h 比较, P<0.01。 |
氧疗是治疗新生儿疾病的常用手段,但长时 间高氧暴露可导致大量活性氧(ROS)的产生,由 于新生儿尤其是早产儿自身抗氧化防御能力不足, 这些具有高度活性的 ROS 可广泛地攻击靶细胞结 构成分,导致 DNA 等大分子物质破坏,是造成早 产儿 BPD 发生的重要分子机制[2, 6, 7] 。同时,DNA 分子损害可启动细胞内一系列信号转导级联反应, 抑制细胞增殖,并诱导细胞发生坏死、凋亡。
PCNA 是 DNA 聚合酶δ的一种辅助蛋白,作 为 S 期细胞的一个标志物,用于检测细胞的增殖 能力,是判定细胞增殖状态的有效指标之一,并 与高氧肺损伤时细胞增殖状况有很好相关性[1,8]。 本课题组前期研究显示,高氧暴露 12 h 可导致胎 鼠 AECII 大量坏死、凋亡,其 PCNA 蛋白表达下降, 增殖受到抑制;但 LFs 所受影响较小,且其 PCNA 蛋白表达水平也没有明显变化,2 种细胞对高氧暴 露的差异性表现可能是导致未成熟肺组织异常重 构的重要原因[9]。本研究进一步延长高氧暴露至 24 h,发现胎鼠 LFs PCNA 蛋白表达水平亦开始明 显降低,提示高氧暴露持续时间延长也可进一步 抑制 LFs 的增殖。这种高氧所致细胞增殖抑制可 导致肺间隔形成受阻和肺泡化程度降低[9]。
肿瘤抑制基因 p53 的表达产物 p53 是细胞周 期的重要检测点蛋白(checkpoint protein)。多种 形式的氧应激可激活 p53,使其磷酸化,后者作为 转录因子可调控多种基因的表达,并介导细胞周 期抑制,促进 DNA 修复或诱导细胞凋亡[6, 7]。本 研究结果显示,95% 高氧暴露 12 h 和 24 h 时胎鼠 LFs p53 mRNA 及其蛋白表达水平均明显增高,提 示 p53 参与了高氧暴露后 LFs 的细胞周期调控。 p53 调控的一个主要靶基因是细胞周期依赖性激 酶抑制蛋白 p21,后者是 G1/S 期检测点蛋白。p21 氨基端可与 G1/S 期细胞周期蛋白及其依赖性蛋白 激酶复合物(cyclins-CDK)结合使细胞周期阻滞 于 G1/S 期,羧基端可与 PCNA 结合抑制 DNA 复 制,促进修复,一旦修复不成功,则诱导细胞发 生凋亡[3, 10, 11, 12]。本研究结果提示,95% 高氧暴露 后,尤其是 24 h 时,LFs 生长抑制率达 23%,同 时 PCNA 的表达明显降低、p53 表达升高,表明高 氧暴露抑制 LFs 增殖同时,也抑制了其 DNA 复制。动物研究表明,80% 高氧暴露可通过降低组蛋白 去乙酰化酶(histone deacetylase,HDAC)的表达及 活化促进 p21 的转录,从而抑制细胞增殖,并进 一步导致新生小鼠肺组织发育障碍,但并没有发 生肺细胞凋亡 [2]。也就是说,p21 的表达也可通过 非依赖 p53(如 HDAC)的途径调控肺细胞的增殖 和凋亡,从而对高氧肺损伤的结局产生影响。那么, 高氧暴露下,LFs 是否通过 HDAC 信号途径在抑制 其增殖同时,避免了凋亡发生? p53 与 HDAC 信 号通路之间是否存在联系?目前尚不清楚。
综上,随高氧暴露时间延长,不仅 AECII 发 生增殖抑制,LFs 的增殖也受到影响,但 LFs 并不 象 AECII 一样发生坏死或凋亡,其具体机制尚有 待进一步研究。
| [1] | Giordani VM, Debenedictus CM, Wang Y, et al.Epidermal growth factor receptor(EGFR) contributes to fetal lung fibroblast injury induced by mechanical stretch[J].J Recept Signal Transduct Res, 2014, 34(1): 58-63. |
| [2] | Londhe VA, Sundar IK, Lopez B, et al.Hyperoxia impairs alveolar formation and induces senescence through decreased histone deacetylase activity and up-regulation of p21 in neonatal mouse lung[J].Pediatr Res, 2011, 69(5 Pt 1): 371-377. |
| [3] | Jean JC, George E, Kaestner KH, et al.Transcription factor Klf4, induced in the lung by oxygen at birth, regulates perinatal fibroblast and myofibroblast differentiation[J].PLoS One, 2013,8(1): e54806. |
| [4] | Wright CJ, Dennery PA.Manipulation of gene expression by oxygen: a primer from bedside to bench[J].Pediatr Res, 2009,66(1): 3-10. |
| [5] | 李文斌, 常立文, 祝华平, 等.高氧、维甲酸对胎鼠肺成纤维细胞 c-Jun、c-Fos 表达的影响 [J].华中科技大学学报(医学版), 2003, 32(2): 216-219. |
| [6] | Klimova TA, Bell EL, Shroff EH, et al.Hyperoxia-induced premature senescence requires p53 and pRb, but not mitochondrial matrix ROS[J].FASEB J, 2009, 23(3): 783-794. |
| [7] | Maniscalco WM, Watkins RH, Roper JM, et al.Hyperoxic ventilated premature baboons have increased p53, oxidant DNA damage and decreased VEGF expression[J].Pediatr Res, 2005,58(3): 549-556. |
| [8] | Albertine KH, Dahl MJ, Gonzales LW, et al.Chronic lung disease in preterm lambs: effect of daily vitamin A treatment on alveolarization[J].Am J Physiol Lung Cell Mol Physiol, 2010,299(1): L59-L72. |
| [9] | 李文斌, 常立文, 容志惠, 等.维甲酸对高氧暴露下原代培养的胎鼠肺泡Ⅱ型上皮细胞和成纤维细胞增殖与凋亡的影响 [J].细胞生物学杂志, 2007, 29(1): 115-121. |
| [10] | McGrath-Morrow SA, Lauer T, Collaco JM, et al.Transcriptional responses of neonatal mouse lung to hyperoxia by Nrf2 status[J].Cytokine, 2014, 65(1): 4-9. |
| [11] | Das KC, Ravi D, Holland W.Increased apoptosis and expression of p21 and p53 in premature infant baboon model of bronchopulmonary dysplasia[J].Antioxid Redox Signal, 2004,6(1): 109-116. |
| [12] | 祝华平, 常立文, 李文斌.CyclinD1和p21CIP1在 大鼠肺发育过程中的动态表达 [J].中国当代儿科杂志, 2011, 13(5): 396-400. |
 2014, Vol. 16
2014, Vol. 16


