2. 泸州医学院附属医院新生儿科, 四川 泸州 646000
新生儿重度缺氧缺血性脑病(hypoxic-ischemic encephalopathy,HIE)为新生儿死亡及儿童致残的 重要原因之一,目前仍无有效的根治性治疗措施。 近 10 年来干细胞移植研究有了重大突破。其中, 人脐带间充质干细胞(human umbilical cord-derived mesenchymal stem cells,hUC-MSCs)是最新研究的 热点之一。研究表明 MSCs 对大鼠缺氧缺血性脑 损伤(hypoxic-ischemic brain damage,HIBD)有保 护作用,但其确切机制尚不清楚[1, 2]。HIE 发病机 制复杂,其中,脑缺氧缺血所诱导的细胞凋亡是 HIE 病理改变及神经系统后遗症的重要原因 [3],而 PI3K/Akt 为经典的抗凋亡促存活信号通路 [4]:神经 营养因子激活酪氨酸激酶受体,通过一系列级联 反应,最终抑制凋亡关键酶 Caspase-3 活化,从而 阻断细胞凋亡。因此设想 hUC-MSCs 移植治疗新生 大鼠 HIBD 可能主要通过释放神经营养因子,抑制 Caspase-3 活化进而减少细胞凋亡,发挥神经保护 作用。本研究拟探讨 hUC-MSCs 通过 Caspase-3对 细胞凋亡的抑制调控、hUC-MSCs 自分化及对内源 性神经样细胞的促分化作用,从而揭示 hUC-MSCs 移植治疗新生大鼠 HIBD 的关键性机制。 1 材料与方法 1.1 材料
hUC-MSCs 购自四川省干细胞库。其他材料 包括5-溴脱氧嘧啶尿苷(BrdU,中杉金桥), TUNEL 原位细胞凋亡检测试剂盒(Roche),小 鼠抗人 BrdU 抗体(1 : 250,abcam),兔抗大鼠 GFAP 抗体(1 : 1 000,abcam),兔抗大鼠 NSE 抗 体(1 : 200,abcam),山羊抗兔 IgG/FITC(1 : 100, 中 杉 金 桥),山 羊 抗 小 鼠 IgG/TRITC(1 : 100, 中杉金桥),兔抗大鼠 Caspase-3 抗体(1 : 500, beyotime),小鼠抗大鼠 β-actin 抗体(1 : 3 000, 中杉金桥),山羊抗兔 IgG/ 辣根酶标记(1 : 3 000, 中杉金桥),山羊抗小鼠 IgG/ 辣根酶标记(1 : 3 000, 中杉金桥),DMI4000B 倒置荧光显微镜,CM1900 冰冻切片机,ULTRA · LUMTM 凝胶成像系统等。 1.2 实验动物及分组
健 康 清 洁 级 新 生 10 日 龄 Sprague-Dawley (SD)大鼠182 只,雌雄不限,平均出生体重 16.6±2.8 g,购自于成都达硕实验动物有限公司。 将 SD 大鼠随机分为假手术组(56 只)、移植组 (MSCs,56 只)及 HIBD 组(56 只)。缺氧缺血 后,MSCs 组动物死亡 6 只,HIBD 组动物死亡 8 只, 随机补充大鼠 14 只,保证每组动物均为 56 只。 将每组按5 个时间点分为5 个亚组,即移植后 24、48 h 及 1、2、3 周,其中,前 2 个时间点亚 组动物数目为 16 只(8 只用于 TUNEL 检测,8 只 用于 Western blot 检测),后 3 个时间点亚组动物 数目为 8 只(均用于免疫荧光检测)。采用 Rice 法[5] 制作 HIBD 模型:乙醚麻醉后常规消毒铺巾, 颈部正中偏右作长约 0.5 cm 切口,分离并结扎右 侧颈总动脉后缝合皮肤;1 h 后置于 92% N2 和 8% O2的缺氧舱中 2.5 h,流量 2 L/min。假手术组大鼠 仅游离右侧颈总动脉,不作结扎及缺氧处理。 1.3 BrdU 标记 hUC-MSCs
细胞传代后,将 BrdU 以 200 μmol/L 加入培养 液中。48 h 后,免疫荧光检测 BrdU 标记是否成功。 将 BrdU 标记的 hUC-MSCs 用生理盐水制成浓度为 4×104/μL 的单细胞混悬液备用。 1.4 侧脑室移植方法
MSCs 组在 HIBD 建模后 24 h,取 hUC-MSCs 悬液 5 μL 注入动物右侧脑室内,注射部位为人字 缝前 3.0 mm,右 1.8 mm,进针深度 2.3 mm。注射 时间 5 min,注射后留针 5 min。HIBD 组及假手术 组动物于同时间,以同部位、同方式注入等量生 理盐水。 1.5 TUNEL 检测移植后细胞的凋亡情况
于侧脑室移植 24、48 h,将各组动物麻醉后 断头取脑,包埋并置于 -80℃冻存 2 h 以上,连续 冠状切片后行 TUNEL 染色,观察凋亡情况。 1.6 Western blot 检测移植后 Caspase-3 的表达
于侧脑室移植 24、48 h 后,将动物麻醉后断 头取脑,Western blot 检测 Caspase-3 的表达。凝胶 成像分析软件测定 Western blot 所得条带的积分光 密度值(IOD)。 1.7 神经行为学评价
于侧脑室移植后 1、2、3 周,运用 Longa 评 分法[6] 对各组大鼠进行神经行为学评价。其分值 越高,表明其神经功能异常程度越重。 1.8 免疫荧光检测胶质纤维酸性蛋白、神经元特 异烯醇化酶
于侧脑室移植后1、2、3 周,将各组动物麻醉后断头取脑,包埋并置于 -80℃冻存 2 h 以 上,连续冠状切片后行 BrdU 及胶质纤维酸性蛋白 (GFAP)或神经元特异烯醇化酶(NSE)双标染色, 荧光显微镜下观察移植细胞的存活、迁徙、分化 情况。每只动物随机选取 10 个视野运用 Image-Pro plus 软件计算 GFAP、NSE 的免疫荧光强度。 1.9 统计学分析
运用 SPSS 17.0 统计软件进行统计学分析,各 组数据以均数 ± 标准差(x±s)表示,组间比较 采用单因素方差分析(one-way ANOVA),P<0.05 为差异有统计学意义。 2 结果 2.1 BrdU 标记 hUC-MSCs 的鉴定
BrdU 标记 hUC-MSCs,荧光显微镜下可见红 色荧光(图 1A),而对照组为阴性(图 1B)。
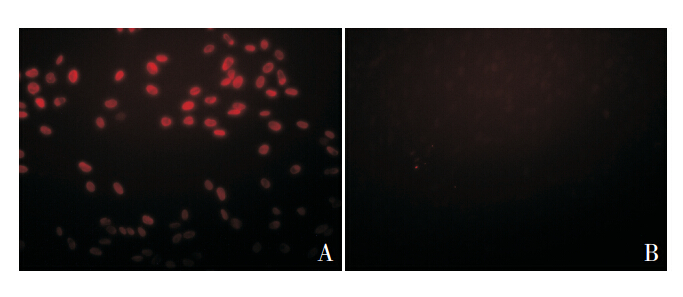 |
图 1 免疫荧光鉴定 Brd U 标记的 hUC-MSCs(×200) A:Brd U 标记的 hUC-MSCs 可见红色荧光;B:阴性对照。 |
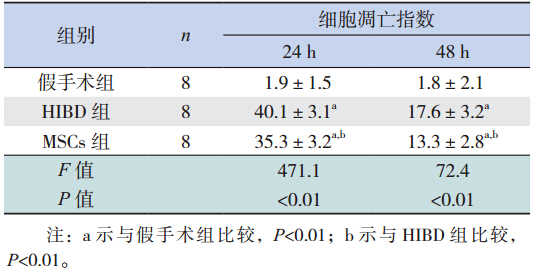
移植后 48 h 进行凋亡检测,每组随机选取 10 个视野,细胞核呈绿色的为 TUNEL 阳性细胞,计 算阳性细胞百分率作为凋亡指数。其中,假手术 组细胞凋亡数较少,HIBD 组的凋亡数最为明显, MSCs 组较 HIBD 组明显减少。见表 1。
| 表1 移植后 3 组大鼠细胞凋亡指数比较 (x±s,%) |
移植后 24、48 h,HIBD 组的表达量最为明 显,MSCs 组较 HIBD 组减少,而较假手术组增高 (P<0.05)(图 2)。
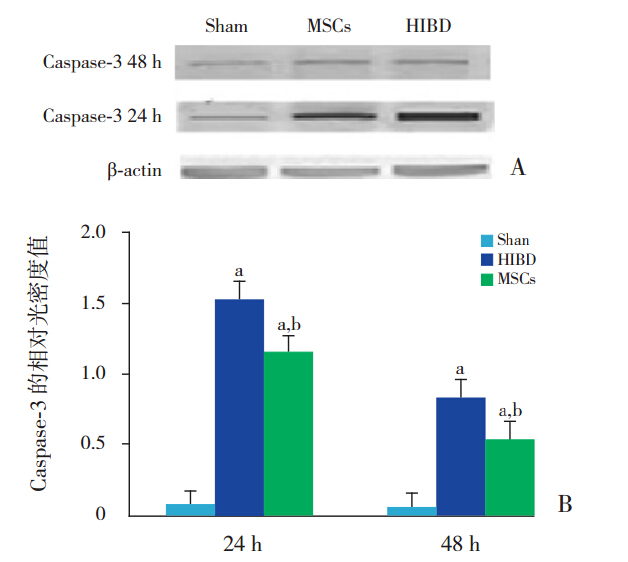 |
图 2 Caspase-3的表达(n=8) 图 A、B 分 别 为 Western blot 检测和定量分析 Caspase-3 的表达。a 示与假手术组比 较,P<0.05;b 示与 HIBD 组比较,P<0.05(Sham:假手术组; MSCs:MSCs 组;HIBD:HIBD 组)。 |
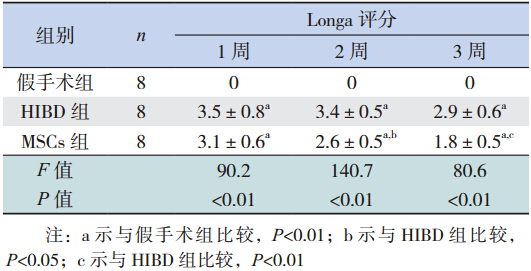
移植后,随日龄增加,MSCs 组新生大鼠在精 神状态、反应能力、运动功能等各方面较 HIBD 组 逐渐改善。移植后 2、3 周,MSCs 组 Longa 评分较 HIBD 组明显降低(P<0.05),见表 2。
| 表2 3 组大鼠不同时间点 Longa 评分比较(x±s,%) |
MSCs 组在移植后 1、2、3 周,免疫荧光可见 BrdU 阳性细胞表达,主要分布于损伤侧海马区域 及大脑皮质,部分 hUC-MSCs 胞浆内 GFAP 或 NSE 染色同时呈阳性反应(图 3),随时间延长,BrdU 阳性细胞数量逐渐减少。MSCs 组 GFAP、NSE 阳 性表达明显高于 HIBD 组(P<0.05),且随时间延 长其表达逐渐增强(P<0.05)(图 4~7)。
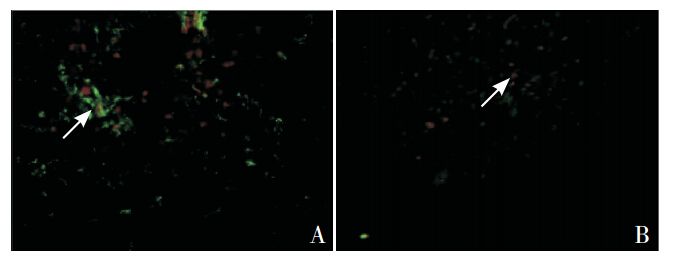 |
图 3 移植后1 周MSCs 组大鼠脑组织内的hUCMSCs 表达(免疫荧光,×400) A:BrdU 阳性细胞同时有 GFAP 阳性表达(箭头所示);B:BrdU 阳性细胞同时有 NSE 阳 性表达(箭头所示)。 |
 |
图 4 组大鼠 GFAP 的表达 (免疫荧光,×400)MSCs 组GFAP 阳性表达明显高于HIBD 组, 且随着时间延长其表达逐渐增强。 |
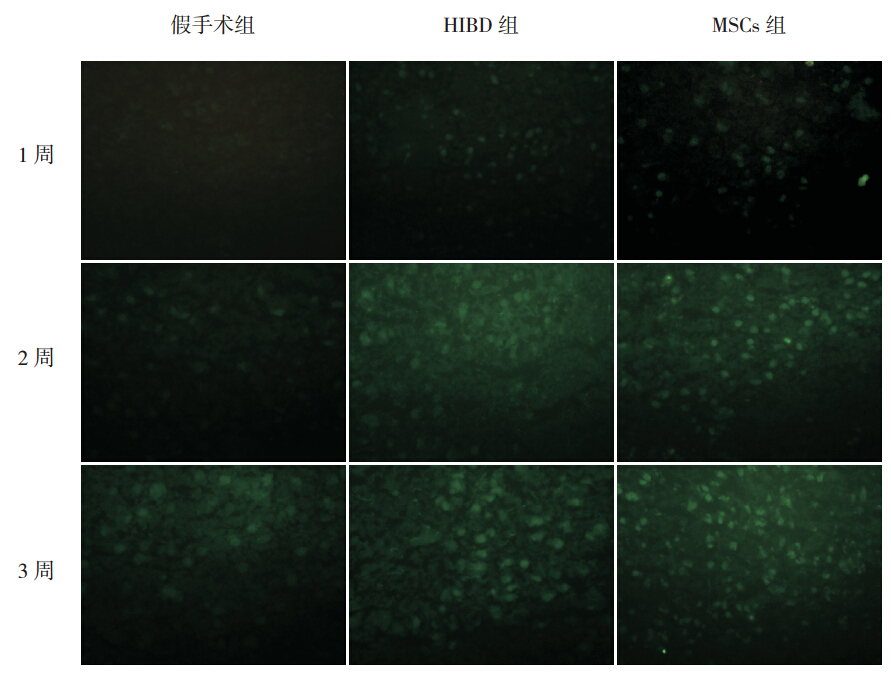 |
图 5 3 组大鼠 NSE 的表达 (免疫荧光,×400) MSCs 组 NSE 阳性表达明显高于 HIBD 组,且 随着时间的延长其表达逐渐增强。 |
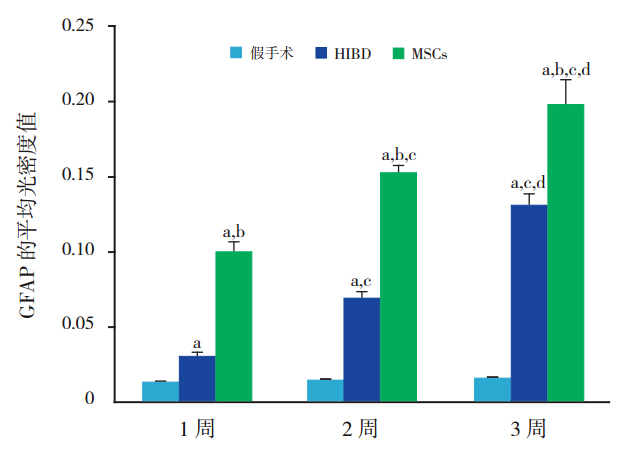 |
图 6 定量分析 GFAP 的平均荧光强度 a 示与假手 术组比较,P<0.05;b 示与 HIBD 组比较,P<0.05;c 示与同组 1 周时比较,P<0.05;d 示与同组 2 周时比较,P<0.05。 |
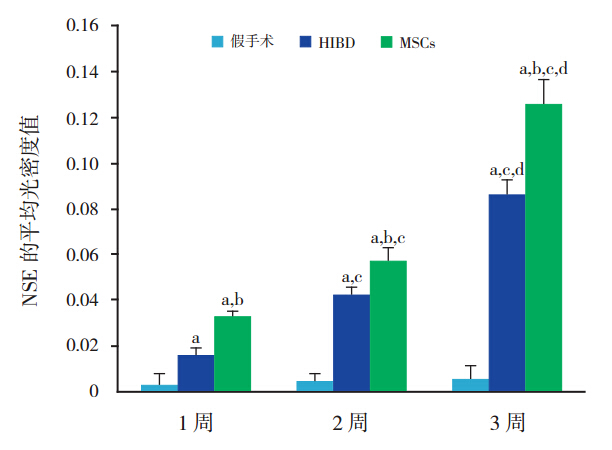 |
图 7 定量分析 NSE 的平均荧光强度 a 示与假手术 组比较,P<0.05;b 示与 HIBD 组比较,P<0.05;c 示与同组 1 周 时比较,P<0.05;d 示与同组 2 周时比较,P<0.05。 |
HIE 是由一系列细胞因子及信号通路共同参 与的复杂连锁反应的结果,其中,最关键的环节 是迟发性细胞损伤所导致的细胞凋亡阶段[7],于缺 氧缺血后 24~48 h 达高峰,而 Caspase-3 为细胞凋 亡级联反应中最关键的凋亡效应蛋白酶[8]。有研究 表明,神经营养因子可以激活酪氨酸激酶受体, 进而启动经典的抗凋亡促存活信号通路 PI3K/Akt, 最终通过抑制凋亡关键酶 Caspase-3 的活化,阻断 细胞凋亡[4]。另有文献报道,MSCs 可以通过释放 神经营养因子减少细胞凋亡,从而促进濒临死亡 的自体神经元存活[9],发挥神经保护与修复作用。
本研究根据文献选择 HIBD 后 24 h 作为移植 时间点,将5 μL hUC-MSCs 悬液(4×104/μL)经 侧脑室移植,对 HIBD 新生大鼠脑组织进行相关检 测。由于 HIBD 后 24~48 h,细胞凋亡达高峰,因此, 本研究以侧脑室移植后 24 h 即 HIBD 后 48 h 作为 初始检测时间点,对细胞凋亡数量及 Caspase-3的 表达进行测定。结果表明:侧脑室移植 48 h 后, MSCs 组的细胞凋亡数量以及 Caspase-3 的表达量 低于 HIBD 组,推测 hUC-MSCs 移植治疗新生大鼠 HIBD 时,借助于多种神经营养因子的释放,早期 可通过抑制 Caspase-3 的表达,减少细胞凋亡,从 而发挥神经保护作用。
新生大鼠 HIBD 的主要损伤部位为海马区域 及大脑皮层。本研究将 BrdU 标记的 hUC-MSCs 移 植入 HIBD 新生大鼠脑组织内,观察到移植后 1、2、 3 周脑组织切片上均可见标记物 BrdU 阳性细胞表 达,其表达量随时间推移而逐渐减少。BrdU 阳性 细胞主要分布于损伤侧海马区域及大脑皮质,偶 见于对侧脑组织,部分移植细胞同时有 GFAP 或 NSE 的阳性表达。MSCs 组 GFAP 及 NSE 阳性表达 明显高于 HIBD 组,而且 MSCs 组移植后 1、2、3 周 GFAP 及 NSE 阳性表达逐渐增强。上述结果表 明,外源性植入 hUC-MSCs 可于脑组织内存活,并 可定向迁徙到受损的海马区域及大脑皮质,可能 与受损脑组织分泌的特异性细胞因子或化学趋化 因子有关[10, 11] 。本研究还发现,植入的 hUC-MSCs 可同时表达 GFAP 或 NSE,表明植入细胞可向神 经元及神经胶质细胞分化,与国内外研究结果相 一致[1,12] 。有学者认为,hUC-MSCs 参与神经系统 功能的恢复与植入细胞整合入宿主脑内重建神经 与突触网,发挥直接替代作用有关[13, 14]。本研究 尚没有足够证据表明 hUC-MSCs 可直接整合入宿主 脑组织内参与神经环路的组建。本研究结果显示, 移植的 hUC-MSCs 的数量随移植后时间的延长逐渐 减少,而神经样细胞则逐渐增多,推测 HIBD 新生 大鼠神经功能的修复主要与除 hUC-MSCs 早期抑制 Caspase-3 的表达,减少神经细胞凋亡有关外 [15], 更重要的是与 hUC-MSCs 的存活、迁徙、自身分化 为神经样细胞以及后期 hUC-MSCs 促进内源性神经 样细胞的分化均有关。本研究结果显示,BrdU 标 记的阳性细胞越来越少,可推测移植细胞的直接 替代作用可能会较小[16],其具体机制尚有待于进 一步的研究。
动物神经行为学的研究是对精神状态、运动 中枢及神经功能的综合评估,可全面反映动物的 整体状态。本研究发现 MSCs 组新生大鼠神经行 为较 HIBD 组有所改善,MSCs 组 Longa 评分低于 HIBD 组,而且随时间的推移这种改善更加明显, 说明 MSCs 随着移植时间的延长可有效促进 HIBD 大鼠神经功能的恢复,这与植入 MSCs 促进神经样 细胞分化的时间基本吻合。由此可见,hUC-MSCs 移植治疗 HIBD 新生大鼠时,可通过早期抑制神经 细胞凋亡,后期定向分化为神经样细胞并促进内 源性神经样细胞的分化,修复损伤脑组织,从而 有效改善 HIBD 新生大鼠的神经行为,为临床应用 hUC-MSCs 移植治疗新生儿 HIE 提供了一定的理论 依据。
| [1] | Xia G, Hong X, Chen X, et al.Intracerebral transplantation of mesenchymal stem cells derived from human umbilical cord blood alleviates hypoxic ischemic brain injury in rat neonates[J].J Perinat Med, 2010, 38(2): 215-221. |
| [2] | Wei X, Du Z, Zhao L, et al.IFATS collection: The conditioned media of adipose stromal cells protect against hypoxia-ischemia-induced brain damage in neonatal rats[J].Stem Cells, 2009,27(2): 478-488. |
| [3] | Nakajima W, Ishida A, Lange MS, et al.Apoptosis has a prolonged role in the neurodegeneration after hypoxic ischemia in the newborn rat[J].J Neurosci, 2000, 20(21): 7994-8004. |
| [4] | Zhao H, Sapolsky RM, Steinberg GK.Phosphoinositide-3-kinase/akt survival signal pathways are implicated in neuronal survival after stroke[J].Mol Neurobiol, 2006, 34(3): 249-270. |
| [5] | Rice JE 3rd, Vannucci RC, Brierley JB.The influence of immaturity on hypoxic-ischemic brain damage in the rat[J].Ann Neurol, 1981, 9(2): 131-141. |
| [6] | Longa EZ, Weinstein PR, Carlson S, et al.Reversible middle cerebral artery occlusion without craniectomy in rats[J].Stroke,1989, 20(1): 84-91. |
| [7] | Nakka VP, Gusain A, Mehta SL, et al.Molecular mechanisms of apoptosis in cerebral ischemia: multiple neuroprotective opportunities[J].Mol Neurobiol, 2008, 37(1): 7-38. |
| [8] | Muñoz-Pinedo C.Signaling pathways that regulate life and cell death: evolution of apoptosis in the context of self-defense[J].Adv Exp Med Biol, 2012, 738: 124-143. |
| [9] | Neuhoff S, Moers J, Rieks M, et al.Proliferation, differentiation and cytokin secretion of human umbilical cord blood-derived mononuclear cells in vitro[J].Exp Hematol, 2007, 35(7): 1119-1131. |
| [10] | Bona E, Andersson AL, Blomgren K, et al.Chemokine and inflammatory cell response to hypoxia-ischemia in immature rats[J].Pediatr Res,1999, 45(4 Pt 1): 500-509. |
| [11] | Levenberg S, Burdick JA, Kraehenbuehl T, et al.Neurotrophin-induced differentiation of human embryonic stem cells on three-dimensional polymeric scaffolds[J].Tissue Eng, 2005, 11(3-4):506-512. |
| [12] | Pimentel-Coelho PM, Magalhães ES, Lopes LM, et al.Human cord blood transplantation in a neonatal rat model of hypoxic-ischemic brain damage: functional outcome related to neuroprotection in the striatum[J].Stem Cells Dev, 2010, 19(3):351-358. |
| [13] | Zheng T, Rossignol C, Leibovici A, et al.Transplantation of multipotent astrocytic stem cells into a rat model of neonatal hypoxic-ischemic encephalopathy[J].Brain Res, 2006, 1112(1):99-105. |
| [14] | Kitada M, Dezawa M.Induction system of neural and muscle lineage cells from bone marrow stromal cells; a new strategy for tissue reconstruction in degenerative diseases[J].Histol Histopathol, 2009, 24(5): 631-642. |
| [15] | Chopp M, Li Y.Treatment of neural injury with marrow stromal cells[J].Lancet Neurol, 2002, 1(2): 92-100. |
| [16] | Chen J, Sanberg PR, Li Y, et al.Intravenous administration of human umbilical cord blood reduces behavioral deficits after stroke in rats[J].Stroke, 2001, 32(11): 2682 -2688. |
 2014, Vol. 16
2014, Vol. 16