2. 阿克苏第一人民医院妇产科, 新疆 阿克苏 843000;
3. 石河子大学医学院第一附属医院儿科, 新疆 石河子 832008
新生儿持续性肺动脉高压(persistent pulmonary hypertension,PPH) 是新生儿期常 见的危重病症之一,发生率占活产婴儿的 1/1 200~2/1 200[1],病死率高。研究表明,围生期 窒息缺氧是新生儿PPH 发生的主要原因之一[2]。 目前新生儿PPH 发病机制尚不清楚,关于 11β-HSD2 及肾素- 血管紧张素- 醛固酮等相关 信号分子在新生儿PPH 发病中的研究鲜有文献报 道。11β-HSD2 是糖皮质激素代谢的关键酶之一, 可通过调节局部组织器官中的糖皮质激素水平来 影响血管功能,低氧状态可负向调控11β-HSD2 的表达。本研究在采用缺氧加吲哚美辛联合诱导 胎鼠肺动脉高压模型的基础上,从11β-HSD2 的 角度出发,通过检测PPH 新生大鼠血清中皮质醇 以及肺组织中前列环素、肾素、血管紧张素、醛 固酮的浓度,探讨11β-HSD2 及相关信号分子在 新生儿PPH 发病中的作用,从而为新生儿PPH 的 临床诊治及预防提供理论基础。
1 材料与方法 1.1 实验对象及分组Sprague-Dawley(SD)清洁级雌鼠10 只,雄 鼠5 只,约8 周龄,体重210~230 g,购自新疆医 科大学实验动物中心,动物生产许可证号:SCXK [新]2003-0001。适应性喂养1 周后,于上午 10:00 合笼,次日上午10 : 00 查阴道脱落细胞并进 行涂片,以查到精子记为孕0 d。孕鼠分笼饲养, 共孕6 只,随机分配为对照组和PPH 组各3 只, 获取对照组新生大鼠28 只,PPH 组新生大鼠31 只。 分别从对照组和PPH 组随机抽取15 只仔鼠用于实 验处理。
1.2 主要试剂主要试剂包括吲哚美辛(Sigma, BCBF9122V)、兔多克隆抗大鼠11β-HSD2(美 国Santa Cruz,LO909)、FITC 标记抗兔( 北京 中杉金桥,106103)、Propidium Iodide(Sigma, SLBD2912V)、大鼠血管紧张素、皮质醇、肾素、 醛固酮ELISA 试剂盒(优尔生,武汉)及前列环 素ELISA 试剂盒(西唐,上海)。
1.3 主要仪器主要仪器包括恒温水浴箱、酶标仪、低温台 式离心机(Thermo-scientific,USA)、激光共聚焦 显微镜、冰冻切片机、微量加样器等。
1.4 胎鼠肺动脉高压模型的建立采用缺氧加吲哚美辛建立胎鼠肺动脉高压模 型[2]。在妊娠的第19 天,孕鼠被随机分为PPH 组 和对照组。PPH 组:妊娠第19 天将大鼠置于12% 氧浓度的有机玻璃盒中,保持箱内温度25~27℃, 湿度50%~70%,孕鼠可在箱内自由饮食。每天定 时添加水、饲料及更换垫料。腹腔内注射吲哚美 辛0.5 mg/kg,每日两次,连续3 d。对照组:妊娠 第19 天将大鼠置于空气中,腹腔内注射与PPH 组 孕鼠相同体积的生理盐水,其他条件与PPH 组一 致。妊娠第22 天,腹腔注射戊巴比妥钠50 mg/kg 麻醉孕鼠并迅速剖腹取出仔鼠(剔除提前出生的 仔鼠)。新生仔鼠处死后立即取出左肺,将其液 氮速冻后-80℃保存。右肺组织被取出后用4 % 多 聚甲醛固定至少24 h,用于苏木精- 伊红(HE) 染色和免疫组化。同时取心脏进行HE 染色病理检 测。并通过比较PPH 组与对照组新生大鼠右心室 游离壁厚度及肺组织中肺小动脉中膜厚度/(中膜 + 内腔)厚度比值的差异进行模型验证。
1.5 新生大鼠肺组织11β-HSD2 表达的检测在激光共聚焦显微镜下观察11β-HSD2 在新 生大鼠肺组织中的表达。取新生大鼠新鲜肺组织 进行冰冻切片(4~5 μm),储存于-20 ℃冰箱中 待用。将冰冻切片取出,静置10 min,待切片回 温和干燥,浸于PBS 中震洗3 次,每次5 min,用 吸水纸吸干组织周围多余的PBS,加入一抗兔抗 大鼠11β-HSD2(1 : 200),在4 ℃冰箱中过夜, 然后冲洗一抗,在浸于PBS 中震洗3 次,每次 5 min,用吸水纸吸干组织周围多余的PBS,加入 二抗山羊抗兔(1 : 50),将切片置于暗盒中37℃ 孵育45 min,用PBS 洗去二抗,用吸水纸吸干组 织周围多余的PBS,用10 μg/L Propidium Iodide 封片。在激光共聚焦显微镜下观察,并采用AIM Image Examiner 软件对扫描图像进行量化分析。
1.6 新生大鼠血清皮质醇及肺组织前列环素、肾素、血管紧张素、醛固酮浓度的检测应用ELISA 检测血清皮质醇及肺组织前列环 素、肾素、血管紧张素、醛固酮的浓度。采用断 头取血法将新生大鼠血液放置于抗凝管中,混匀, 静置20 min 后3 000 g 离心20 min,取上清,贮存于-80℃。严格按皮质醇说明书检测血清中的皮质 醇的含量。取1 g 肺脏组织,加入5 mL 0.01 M PBS (pH=7.4),匀浆后5 000 r/min 离心20 min,取上清, 按照试剂盒说明书操作,在450 nm 波长下测定吸 光度(OD 值),计算新生大鼠肺组织中前列环素、 肾素、血管紧张素、醛固酮的浓度。
1.7 统计学分析采用SPSS 17.0 统计软件进行统计学分析,数 据以均数± 标准差(x±s)表示,两组间比较采 成组t 检验,P<0.05 为差异有统计学意义。
2 结果 2.1 评价胎鼠肺动脉高压模型指标的变化缺氧后,新生大鼠右心室出现肥厚,肺小动 脉管壁增厚。HE 染色结果显示:与对照组相比, PPH 组新生大鼠右心室游离壁厚度增高,差异有 统计学意义(P<0.01)。新生大鼠肺小动脉中膜厚 度/(中膜+ 内腔)厚度增大,差异有统计学意义 (P<0.01)。见表 1。
| 表 1 37 例移植患儿一般情况 |
激光共聚焦显微镜下显示11β-HSD2 在两 组新生大鼠肺组织中广泛表达,主要表达在肺血 管上皮细胞、肺泡上皮细胞及支气管上皮细胞胞 浆内,见图 1C、F。PPH 组11β-HSD2 表达较对 照组减少,见图 1A、D。对照组、PPH 组新生大 鼠肺组织中11β-HSD2 的平均荧光强度分别为 200±23、72±31,两组比较差异有统计学意义 (t=11.477,P<0.01)。
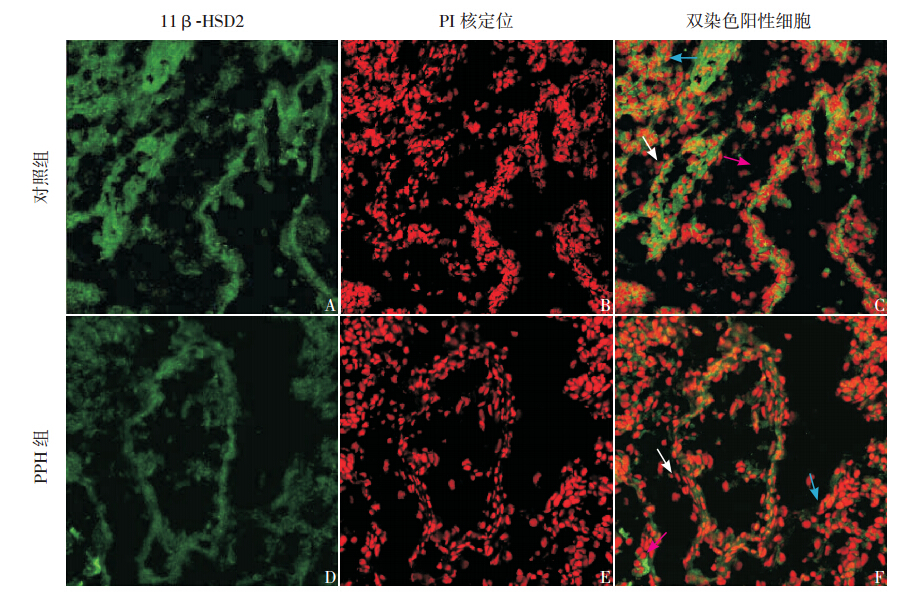 |
图 1 激光共聚焦显微镜定位11β-HSD2 的表达(×200)与对照组( 图A) 相比,PPH 组( 图D)11β-HSD2 阳性细胞的表达减少。图B、E 显示了核染色定位肺血管、肺泡及支气管上皮细胞。图C、F 显示11β-HSD2 主要是在肺血管上皮细胞(白色箭头所示)、肺泡上皮细胞(蓝色箭头所示)及支气管上皮细胞(红色箭头所示)胞浆内表达。 |
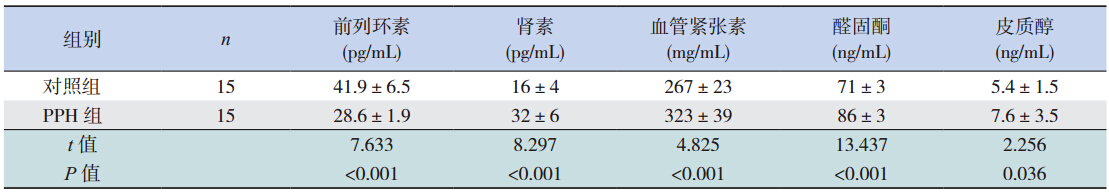
与对照组比较,PPH 组新生大鼠血清皮质醇 浓度升高,差异有统计学意义(P<0.05);PPH 组肺组织中前列环素的水平降低,差异有统计学 意义(P<0.01);肾素、血管紧张素、醛固酮的水 平增高,差异有统计学意义(均P<0.01),见表 2。
| 表 1 37 例移植患儿一般情况 |
本研究采用缺氧加吲哚美辛联合诱导的方法 建立胎鼠肺动脉高压模型。病理学研究结果显示: PPH 组新生大鼠右心室游离壁及肺小动脉管壁较 对照组显著增厚,表明胎鼠肺动脉高压模型建立 成功。相关研究认为缺氧导致肺微小动脉内皮损 伤,进而引起血管内皮功能失调,使得血管活性 物质及细胞因子产生及释放异常,血管舒缩平衡 因子失调,作用于血管平滑肌,早期表现为肺血 管收缩,后期表现为肺血管壁病理改变及肺血管 重建[3, 4]。
本研究结果显示:与对照组相比,PPH 组新 生大鼠肺组织中11β-HSD2 的表达降低,新生大 鼠血清中皮质醇的浓度升高。目前关于11β-HSD2 调控皮质激素的研究主要集中在胎盘,胎盘 11β-HSD2 在降低母体皮质醇水平从而保护胎儿 在宫内的正常生长发育提供重要作用[5]。在胎儿宫 内生长迟缓和先兆子癎等病理状态的胎盘组织中, 11β-HSD2 表达量和酶活性明显低于正常胎盘组 织[6, 7]。已有研究证实胎儿各种组织器官包括肺脏 均有11β-HSD2 表达[8],提示宫内缺氧也可能导 致肺脏11β-HSD2表达减少从而影响肺血管功能。 本研究证实了11β-HSD2 主要是在新生大鼠肺组 织中肺泡上皮细胞、支气管上皮细胞及肺血管上 皮细胞胞浆中表达。
在体内,健康人外周血管阻力的维持需要少 量的皮质激素。11β-HSD2 是糖皮质激素代谢的关 键酶之一,为专一氧化酶。在糖皮质激素作用的 调节中,11β-HSD2 的激活和调节起着关键作用[9]。 11β-HSD2 的表达障碍可以导致皮质醇灭活减少, 缺氧抑制了肺组织中11β-HSD2 的表达和活性, 使皮质醇浓度增加,并且还可以通过活化盐皮质 激素受体导致高血压[10]。根据相关报道,过多的 皮质醇可通过抑制内皮细胞前列环素等血管舒张 因子的产生,同时通过与其受体结合并激活该受 体进而增加血管平滑肌细胞上的α 肾上腺素受 体、血管紧张素II 受体等缩血管物质,从而增加 血管的缩血管效应,最终诱导高血压的发生和发 展[11, 12]。在活体研究中也显示,抑制血管内皮细 胞的11β-HSD2,可通过反应级联以自分泌的方 式使血管收缩,还会导致血管紧张素II 和肾上腺 素反应加强[13],血管紧张素Ⅱ促进血管收缩和肾 上腺皮质分泌醛固酮,醛固酮可促进钠、水重吸收, 引起血压增高。前列环素与多种肺部疾病相关[14, 15], 它主要由内皮细胞分泌,具有强大的扩张血管,抑 制血小板聚集及细胞黏附的作用,不仅能预防血 栓形成,还能直接作用于平滑肌细胞,进而促使 血管扩张。近年来证实气管内应用前列环素能选 择性降低肺血管阻力[16],应用前列环素类药物(如 前列地尔)能够有效地治疗新生儿PPH[17] 及低氧 性肺动脉高压[18]。本研究结果显示,PPH 组肺组 织中前列环素水平较对照组降低,肾素、血管紧 张素、醛固酮水平较对照组升高,表明11β-HSD2 通过影响前列环素、肾素、血管紧张素、醛固酮 参与新生儿PPH 的发病机制,可能成为干预新生 儿PPH 病情进展的另一个新途径。
综上所述,11β-HSD2 在新生大鼠肺组织中 广泛表达。PPH 新生大鼠肺组织中11β-HSD2 的 表达减低,使新生大鼠血清皮质醇浓度升高。过高浓度的皮质醇一方面通过抑制肺血管内皮细胞 分泌舒血管物质,另一方面又通过激活α 肾上腺 素、血管紧张素II 等缩血管物质,使肺血管舒缩 功能失衡,持续处于收缩状态,肺血管压力升高, 进而造成肺动脉高压。血管紧张素II 又促进了肾 上腺皮质分泌醛固酮,造成体内水钠潴留,进一 步增加了肺血管的压力。
| [1] | 杜立中, 魏克伦, 孙眉月.新生儿持续肺动脉高压诊疗常规[J].中华儿科杂志, 2002, 40(7): 438-439. |
| [2] | Xu XF, Gu WZ, Wu XL, et al.Fetal pulmonary vascular remodeling in a rat model induced by hypoxia and indomethacin[J].J Matern Fetal Neonatal Med, 2011, 24(1):172-182. |
| [3] | Das R, Balonan L, Ballard HJ, et al.Chronic hypoxia inhibits the antihypertensive effect of melatonin on pulmonary artery[J].Int J Cardiol, 2008, 126(3): 340-345. |
| [4] | 桑葵, 周英, 李明霞.缺氧性肺动脉高压新生大鼠肺血管重塑的研究 [J].中国当代儿科杂志, 2012, 14(3): 210-214. |
| [5] | 姚锋祥, 汤彪, 黄引平.胎盘 11β-HSD2 表达与皮质醇代谢水平的关系及其对子痫前期的相关性研究[J].中国妇幼保健,2013, 28(8): 1336-1339. |
| [6] | Dy J, Guan H, Sampath-Kumar R, et al.Placental 11beta-hydroxysteroid dehydrogenase type 2 is reduced in pregnancies complicated with idiopathic intrauterine growth restriction:evidence that this is associated with an attenuated ratio of cortisone to cortisol in the umbilical artery[J].Placenta, 2008,29(2): 193-200. |
| [7] | Ostreicher I, Almeida JR, Campean V, et al.Changes in 11beta-hydroxysteroid dehydrogenase type 2 expression in a low-protein rat model of intrauterine growth restriction[J].Nephrol Dial Transplant, 2010, 25(10): 3195-3203. |
| [8] | Garbrecht MR, Schmidt TJ, Krozowski ZS, et al.11Beta-hydroxysteroid dehydrogenase type 2 and the regulation of surfactant protein A by dexamethasone metabolites[J].Am J Physiol Endocrinol Metab, 2006, 290(4): E653-E660. |
| [9] | 陈晓琳.11β- 羟基类固醇脱氢酶 2 与炎性疾病的关系 [J].医学综述, 2011, 17(12): 1769-1772. |
| [10] | Campino C, Carvajal CA, Cornejo J, et al.11β-hydroxysteroid dehydrogenase type-2 and type-1(11β-HSD2 and 11β-HSD1) and 5β-reductase activities in the pathogenia of essential hypertension[J].Endocrine, 2010, 37(1): 106-114. |
| [11] | Ong SLH, Whitworth JA.How do glucocorticoids cause hypertension: role of nitric oxide deficiency, oxidative stress,and eicosanoids[J].Endocrinol Metab Clin North Am, 2011,40(2): 393-407. |
| [12] | Dodt C, Wellhoner JP, Schutt M, et al.Glucocorticoids and hypertension[J].Internist(Berl), 2009, 50(1): 36-41. |
| [13] | Hadoke PWF, Christy C, Kotelevtsev YV, et al.Endothelial cell dysfunction in mice after transgenic knockout of type 2, but not type 1, 11β-hydroxysteroid dehydrogenase[J].Circulation, 2001,104(23): 2832-2837. |
| [14] | Hache M, Denault AY, Belisle S, et al.Inhaled prostacyclin(PGI2) is an effective addition to the treatment of pulmonary hypertension and hypoxia in the operating room and intensive care unit[J].Can J Anesth, 2001, 48(9): 924-929. |
| [15] | Schütte H, Schell A, Schäfer C, et al.Subthreshold doses of nebulized prostacyclin and rolipram synergistaically protect against lung ischemia-reperfusion[J].Transplantation, 2003,75(6): 814-821. |
| [16] | Tissot C, Beghetti M.Review of inhaled iloprost for the control of pulmonary artery hypertension in children[J].Vasc Health Risk Manag, 2009, 5(1): 325-331. |
| [17] | 赵芳萍, 石静云, 易彬.新生儿持续肺动脉高压的治疗进展[J].中国妇幼保健, 2012, 27(22): 3521-3524. |
| [18] | 张凌云, 高宝安.肺动脉平滑肌细胞与低氧性肺血管重塑形成机制 [J].中国动脉硬化杂志, 2013, 21(2): 177-181. |
 2014, Vol. 16
2014, Vol. 16