幼年型粒单核细胞白血病(juvenile myelomonocytic leukemia,JMML)是临床罕见的儿童克 隆性造血干细胞异常性疾病,根据WHO 分型为 MDS/MPN。主要累及2 岁以下婴幼儿,其年发病 率为1.2/106,占儿童白血病的2%~3%。男性多于 女性,男∶女比例为1.4~2.5 : 1[1, 2]。JMML 临床表 现非特异性,遗传异质性较大,预后不良。研究 表明JMML 与多种突变基因引起RAS/ 促细胞分裂 原(mitogen)活化的蛋白激酶(MAPK)通路异 常有关[3, 4],然而目前尚无有关JMML 突变类型与 患儿临床特征及预后的相关性研究。为提高JMML 诊断水平,探讨突变基因类型与临床特征、预后 间的相关性,本研究回顾性分析我院2010 年10 月至2013 年3 月收治的14 例JMML 患儿临床病 例资料,并对JMML 基因突变类型及临床特征、 预后相关性进行初步探讨。 1 资料与方法 1.1 研究对象及诊断标准
选取2010 年10 月至2013 年3 月我院收治的 初诊为JMML 患儿14 例为研究对象,收集患儿的 临床资料进行回顾性分析。所有患儿均根据1997 年国际JMML 协作组诊断标准进行诊断:(1)临 床特征:①肝脾肿大,②淋巴结肿大,③贫血症 状及体征,④发热,⑤皮肤损害;(2)最低实验 室标准(同时满足以下3 个条件):① Ph 染色体 或BCR/ABL 融合基因阴性,②外周血单核细胞计 数>1×109/L,③骨髓原始细胞<20%;(3)明确 诊断要求的标准 (除了最低实验室标准至少满足 以下2 个条件):①抗碱血红蛋白(HbF)随年 龄增加,②外周血涂片可见髓系幼稚细胞,③白 细胞>10×109/L,④克隆性异常(包括单体7), ⑤体外培养髓系细胞对粒细胞- 巨噬细胞集落刺 激因子(GM-CSF)高度敏感。 1.2 RT-PCR 检测JMML 突变基因
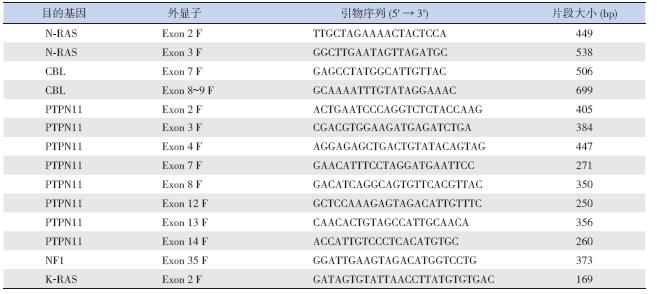
取各组晨起空腹外周血或行骨穿检查取骨髓 4~5 mL,EDTA 抗凝。按照基因组DNA 提取试剂 盒(北京博迈德生物技术有限公司)说明书进行基 因组DNA 提取。将提取的DNA 进行PCR 扩增。 本研究所选目的基因为JMML 常见突变基因,包 括PTPN11、N-RAS、K-RAS、CBL 和NF1,引物 由北京梓熙生物科技有限公司设计合成(表 1)。 PCR 反应体系为25 μL,包括DNA 样品1~2 μL, 2×Mix 12.5 μL,上下游引物各1 μL,ddH2O 补足 至25 μL。PCR 扩增条件:94℃预变性5 min;94℃ 变性30 s,55℃退火30 s,72℃延伸45 s,共35 个 循环;72℃再延伸8 min。扩增产物于1.5% 琼脂糖 凝胶上进行电泳。取PCR 产物进行测序,测序结 果应用Mutation Surveyor v3.25 软件进行分析。
| 表 1 常见突变基因引物序列 |
14 例JMML 患儿中,男11 例(79%),女 3 例(21%),男∶女为3.7 : 1;诊断时中位年龄 2.0 岁( 范围0.6~6.0 岁); 以白细胞增高为首 发症状的5 例,发热6 例,咳嗽3 例,面色苍白 3 例,皮肤黏膜出血点3 例,腹泻1 例。10 例患 儿初诊时出现浅表淋巴结肿大;11 例可见肝脏 肿大,平均右肋下3.2 cm( 范围0.9~9.0 cm); 9 例患儿脾脏肿大,平均左肋下3.6 cm( 范围 1.3~9.0 cm)。Hb 8.6 g/dL(范围4.5~11.1 g/dL), WBC 21.6×109/L( 范围10.4~41.5×109/L),PLT 41.0×109/L(范围9.0~191.0×109/L),单核细胞 绝对值3.9×109/L( 范围1.0~12.0×109/L),HbF 17.8%( 范围1.0%~87.8%)。9 例患儿进行体外 GM-CSF 高敏感性实验,均呈阳性。13 例患儿行 染色体检查,5 例出现染色体数量或结构异常,其 中3 例为7 号染色体缺失,1 例为8 号染色三体, 1 例为复杂染色体核型异常。 2.2 JMML 突变基因检测结果分析
14 例患儿中,PTPN11 基因突变4 例(29%), 为 Exon13 或Exon3 的点突变或错义突变;N-RAS 基因突变3 例(21%),为Exon2 点突变或Exon3 错义突变;1例患儿(7%)同时出现PTPN11和K-RAS 突变;6 例(43%)患儿未检测到常见突变。检测 到突变基因的8 例患儿基因测序图如图 1 所示。
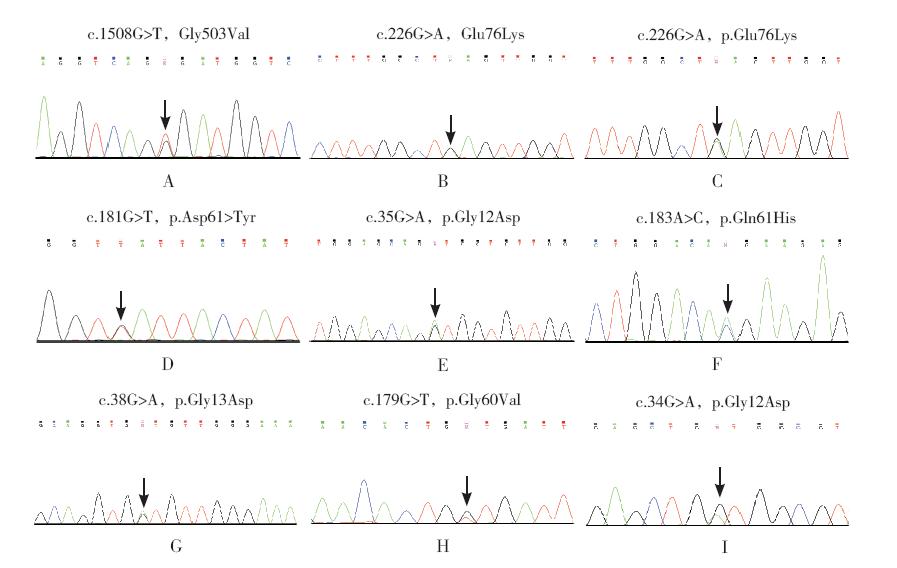 |
图 1 8 例JMML 患儿突变基因DNA 测序图 A:患儿,男,3 岁,PTPN11 基因Exon13 点突变;B:患儿,男,2 岁, PTPN11 基因Exon3 点突变;C:患儿,男,2 岁,PTPN11 基因Exon3 错义突变;D:患儿,男,3 岁,PTPN11 基因Exon3 错 义突变;E:患儿,女,4 岁,N-RAS 基因Exon2 点突变;F:患儿,男,1 岁,N-RAS 基因Exon3 错义突变;G:患儿,男,1 岁,N-RAS 基因Exon2 点突变;H~I:患儿,男,3 岁,H 图示检测到PTPN11 基因Exon3 错义突变,I 图示检测到K-RAS 基因Exon2 错 义突变。箭头所示为基因具体突变位点。 |
本研究中PTPN11 基因突变最常见,发生该 突变的4 例患儿均为男性,中位年龄2.5 岁(范围 2.0~3.0 岁),从发病到明确诊断中位时间为1.0 个月(范围0.3~2.0 个月);4 例患儿均表现不同 程度的贫血、出血、发热及肝、脾、淋巴结肿大; 外周血Hb 8.3 g/dL( 范围45~133 g/dL),HbF 17.3%(范围5.1%~29.5%),WBC 计数31×109/L (范围16.9~41.5×109/L),单核细胞绝对值5.7× 109/L( 范围1.2~12.0×109/L),PLT 计数24.7× 109/L(范围13.0~41.0×109/L);其中3 例患儿进 行染色体及BCR/ABL 融合基因检测,结果显示融 合基因均为阴性,1 例出现7 号染色体缺失,2 例 染色体核型正常;临床观察发现PTPN11 基因突 变患儿疾病进展迅速,主要表现为高热,白细胞 进行性增高,肝脾肿大,感染症状明显,病程中 2 例患儿出现多浆膜腔积液,1 例患儿心功能衰竭; 随访至今,3 例患儿死亡,1 例疾病进展。发生N-RAS 基因突变的3 例患儿中,男2 例,女1 例,中位 年龄2.0 岁(范围1.0~4.0 岁),从发病到明确诊 断中位时间为13.7 个月(范围2.0~36.0 个月); 2 例出现颜面或全身散在皮疹;外周血Hb 9.7 g/dL ( 范围7.5~11.1 g/dL),HbF 7.8%( 范围1.4%~ 17.0%),WBC 计数 18.8×109/L( 范围12.3~28.5× 109/L);3 例患儿均进行染色体及BCR/ABL 融合 基因检测,结果显示融合基因均为阴性,1 例出现 复杂染色体核型异常伴有7 号染色体缺失,2 例染 色体核型正常,临床观察发现N-RAS 基因突变患 儿病情进展缓慢,随访至今,1 例患儿疾病未见 明显进展,2 例患儿死亡。K-RAS 合并PTPN11 基 因突变患儿为男性,3 岁,从发病到明确诊断中 位时间为3 个月;临床表现为贫血貌,可见浅表 淋巴结肿大,肝脾肋下2 cm,外周血WBC 计数 10×109/L;此例患儿接受同胞相合造血干细胞移 植,随访至今血象正常。 3 讨论
JMML 是罕见的儿童克隆性造血干细胞异常 性疾病,多发生于婴幼儿,临床表现非特异性, 对化疗药物反应极差,预后不良,严重威胁着患 儿的健康。JMML 突变基因检测的开展,大大地提 高了临床诊断的准确率,探讨特殊突变基因类型 与临床特征之间的相关性对于提高临床诊断准确 率,判断疾病预后及选择有效治疗方案具有重要 的意义。目前研究表明JMML 发病与NF1、RAS、 PTPN11、CBL 突变引起的RAS/ 促细胞分裂原 (mitogen)活化的蛋白激酶(MAPK)通路异常有 关[3, 4, 5, 6],其中PTPN11 是JMML 最常见的突变基因, 大约35% 的JMML 患儿有PTPN11 体细胞突变[7, 8]。 其主要编码非受体型酪氨酸磷酸酶蛋白SHP-2, 参与生长因子下游信号转导途径,调节多种细胞 反应,包括细胞增殖,分化及游走。在无症状性 JMML 患者体内PTPN11 突变常位于外显子3、4、 13[9],最常见的突变类型为226G>A,产生E76K 蛋白,其具有高度磷酸酶活性,可诱导胎儿肝脏 细胞对GM-CSF 具有高度敏感性,且可将BaF3 细 胞系转化为细胞因子非依赖型[8, 10, 11]。本研究对 14 例患儿进行了JMML 常见突变基因检测,其中 4 例患儿出现PTPN11 突变,占29%,其中2 例患 儿突变位点为最常见的 226G>A 。
JMML 患者对化疗反应极差,异基因造血干 细胞移植是目前唯一有望治疗此类疾病的方法。 但是仍有40% 左右的患者移植后出现复发,且由 于造血干细胞来源有限以及免疫排斥反应,使大 部分患者失去异基因造血干细胞移植的机会。近 年来研究发现,部分JMML 患者有自发缓解趋势。 Matsuda 等[12] 对临床进行观察报道3 例N-RAS 或 K-RAS 突变JMML 患儿临床病情进展缓慢,并获 得最终的自发缓解。Flotho 等长期观察发现12 例 明确诊断为JMML 患儿未进行造血干细胞移植, 随访3 年,5 例带有RAS 突变的患儿获得长期缓 解[13]。研究发现能够获得自发缓解的JMML 病例 一般都具有好的预后因素:如发病年龄小,初诊 血小板>33×109/L,HbF 减低[14, 15]。还有研究报 道女性病例预后不良,可导致女性患儿总生存率 (OS),无事件生存率(EFS)明显减低[16]。本 研究对14 例JMML 患儿进行突变基因检测,并对 突变类型及临床特征、预后进行相关性分析,研 究发现,PTPN11 突变为本研究中最常见的突变基 因类型,占总病例数的29%,与文献报道结果一 致[3, 4]。3 例(21%)患儿出现N-RAS 突变,1 例(7%) 患儿同时伴有PTPN11 及K-RAS 突变。本研究 14 例病例中男性明显多于女性,男: 女为3.7 : 1, 尤其PTPN11 突变患儿均为男性,中位年龄2.5 岁, 高于RAS 及无突变基因患儿,PTPN11 患儿初诊 PLT 中位数为24.7×109/L,而HbF 偏高,平均值 为17.3%,根据文献报道均为预后不良因素。临 床观察发现,此组病例中除1 例未进行临床相关 检测及治疗外,其余3 例病情进展迅速,短时间 内WBC 明显增高,肝脾进行性增大,进而出现多 浆膜腔积液,随访至今,3 例患儿均死亡,1 例患 儿病情进展,提示PTPN11 突变类型疾病凶险,病 情进展迅速,预后不良。N-RAS 突变组中位年龄 2.0 岁,PLT 中位数为35×109/L,HbF 明显低于 PTPN11 突变患儿,此组病例病情进展缓慢,从发 病到明确诊断中位时间为13.7 个月。K-RAS 合并 PTPN11 突变患儿由于接受同胞供者造血干细胞移 植,目前病情恢复,血象正常,但由于此种复杂 突变类型病例数较少,基因类型与临床预后关系 仍有待于进一步观察。
PTPN11 是JMML 病例中最常见的突变类型, 此种类型外周血WBC 计数及单核细胞绝对值增高, PLT 明显降低,疾病进展迅速,预后不良,建议 诊断明确尽早行造血干细胞移植。N-RAS 突变病 例病情进展缓慢,部分病例疾病无进展,临床上 可动态观察,根据病情变化决定治疗方案。复杂 突变基因类型病例数极少,需增加病例数进一步 总结分析。
| [1] | Niemeyer CM, Kratz CP. Paediatric myelodysplastic syndromes and juvenile myelomonocytic leukaemia: molecular classification and treatment options[J]. Br J Haematol, 2008, 140(6): 610-624. |
| [2] | Loh ML. Childhood myelodysplastic syndrome: focus on the approach to diagnosis and treatment of juvenile myelomonocytic leukemia[J]. Hematology Am Soc Hematol Educ Program, 2010, 2010: 357-362. |
| [3] | Liu X, Sabnis H, Bunting KD, et al. Molecular targets for the treatment of juvenile myelomonocytic leukemia[J]. Adv Hematol, 2012, 2012: 308252. |
| [4] | Loh ML. Recent advances in the pathogenesis and treatment of juvenile myelomonocytic leukaemia[J]. Br J Haematol, 2011, 152(6): 677-687. |
| [5] | Emanuel PD, Bates LJ, Castleberry RP, et al. Selective hypersensitivity to granulocyte-macrophage colony-stimulating factor by juvenile chronic myeloid leukemia hematopoietic progenitors[J]. Blood, 1991, 77(5): 925-929. |
| [6] | Loh ML, Sakai DS, Flotho C, et al. Mutations in CBL occur frequently in juvenile myelomonocytic leukemia[J]. Blood, 2009, 114(9): 1859-1863. |
| [7] | Loh ML, Vattikuti S, Schubbert S, et al. Mutations in PTPN11 implicate the SHP-2 phosphatase in leukemogenesis[J]. Blood, 2004, 103(6): 2325-2331. |
| [8] | Tartaglia M, Niemeyer CM, Fragale A, et al. Somatic mutations in PTPN11 in juvenile myelomonocytic leukemia, myelodysplastic syndromes and acute myeloid leukemia[J]. Nat Genet, 2003, 34(2): 148-150. |
| [9] | Kratz CP, Niemeyer CM, Castleberry RP, et al. The mutational spectrum of PTPN11 in juvenile myelomonocytic leukemia and Noonan syndrome/myeloproliferative disease[J]. Blood, 2005, 106(6): 2183-2185. |
| [10] | Schubbert S, Lieuw K, Rowe SL, et al. Functional analysis of leukemia-associated PTPN11 mutations in primary hematopoietic cells[J]. Blood, 2005, 106(1): 311-317. |
| [11] | Chan RJ, Leedy MB, Munugalavadla V, et al. Human somatic PTPN11 mutations induce hematopoietic-cell hypersensitivity to granulocyte-macrophage colony-stimulating factor[J]. Blood, 2005, 105(9): 3737-3742. |
| [12] | Matsuda K, Shimada A, Yoshida N, et al. Spontaneous improvement of hematologic abnormalities in patients having juvenile myelomonocytic leukemia with specific RAS mutations[J]. Blood, 2007, 109(12): 5477-5480. |
| [13] | Flotho C, Valcamonica S, Mach-Pascual S, et al. RAS mutations and clonality analysis in children with juvenile myelomonocytic leukemia (JMML)[J]. Leukemia, 1999, 13(1): 32-37. |
| [14] | Niemeyer CM, Arico M, Basso G, et al. Chronic myelomonocytic leukemia in childhood: a retrospective analysis of 110 cases. European Working Group on Myelodysplastic Syndromes in Childhood (EWOG-MDS)[J]. Blood, 1997, 89(10): 3534-3543. |
| [15] | Passmore SJ, Chessells JM, Kempski H, et al. Paediatric myelodysplastic syndromes and juvenile myelomonocytic leukaemia in the UK: a population-based study of incidence and survival[J]. Br J Haematol, 2003, 121(5): 758-767. |
| [16] | Locatelli F, Nöllke P, Zecca M, et al. Hematopoietic stem cell transplantation (HSCT) in children with juvenile myelomonocytic leukemia (JMML): results of the EWOGMDS/EBMT trial[J]. Blood, 2005, 105(1): 410-419. |
 2015, Vol. 17
2015, Vol. 17