2. 湖南省儿童医院血液内科, 湖南 长沙 410005
急性淋巴细胞白血病(acute lymphoblastic leukemia,ALL)在儿童恶性肿瘤中最常见,约占淋 巴细胞白血病的70%~80%。甲氨蝶呤(methotrexate, MTX)用于肿瘤治疗已逾50 年,目前仍是治疗 ALL 最重要的药物之一,MTX 为叶酸类似物,主 要借助于还原叶酸载体的转运进入细胞,大剂量MTX(HD-MTX)是ALL 髓外白血病防治的重要 措施,胸苷酸合成酶(TS)是叶酸代谢的重要相 关酶,TS 的多态性可导致叶酸代谢相关酶活性的 下降,影响叶酸的正常代谢,TS 常见的3 种基因 型为2R/2R、2R/3R、3R/3R。在临床应用时,HDMTX 可导致严重的骨髓抑制、肝脏毒性、肾脏毒 性、胃肠道反应、黏膜损害(口腔炎)等不良反 应,MTX 因严重的不良反应被迫中断,常常是导 致ALL 复发和患者治疗相关死亡的原因之一。临 床实践中不难发现:不同患者经HD-MTX 治疗后 疗效及相关不良反应亦不同,尤其是不良反应存 在明显的个体差异。因此,研究一个对HD-MTX 化疗相关毒副反应的预测指标对ALL 患儿MTX 的 合理用药是非常有益的,以期为实现个体化治疗 指明方向。 1 资料与方法 1.1 研究对象
选取2011 年3 月至2013 年3 月在湖南省人 民医院儿科和湖南省儿童医院住院的ALL 患儿 73 例为研究对象,所有患儿确诊均参照儿童ALL 诊疗建议[1],且目前均处于缓解期。其中男34 例, 女39 例,年龄范围1 岁8 个月至11 岁11 个月; 标危37 例,中危及高危共36 例。分别记录患儿 化疗前后的血常规(中性粒细胞计数、血红蛋白、 血小板)、肝功能、肾功能,以及临床症状,包 括有无胃肠道反应、口腔炎等。该研究获得患儿 监护人同意并签署知情同意书。 1.2 化疗方案
参照CCLG-ALL 2008 方案,所有ALL 患儿均 行HD-MTX+ 亚叶酸钙(CF)+6- 巯基嘌呤(6-MP) 方案化疗,MTX 使用剂量:标危3 g/m2,中危及 高危5 g/m2。MTX 采用24 h 静脉滴注,10% 剂量 作为突击量在0.5 h 内快速静脉均匀滴入,余量于 23.5 h 内均匀滴入,在行突击量MTX 静脉滴注后 2 h 内,行三联(MTX+ 阿糖胞苷+ 地塞米松)鞘 注1 次。静脉滴注MTX 后36~42 h 用CF 解救, 剂量为15 mg/m2,每6 h 给药1 次,共6~8 次。 行化疗方案当天及后2 d 需大剂量水化碱化(每 日液体总量:3 000 mL/m2,每日总碱量:5% 碳酸 氢钠130 mL/m2)。给药期间,监测24 h 出入水 量,保持尿pH ≥ 7.0;同时,每晚睡前顿服6-MP (25 mg/m2);化疗过程中常规对口腔黏膜、胃肠 道及重要脏器进行保护。 1.3 Real-Time PCR 检测TS 基因多态性
清晨空腹采集ALL 患儿外周静脉血2 mL,置 于EDTA 抗凝试管中4℃保存,48~72 h 内,使用 天根试剂公司的血药基因组DNA 试剂盒(离心柱 型DP318),按照试剂盒说明书提取DNA。将提 取的DNA 进行Real-Time PCR 扩增。根据Genbank 检索到的TS 核苷酸序列,并参考文献[2] 设计TS 基因引物,由华大基因科技股份有限公司合成。 TS 上游引物:5'-GTGGCTCCTGCGTTTCCCCC-3', 下游引物:5'-CCAAGCTTGGCTCCGAGCCGGCCACAGGCATGGCGCGG- 3',片段长度:251 bp。PCR 反应体系(30 μL),包括Mix 15 μL,上下游引物 各1.5 μL,DNA 模板10 μL,去离子水2 μL。反应 条件为:95℃预变性2 min;94℃变性30 s,62℃ 退火30 s,72℃延伸30 s,共36 个循环;72℃再 延伸7 min。取扩增产物5 μL 与Marker 7.5 μL 混 合,于3% 琼脂糖凝胶中,以100 mV 电压电泳 45 min,并在凝胶成像系统中拍照分析。将剩余的 PCR 产物原液送华大基因,纯化后进行直接测序。 1.4 化疗后不良反应指标检测
HD-MTX 化疗前后及化疗过程中监测患儿生 命体征及实验室检查结果(每2~3 d 测一次血常规、 肝功能、电解质和肾功能),观察记录临床症状。 HD-MTX 化疗开始后42~48 h 采集患儿外周静脉血 2 mL,立即送本院临床药学研究所,行MTX 血药 浓度监测。
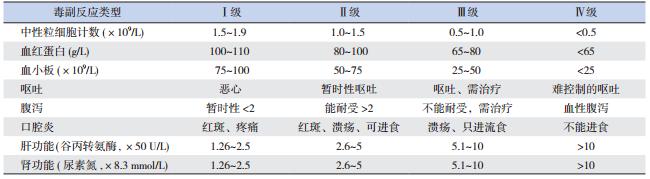
记录患儿行HD-MTX 化疗过程中出现的不良 反应,根据美国国立癌症研究所常规毒性判定标 准(NCI-CTC)评价不良反应[3]。评价观察的指标 有:骨髓抑制(表现为外周血中性粒细胞减少、 血红蛋白和血小板降低);肝脏毒性(表现为谷 丙转氨酶升高);肾脏毒性(表现为尿素氮升高); 胃肠道反应(表现为呕吐、腹泻);黏膜损害(表 现为口腔炎)。分级≥Ⅱ级被认为是临床相关的 化疗毒副反应。见表 1。
| 表 1 美国国立癌症研究所常规毒性判定标准 |
应用SPSS 13.0 统计软件包对数据进行统计学 分析。计数资料以百分率(%)表示,组间比较采 用校正χ2 检验或Fisher 确切概率法,p<0.05 为差 异有统计学意义。 2 结果 2.1 不同危险度分型患儿TS 基因型分布
TS 基因检测结果显示,73 例患儿中,2R/2R 型3 例(4%),2R/3R 型 12 例(16%),3R/3R 型 58 例(79%)。不同危险度分型ALL 患儿基因型分 布频率比较差异无统计学意义(p>0.05),见表 2。
| 表 2 不同危险度分型ALL 患儿TS 基因型分布比较 [例(%)] |
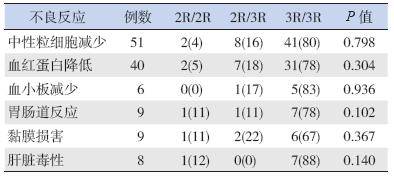
73 例ALL 患儿接受HD-MTX 化疗后,发生中 性粒细胞减少、血红蛋白降低和血小板减少分别 为51 例(70%)、40 例(55%)和6 例(8%); 发生肝脏毒性、黏膜损害和胃肠道反应者分别为 8 例(11%)、9 例(12%) 和9 例(12%); 无 1 例发生肾脏毒性。见表 3。
| 表 3 73 例ALL 患儿化疗后不良反应发生情况 [例(%)] |
结果显示,不同TS 基因型ALL 患儿化疗后 不良反应发生率比较差异均无统计学意义(均 p>0.05),见表 4。
| 表 4 不同TS 基因型ALL 患儿化疗后不良反应发生率比较 [例(%)] |
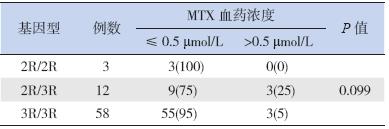
ALL 患儿化疗后42~48 h MTX 血药浓度监测 结果提示:2R/2R 型、2R/3R 和3R/3R 型ALL 患 儿化疗后42~48 h MTX>0.5 μmol/L 分别有0 例、 3 例和3 例,说明TS 基因多态性与MTX 化疗后血 药浓度的变化无关联(p>0.05),见表 5。
| 表 5 TS 基因型与MTX 血药浓度之间的关系 [例(%)] |
尽管目前对ALL 的治疗已取得了很大进展, 但MTX 目前仍是治疗ALL 最重要的药物之一。 MTX 为叶酸类似物,主要借助于还原叶酸载体的 转运进入细胞,MTX 和二氢叶酸竞争,与二氢叶 酸还原酶(DHFR)结合,从而使二氢叶酸不能被还原成四氢叶酸,同时进入细胞的MTX 在甲氨 蝶呤聚谷氨酸合成酶(FPGS)的催化作用下,在 MTX 的γ- 羧基位上加上约7~10 个谷氨酸残基, 形成MTX 多聚谷氨酸(MTXPG),多聚谷氨酸 化可增强MTX 的作用,抑制TS 和甲酰基转移酶 (GARTFase),并由于快速出胞被阻断使MTX 胞 内滞留时间延长。因缺乏四氢叶酸,一碳单位形 成减少,DNA、RNA 合成受限,快速增生的肿瘤 细胞如淋巴母细胞因缺乏复制所需的原料而逐渐 死亡。HD-MTX 是ALL 髓外白血病防治的重要措施, 其机制是在HD-MTX 治疗时,MTX 血药浓度很高, 可顺利通过血脑屏障进入中枢神经系统(CNS), 同时三联鞘注,从而有效地杀灭隐蔽在CNS 的白 血病细胞,减少复发[4]。
TS 是胸腺嘧啶脱氧核苷(dTMP)合成过程中 的限速酶,其功能是以5,10- 亚甲基四氢叶酸为原 料,催化尿嘧啶脱氧核苷(dUMP)甲基化为胸腺 嘧啶脱氧核苷(dTMP),而 dTMP 又是DNA 生物 合成所必需的。因此,通过对 TS 进行抑制就能达 到抑制DNA 的生物合成进而抑制细胞生长或增殖 的作用。TS 在 DNA 合成与修复、细胞增殖与分化 中有十分重要的作用,是肿瘤化疗药 5- 氟尿嘧啶 (5-Fu)和MTX 等的重要靶酶。
本研究发现TS 各基因型与HD-MTX 化疗后不 良反应的发生无明显相关,与Kishi 等[5] 的研究结 果一致。然而,Faganel 等[6] 研究显示,ALL 患儿 进行HD-MTX 化疗后,TS 2R/3R 基因型携带者的 血小板减少和黏膜炎发生风险明显下降。同时一 项成人研究表明,TS 3R/3R 基因型可增加ALL 化 疗后贫血的危险性[7]。
本研究未发现TS 基因多态性与MTX 血药浓 度之间存在关联。此外,HD-MTX 化疗相关不良 反应还可能与其他叶酸代谢途径相关基因多态性 存在相关性[6, 8]。
综上所述,TS 基因多态性与ALL 患儿HDMTX 化疗后不良反应的发生风险无关,并未达到 预期研究目的,需要综合其他叶酸代谢相关酶的 基因多态性以及协同作用、体内叶酸水平、同时 服用的化疗药物及扩大样本量来进一步求证。
| [1] | 中华医学会儿科学分会血液学组, 中华儿科杂志编辑委员 会. 儿童急性淋巴细胞白血病诊疗建议(第三次修订草案)[J]. 中华儿科杂志, 2006, 44(5): 392-395. |
| [2] | Horie N, Aiba H, Oguro K, et al. Functional analysis and DNA polymorphism of the tandemly repeated sequences in the 5'-terminal regulatory region of the human gene for thymidylate synthase[J]. Cell Struct Funct, 1995, 20(3): 191-197. |
| [3] | Basch E, Iasonos A, McDonough T, et al. Patient versus clinician symptom reporting using the National Cancer Institute Common Terminology Criteria for Adverse Events: results of a questionnaire-based study[J]. Lancet Oncol, 2006, 7(11): 903-909. |
| [4] | 万伍卿. 儿童急性淋巴细胞白血病髓外白血病预防研究进展[J]. 实用儿科临床杂志, 2011, 26(15): 1158-1160. |
| [5] | Kishi S, Cheng C, French D, et al. Ancestry and pharmacogenetics of antile-ukemic drug toxicity[J]. Blood, 2007, 109(10): 4151-4157. |
| [6] | Faganel Kotnik B, Grabnar I, Bohanec Grabar P, et al. Association of genetic polymorphism in the folate metabolic pathway with methotrexate pharmacokinetics and toxicity in childhood acute lymphoblastic leukaemia and malignant lymphoma[J]. Eur J Clin Pharmacol, 2011, 67(10): 993-1006. |
| [7] | Alessia O, Monica De M, Matteo Giovanni Della P, et al. Gene polymorphisms in folate metabolizing enzymes in adult acute lymphoblastic leukemia: effects on methotrexate-related toxicity and survival[J]. Haematologica, 2009, 94(10): 1391-1398. |
| [8] | Chen X, Wen F, Yue L, et al. Genetic polymorphism of γ-glutamyl hydrolase in Chinese acute leukemia children and identification of a novel double nonsynony-mous mutation[J]. Pediatr Hematol Oncol, 2012, 29(4): 303-312. |
 2015, Vol. 17
2015, Vol. 17