噬血细胞综合征(hemophagocytic syndrome,HPS)是一种多器官、多系统受累,并进行性加重伴免疫功能紊乱的巨噬细胞增生性疾病,该病起病急、病情进展迅速、病死率高。目前,多数HPS 患者发病原因尚不完全明确,病毒感染在其发病中的作用是研究方向之一。有研究认为,人微小病毒 B19(human parvovirus B19,HPVB19)与HPS 关系密切[1,2],但国内少有报道,本研究采用酶联免疫吸附试验(ELISA)和荧光定量PCR 法对HPS 患儿和健康儿童的外周静脉血血清标本进行HPVB19-IgM、IgG 和HPVB19-DNA 检测,探讨HPS 患儿与HPVB19 感染的关系及临床特征。1 资料与方法1.1 研究对象
选取2013 年4 月至2014 年4 月于郑州大学第一附属医院收治入院的初诊为HPS 的65 例患儿为研究对象,其中男39 例,女26 例,年龄6个月至14 岁,中位年龄5.7 岁,首发疾病诊断符合2004-HLH 诊断指南[3] 及2009 年美国血液年会提出的修订指南[4],初诊病程 5~46 d,所有HPS 患儿均无其他家族遗传性疾病,且临床资料完整;同期选取在郑州大学第一附属医院行健康体检的儿童65 例为对照组,其中男34 例,女31 例,年龄3 个月至13 岁,中位年龄5.5 岁,两组儿童在性别、年龄、生活地区分布等方面比较差异均无统计学意义(均P>0.05)。1.2 HPVB19 感染的诊断标准
临床有HPVB19 感染相关的症状,并同时符合下列条件之一:(1) 特异性HPVB19-IgM 抗体阳性,并HPVB19-DNA 阳性;(2) 特异性HPVB19-IgG 由阴性转阳性或效价升高≥ 4 倍;(3)定量PCR 检测HPVB19-DNA 阳性,并达到>104 IU/mL(6.5×103 基因量/mL)或逐渐上升;(4)骨髓或其他组织中B19 病毒抗原阳性或检测出病毒颗粒。1.3 标本采集
两组均于首次就诊时采集外周静脉血2 mL于普通干燥管中,3 400 r/min 离心8 min,留取血清,-20℃保存,待用于ELISA 检测;另用EDTA抗凝管采集外周静脉血2 mL,分离白细胞并固定于载玻片上,低温保存,待用于荧光定量PCR 检测。1.4 ELISA 法检测血清HPVB19-IgM和IgG抗体
HPVB19-IgM 和IgG ELISA 检测试剂盒分别购自德国Virion 和Serion 公司。操作步骤如下:待测血清1 : 100 稀释,标准对照和阳性对照1 : 10稀释;在相应孔中分别加入100 μL 标准对照、阳性对照和待测血清样品;37℃孵育60 min;倒出孔中液体,每孔加入200 μL 稀释的洗涤液,重复洗涤3 次;每孔中加入100 μL 稀释的结合抗原;37℃孵育60 min;重复洗涤3 次;在每孔中加入100 μL 底物液;20~25 ℃暗室中孵育10 min;在每孔中加入100 μL 终止液;30 min 内在微孔读数器(B10-RAD Microplate Reader)中读出450 nm 处的OD 值。结果判定以标准对照B 的OD 值为标准:>1.2 为阳性,<0.8 为阴性,0.8~1.2 为可疑阳性。1.5 实时荧光定量PCR 法检测HPVB19-DNA
取样本200 μL,采用广州达安公司提取试剂盒提取并纯化样本中的B19 DNA,提取过程在罗氏MagNA Pure LC 2.0 核酸提取仪上完成,操作严格按照说明书进行。从NCBI 上下载HPVB19 核苷酸序列,由上海生工生物工程公司设计并合成引物和探针: 上游引物5'-GGGCCAATTGGAGGTATTAAATC-3',下游引物5'-CCACCGTCCTGTAGCTTTACG-3',片段长度为117 bp;探针5'-Fam-TACTACCTTAGTTCAGTATGCTGTG-BHQ1-3'。实时荧光定量PCR 检测试剂盒购自广州中山大学达安基因股份有限公司,实验过程在ABI Prism 7500 荧光定量PCR 仪上进行。反应体系为60 μL,包括模板20 μL,热启动Taq酶0.4 μL,尿DNA 糖基化酶(UNG)0.5 μL,1×PCR 缓冲液5 μL,上下游引物各2.5 μL,探针0.5 μL,200 μmol/L dNTP 4 μL,5.0 mmol/LMgCl2 5 μL,灭菌蒸馏水补足体积至60 μL。反应条件为:37 ℃ UNG 反应2 min;50 ℃ UNG 灭活5 min;94℃预变性10 min;94℃变性10 s,55℃退火35 s,65℃延伸35 s,共45 个循环;荧光信号层设定为FAM 荧光素,荧光信号采集设定在最后一步的65 ℃。PCR 结果判定:DNA 总含量<104 IU/mL(6.5×103 基因量/mL) 为阴性,DNA总含量>104 IU/mL 为阳性。1.6 统计学分析
应用SPSS 17.0 统计学软件对数据进行统计学分析,计数资料用率(%)表示,两组样本率之间的比较采用Χ2 检验;当n ≥ 40,1 ≤理论频数<5 时,采用校正Χ2 检验,P<0.05 为差异有统计学意义。2 结果2.1 HPVB19-IgM 和HPVB19-IgG 检测结果
65 例HPS 患儿中,分别检测出17 例HPVB19-IgM 和25 例HPVB19-IgG 阳性患儿,阳性率分别为26% 和38%;对照组65 例儿童中,分别检测出6 例HPVB19-IgM 和19 例HPVB19-IgG 阳性者,阳性率分别为9% 和29%,两组HPVB19-IgM 阳性率比较差异有统计学意义(Χ2=6.392,P=0.011),而HPVB19-IgG 阳性率在两组间差异无统计学意义(Χ2=1.237,P=0.266)。
65 例HPS 患儿中,同时检测出HPVB19-IgM 和IgG 均阳性者7 例(11%),HPVB19 总阳性率为54%(35/65);对照组65 例儿童中,无HPVB19-IgM 和IgG 同时阳性者,HPVB19 总阳性率为38%(25/65),两组总阳性率比较差异无统计学意义(Χ2=3.095,P=0.079)。2.2 HPVB19-DNA 检测结果
65 例HPS 患儿中,检测出HPVB19-DNA 阳性14 例,感染率为22%,其中HPVB19-IgM 阳性13 例,阴性1 例;对照组65 例儿童中,检测出HPVB19-DNA 阳性2 例,感染率为3%,且均为HPVB19-IgM 阳性,两组HPVB19 感染率比较差异有统计学意义(Χ2=10.263,P=0.001)。2.3 不同检测结果HPS 患儿的临床特征分析
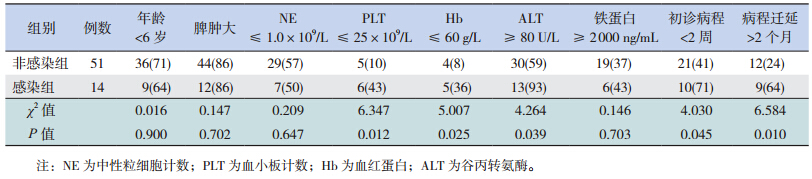
根据HPVB19-DNA 的检测结果将HPS 患儿分为感染组和非感染组,与非感染组患儿比较,感染组患儿起病更急,血小板计数及血红蛋白含量明显下降,更易出现肝功能损伤,病程迁延时间更长(均P<0.05),而在年龄、脾肿大、中性粒细胞计数及血清铁蛋白水平等方面比较差异均无统计学意义(均P>0.05),见表 1。
| 表1 不同检测结果 HPS 患儿的临床特征比较 [例(%)] |
HPVB19 是在编号为B19 的献血者血清标本中偶然发现的直径为20~25 nm 的球形颗粒样病毒,由一线状单链DNA 和衣壳构成,我国于1990 年首次在西安应用病毒血清学方法证实国内存在此种病毒感染。近几年的研究发现,HPVB19 感染的疾病谱在不断扩大,其致病性日益引起重视,现已证明儿童感染B19 病毒可导致多种疾病,如传染性红斑(IE)、一过性再障危象、纯红细胞再生障碍性贫血[5]、特发性血小板减少性紫癜(ITP)[6]、关节炎[7]、过敏性紫癜[8](HSP)、粒细胞减少症、心肌炎[9]、支气管炎、川崎病、单纯性红细胞发育不良等[10],如果妊娠期受B19 病毒感染,可致胎儿宫内死亡流产,或胎儿水肿贫血[11]。现在国内外对HPVB19 是否是某些疾病的直接病原体还是特定疾病患者可以成为HPVB19 易感人群尚未肯定。
HPS 发病原因多样,起病急,病情进展迅速,死亡率高,需要及时行临床干预治疗。HPS 根据不同病因分为两种类型:原发性HPS 和继发性HPS。继发性HPS 主要继发于感染、肿瘤、药物、结缔组织疾病等,尤其是病毒感染,其中EB 病毒(EBV)、巨细胞病毒(CMV)、疱疹类病毒、肠道病毒、腺病毒等最多见[12,13,14,15],原发性HPS 可因感染而诱发。随着研究的深入,一些新的感染因素逐渐被大家认识,近年研究表明,HPVB19 感染与 HPS 密切相关[1,2,14]。
当前,确诊HPVB19 感染的方法有血清学、组织学和分子生物学检测,以ELISA 方法应用最广泛。HPVB19 特异性IgM 抗体阳性表示近期感染或急性感染,免疫功能正常的个体在感染HPVB19后10~12 d 即产生特异性IgM 抗体,持续5 个月左右;特异性IgG 抗体通常在感染后15 d 产生,持续数月甚至终生,IgG 阳性表示既往感染,但其阳转或效价升高,是急性感染的指标。本研究结果提示:HPS 组患儿中HPVB19-IgM 阳性率为26%,显著高于正常对照组(9%),说明本组至少26% 存在急性 HPVB19 感染,提示我国HPS患儿有较高的HPVB19 感染率,HPVB19 感染与HPS 发病可能具有相关性。HPS 组和正常对照组中HPVB19-IgG 阳性率分别为38% 和29%,阳性率比较无明显差异。本研究中正常对照组HPVB19检测阳性率高于国内其他学者研究结果[16],一方面说明我国儿童中HPVB19 病毒感染率可能在逐年增高,另一方面可能与检测方法及受检测患儿合并有其他隐匿性感染有关。
考虑到某些免疫缺陷或抑制者,有时缺乏可检测到的特异性抗体反应,一般情况下,若仅依据IgM 和IgG 检测结果,诊断B19 感染的结论尚有一定的局限性,因此对于B19 病毒感染诊断最好行PCR 检测。故本研究采用荧光定量PCR 方法进一步行HPVB19-DNA 检测,结果显示:HPS组检测出HPVB19-DNA 阳性14 例,HPVB19-IgM和HPVB19-DNA 均阳性13 例,HPVB19-IgM 阴性患儿中HPVB19-DNA 阳性1 例,根据HPVB19 感染的诊断标准,感染率为22%;明显高于对照组HPVB19 的感染率(3%)。进一步分析HPS 患儿的临床特征显示,14 例HPVB19 感染组患儿中,初诊病程<2 周者占71%,PLT ≤ 25×109/L 者占43%,Hb ≤ 60 g/L 者占36%,ALT ≥ 80 U/L占93%,病程迁延时间>2 个月者占64%,较HPVB19 非感染组患儿有明显差异,提示HPVB19感染引起的HPS 起病较急,临床表现较重,血小板和血红蛋白减低尤为突出,且较易出现肝功能损伤,病程迁延时间更长,而在年龄、脾肿大、中性粒细胞计数及血清铁蛋白水平等方面无明显差异。HPVB19 感染的临床表现多样,但是迄今为止,HPVB19 感染引起HPS 的作用机制尚未完全明了,De Maria 等[17] 认为,受感染的红细胞成为吞噬细胞的靶细胞,可能是本病发生的机理之一;另一机理可能为干扰素-γ 及肿瘤坏死因子-α 等细胞因子损害吞噬细胞系统的调控功能,导致全血细胞减少。总之,有关HPVB19 感染引起HPS患者各种临床表现的机制有待进一步研究。
综上所述,HPVB19 在HPS 患儿中有较高的感染率,HPVB19 感染与HPS 发病可能具有相关性,HPVB19 可能加重HPS 的某些临床症状,本课题组将用进一步前瞻性的研究方法来揭示其因果关系。本实验结果提示HPVB19 协同其他感染因素可能加快HPS 起病时间,并加重其血液系统及肝功能的损害,该结果仍需更多的实验证实。观察临床特征显示,HPVB19 感染诱发的HPS 起病更急,血小板及血红蛋白减低更明显,且更易出现肝功能损伤,病情迁延时间相对较长,对此,本课题组将对HPVB19 感染相关性HPS 患儿进行随访,并扩大样本量,进一步分析其预后,以明确HPVB19 感染与HPS 的发病关系、临床特征及其预后。
对儿科常见疾病患儿尤其HPS 患儿及早筛查HPVB19,甚至将HPVB19 检测列为常规检测项目之一,对病因分析以及避免交叉感染有重要临床意义。目前,HPVB19 感染相关性HPS 尚无特异性治疗方法,加强抗病毒治疗及应用丙种球蛋白提高机体免疫力有利于提高临床治疗效果,并有助于预防并发相关HPVB19 感染的其它疾病。
| [1] | Tavera M, Petroni J, León L, et al. Reactive haemophagocytic syndrome associated with parvovirus B19 in a kidney-pancreas transplant patient[J]. Nefrologia, 2012, 32(1): 125-126. |
| [2] | Sood N, Yadav P. Hemophagocytic syndrome associated with concomitant Klebsiella and Parvovirus B-19 infection[J]. Indian J Pathol Microbiol, 2012, 55(1): 124-125. |
| [3] | Henter J, Horne A, Arico M, et al. HLH-2004: Diagnostic and therapeutic guidelines for hemophagocytic lymphohistiocytosis[J]. Pediatr Blood Cancer, 2007, 48(2): 124-131. |
| [4] | Filipovich AH. Hemophagocytic lymphohistiocytosis(HLH) and related disorders[J]. Hematology Am Soc Hematol Educ Program, 2009: 127-131. |
| [5] | Gupta V, Saini I, Nath G, et al. Prevalence of parvovirus B 19 infection in children with aplastic anemia[J]. Indian Pediatr, 2013, 50(5): 489-491. |
| [6] | 张耀东, 胡群, 刘双又, 等. 人微小病毒B19感染与儿童特发性血小板减少性紫癜关系的meta分析[J]. 中国当代儿科杂志, 2009, 11(12): 999-1001. |
| [7] | Carreño Má, Wainstein E, Abumohor P. Parvovirus B19 arthritis: Report of three cases[J]. Rev Med Chil, 2012, 140(11): 1453-1456. |
| [8] | Alonso-Ojembarrena A, Alvarez-Coca J, Pérez-García MJ, et al. Henoch-Schönlein purpura due to parvovirus B19[J]. An Pediatr(Barc), 2006, 65(6): 641-642. |
| [9] | Molina KM, Garcia X, Denfield SW, et al. Parvovirus B19 myocarditis causes significant morbidity and mortality in children[J]. Pediatr Cardiol, 2013, 34(2): 390-397. |
| [10] | Mihály I, Trethon A, Arányi Z, et al. Observations on human parvovirus B19 infection diagnosed in 2011[J]. Orv Hetil, 2012 Dec, 153(49): 1948-1957. |
| [11] | Abiodun I, Opaleye OO, Ojurongbe O, et al. Seroprevalence of parvovirus B19 IgG and IgM antibodies among pregnant women in Oyo State, Nigeria[J]. J Infect Dev Ctries, 2013, 7(12): 946- 950. |
| [12] | 张景荣, 梁筱灵, 靳蓉, 等. HLH-2004方案诊治儿童噬血细胞综合征临床分析[J]. 中国当代儿科杂志, 2013, 15(8): 686- 688. |
| [13] | Canak G. Viral infection and hemophagocytic lymphohistiocytosis[J]. Med Pregl, 2013, 66(11-12): 448-451. |
| [14] | Goudarzipour K, Kajiyazdi M, Mahdaviyani A, et al. Epsteinbarr virus-induced hemophagocytic lymphohistiocytosis[J]. Int J Hematol Oncol Stem Cell Res, 2013, 7(1): 42-45. |
| [15] | Hodnut FÖ, Ozcay F, Malbora B, et al. Severe adenovirus infection associated with hemophagocytic lymphohistiocytosis[J]. Turk J Haematol, 2014, 31(1): 103-105. |
| [16] | 张国成. 儿童微小病毒B19感染的诊断与治疗[J]. 临床儿科杂志, 2008, 26(6): 459-463. |
| [17] | De Maria A, Zolezzi A, Passalacqua G, et al. Melkersson- Rosenthal syndrome associated with parvovirus B19 viraemia and haemophagocytic lymphohistiocytosis[J]. Clin Exp Dermatol, 2009, 34(8): e623-e625. |
 2015, Vol. 17
2015, Vol. 17