川崎病(Kawasaki disease,KD)是一种非特异性全身性血管炎症,其最严重的并发症是合并冠状动脉损伤(CAL),目前病因及发病机制尚未明了。脂联素是脂肪细胞分泌的脂肪因子,研究发现血清脂联素水平与胰岛素抵抗、代谢综合征、糖尿病、心血管病、癌症等疾病的发生呈负相关,具有调节脂质及葡萄糖代谢、抗炎、心血管保护作用、抗细胞凋亡等多种生物学效应。有研究发现KD急性期患儿血清脂联素水平降低[1],但是血清脂联素水平的变化与 KD患儿CAL 之间是否相关尚不清楚。本研究通过检测不同时期KD患儿血清脂联素水平,并作相关因素分析,以探讨脂联素与KD及合并CAL 的关系。1 资料与方法1.1 研究对象
选择2011年10月至 2013 年7 月在我院住院及门诊随访的KD患儿45 例,其中男30例,女15 例,年龄2个月至6 岁,平均 1.9±1.5岁,其中1 岁以下13 例(29%),l~3 岁15 例(33%),>3 岁17 例(38%)。均符合2002 年日本KD研究委员会修订的第5 版诊断标准[2],并排除其他疾病;均按《实用儿科学》进行临床分期,即急性期、亚急性期、恢复期[3];所有患儿行心脏超声心动图检查,按《实用儿科学》冠状动脉受累程度分级分期标准[3] 分为CAL 组(18例,均为轻度冠状动脉扩张)和冠状动脉正常组(NCAL,27例)。
所有患儿于发病10 d 内给予静脉注射丙种球蛋白(IVIG,1~2 g/kg);并予阿司匹林口服,剂量为30~50mg/(kg · d),分3 次口服,热退2 周左右减量至3~5 mg/(kg · d),维持6~8 周,如有冠状动脉病变,用药至冠状动脉恢复正常后1 个月。同时间段在我院门诊体检的健康儿童20 例为正常对照组,其中男 14 例,女6 例,年龄4 个月至 6岁,平均 2.0±1.3 岁。CAL 组、NCAL 组及对照组3 组间年龄(F=0.537,P=0.958)、性别(Χ2=0.07,P=0.965)差异无统计学意义。1.2 血清脂联素浓度的检测
KD组分别于急性期(发热10 d 内)、治疗后亚急性期(发热11~21 d)及恢复期(发热21~30 d)清晨空腹采血2 mL 于干燥管内,离心后收集血清,采用ELISA 法检测血浆脂联素浓度,试剂盒由美国R&D 公司提供,检测仪器为西门子公司BEP Ⅲ全自动酶免分析仪;美国Beckman 公司全自动生化分析仪检测血清总胆固醇(TC)、甘油三酯(TG)、高密度脂蛋白(HDL)、低密度脂蛋白(LDL)。健康对照组儿童于清晨空腹采血检测脂联素水平,方法同前。 1.3 一般血液学指标的检测
KD组治疗前取静脉血3 mL,其中1 mL 加入EDTA-Na2 抗凝管,充分摇匀,美国Beckman 公司全自动血液分析仪检测血小板(PLT)和C- 反应蛋白(CRP);剩余2 mL 加入肝素钠抗凝管,采用魏氏法检测红细胞沉降率(ESR)。1.4 心脏彩色超声检查
采用西门子ACUSON SC2000 型彩色超声诊断仪进行检测,高频巨阵探头。检查时保持环境安静,光线适中。受试儿童安静平卧,由超声专业医师进行检测,根据冠状动脉内径进行分组。1.5 统计学分析
采用SPSS 13.0 统计软件进行统计学处理。正态分布的计量数据用均数± 标准差(x±s)表示,组间比较采用单因素方差分析,两两比较用LSD检验。计数资料组间比较采用R×C Χ2 检验;相关性分析采用Pearson 相关分析或Spearman 相关分析。P<0.05 为差异有统计学意义。2 结果2.1 KD患儿在不同时期血清脂联素水平
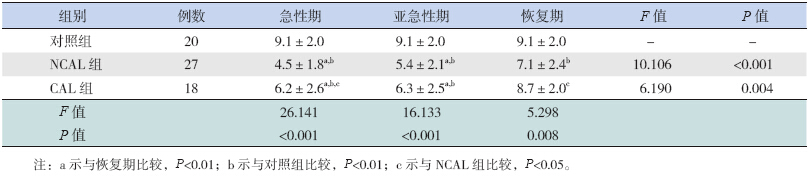
KD患儿血清脂联素水平由急性期、亚急性期至恢复期逐渐升高,但均低于正常对照组。其中CAL 组急性期与亚急性期脂联素水平低于恢复期和正常对照组(P<0.001),而急性期与亚急性期之间及恢复期与正常对照组之间脂联素水平比较差异均无统计学意义(分别P=0.914、0.592)。NCAL 组急性期与亚急性期之间脂联素水平比较差异无统计学意义(P=0.122),但均低于恢复期(P<0.001),且3 个时期脂联素水平均低于正常对照组(P<0.001)。见表 1。
| 表1 组间血清脂联素水平的比较(μg/mL,x±s) |
NCAL 组在急性期、亚急性期和恢复期的血清脂联素水平均较CAL 组低,其中在急性期与恢复期差异有统计学意义(分别P=0.011、0.022),见表 1。
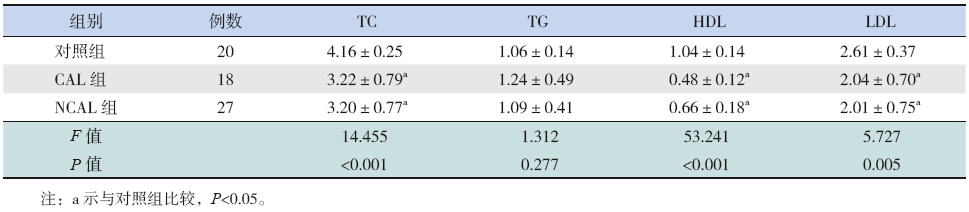
| 表2 组间血脂4项的比较(mmol/L,x±s) |
NCAL 组和CAL 组血清TC、HDL、LDL 均较正常对照组降低(P<0.05);NCAL 组和CAL 组血清TC、TG、HDL、LDL 比较差异无统计学意义(P>0.05);3 组间血清TG 比较差异无统计学意义(P>0.05)。2.4 急性期血清脂联素与其他指标的相关性
血清脂联素与血清TC、TG、CRP 水平及CAL的发生呈正相关,r 分别为0.31、0.30、0.34、0.35,P 分别为0.03、0.04、0.03、0.02;而与HDL、LDL、PLT、ESR、年龄、性别无相关性,r分别为0.07、0.23、-0.05、-0.01、0.06、0.11,P 分别为0.62、0.12、0.79、0.93、0.70、0.48。 3 讨论
KD由日本学者Tomisaku Kawasaki 1976 年首次报道以来,至今病因及发病机制未明。从1995年Scherer 等[4] 首次在小鼠体内克隆出脂联素以来,脂联素的抗炎、心血管保护作用逐渐被人们认识。但是,脂联素是否参与人类KD的发病过程,目前还不是很清楚。本研究发现,在KD患儿急性期至恢复期,相比健康儿童,脂联素水平都明显降低,未合并CAL 者降低更明显。提示血清脂联素水平变化可能参与了KD全身炎症反应及CAL 的发生,脂联素或许可以作为KD等全身免疫炎症反应疾病的预测因子,对于早期鉴别诊断及治疗具有重要临床意义。
日本学者首先观察到,KD急性期脂联素水平较恢复期明显降低[1],本研究动态观察KD患儿急性期、亚急性期、恢复期脂联素水平,结果发现,在急性期与亚急性期间比较无差异,但均较恢复期明显降低。可能由于处于疾病早期阶段,脂联素的差别尚未完全显现出来,在疾病后期逐渐明显。合并CAL 者与未合并CAL 者之间血清脂联素水平的差异,主要表现在急性期、恢复期,而亚急性期两者比较无差异,考虑可能是由于亚急性期KD病程较短所致。在本研究中,恢复期定义为发病2 个月内,血清脂联素水平在KD患儿后期水平如何,需延长观察时间,多个时间段采血进一步研究。
目前有关报道KD患儿脂联素水平的研究尚少,本研究中KD患儿血清脂联素水平较对照组明显降低,具体机制考虑可能与以下方面有关:(1)急性期KD患儿CAL 发生时肿瘤坏死因子-α(TNF-α)、白介素-6 等促炎症因子显著增高[5],Simons 等[6] 发现TNF-α、IL-6 可抑制体外培养的人脂肪细胞总脂联素的释放;(2)脂联素为过氧化物酶体增殖物激活受体-γ(PPARγ)的靶基因[7],有研究显示,PLT 在 KD急性期增高[8] ,高PLT 水平抑制PPAR-γ mRNA 表达水平[9],高PLT水平可间接降低血清脂联素水平;(3)KD存在明显的血脂代谢紊乱[10],高脂血症可抑制脂联素分泌[11];(4)脂联素某些位点的基因突变可影响脂联素水平,研究发现11377 C/G 的G 等位基因降低血浆脂联素水平[12]。
本研究发现未合并CAL 的KD患儿较合并CAL 者血清脂联素水平降低更明显,考虑KD患儿发生CAL 时血清脂联素水平增高,可能与脂联素的血管保护作用有关。有研究显示血管周围脂肪组织在血管内膜损伤后分泌脂联素,通过脂联素的抗炎活性对内膜形成一定的保护作用[13,14]。脂联素与不同血管内皮细胞上脂联素受体1 结合,促进内皮型一氧化氮合酶(eNOS)及一氧化氮(NO)释放,脂联素通过NO 中介物,对血管产生活性调节作用[15];在KD急性期合并CAl 患儿新生血管的内皮细胞、白细胞、成纤维细胞局部都有血管细胞粘附分子(VCAM-1)的表达[16],而脂联素可明显抑制VCAM-1 的表达和炎性细胞向血管壁迁移过程,产生应激保护作用[17]。本研究中,患儿CAL 均为轻度损伤,血清脂联素水平与冠状动脉损伤程度的相关性研究有待进一步开展。
研究显示脂联素与血脂代谢密切相关。Mantzoros 等 [18] 对女性 2 型糖尿病患者进行研究发现,血循环中脂联素的浓度与血脂含量密切相关。Yamauchi 等[19] 研究表明脂联素主要通过促进肌肉对脂肪酸摄取及代谢,降低肌肉、肝脏、循环中游离脂肪酸(FFA)与TG 浓度,以解除高脂血症所引起的血管内皮损伤。本研究中血清脂联素与血清TC、TG 呈正相关,表明在KD患儿中脂联素与血脂代谢关系紧密。目前对KD患儿血脂代谢异常的报道较少。张园海等[20] 认为KD患儿出现血脂代谢异常可能与生化代谢、炎症因子、胃肠损伤等多种因素有关。本研究结果显示:KD患儿血清TC、HDL、LDL 水平均较正常对照组降低,提示KD患儿中存在血脂代谢紊乱,但合并与未合并CAL 组血清TC、TG、HDL、LDL 比较无差异,需大样本进一步研究。
有关KD冠状动脉病变目前公认的炎症指标有: 外周血白细胞计数、CRP、ESR 等[21]。Ashouri 等[22] 研究显示,CRP 是冠状动脉瘤发生的独立危险因素,且CRP 升高的水平与冠状动脉病变的程度呈正相关[23],Ouchi 等发现[24],在成人冠心病患者中,脂联素水平与CRP 密切相关,同时脂联素可抑制CRP 的产生与表达。有关研究也显示血清CRP 的明显升高对提示KD患者发生CAL 有一定的临床意义[25]。本研究发现,血清脂联素与CRP 水平及CAL 的发生呈正相关,提示在KD患儿中,血清脂联素水平与KD患儿发生CAL关系密切。但也有研究发现,在KD患儿中,CAL的发生与血清脂联素水平不相关[26]。
综上所述,KD患儿存在血脂紊乱及低脂联素水平,血清脂联素水平降低可能是全身炎症反应的结果;KD患儿中的血清脂联素水平增高与CAL关系密切。今后有必要开展多中心、大样本研究,以获得更有说服力的结果。另外,脂联素在KD中出现明显变化的原因也需进一步深入研究。
| [1] | Takeshita S, Takabayashi H, Yoshida N. Circulating adiponectin levels in Kawasaki disease[J]. Acta Paediatr, 2006, 95(10): 1312-1314. |
| [2] | Ayusawa M, Sonobe T, Uemura S, et al. Revision of diagnostic guidelines for Kawasaki disease (the 5th revised edition)[J]. Pediatr Int, 2005, 47(2): 232-234. |
| [3] | 胡亚美, 江载芳. 诸福棠实用儿科学[M]. 北京: 人民卫生出版社, 2002: 698-705. |
| [4] | Scherer PE, Williams S, Fogliano M, et al. A novel serum protein similar to C1q, produced exclusively in adipocytes[J]. J Biol Chem, 1995, 270(45): 26746-26749. |
| [5] | Furukawa S, Matsubara T, Ichiyama T. Regulation of proinflammatory cytokine cascade in Kawasaki disease[J]. Nihon Rinsho, 2008, 66(2): 258-264. |
| [6] | Simons PJ, van den Pangaart PS, Aerts JM, et al. Proinflammatory delipidizing cytokines reduce adiponectin secretion from human adipocytes without affecting adiponectin oligomerization[J]. J Endocrinol, 2007, 192: 289-299. |
| [7] | Iwaki M, Matsuda M, Maeda N, et al. Induction of adiponectin, a fat-derived antidiabetic and antiatherogenic factor, by nuclear receptors[J]. Diabetes, 2003, 52(7): 1655-1663. |
| [8] | Ruan Y, Ye B, Zhao X. Clinical characteristics of Kawasaki syndrome and the risk factors for coronary artery lesions in China[J]. Pediatr Infect Dis J, 2013, 32(10): e397-e402. |
| [9] | Akbiyik F, Ray DM, Gettings KF, et al. Human bone marrow megakaryocytes and platelets express PPARgamma, and PPARgamma agonists blunt platelet release of CD40 ligand and thromboxanes[J]. Blood, 2004, 104(5): 1361-1368. |
| [10] | Cabana VG, Gidding SS, Getz GS, et al. Serum amyloid A and high density lipoprotein participate in the acute phase response of Kawasaki disease[J]. Pediatr Res, 1997, 42(5): 651-655. |
| [11] | Naderali EK, Estadella D, Rocha M, et al. A fat-enriched, glucose-enriched diet markedly attenuates adiponectin mRNA levels in rat epididymal adipose tissue[J]. Clin Sci(Lond), 2003, 105(4): 403-408. |
| [12] | Suriyaprom K, Phonrat B, Namjuntra P, et a1. The-11377> G adiponectin gene polymorphism alters the adiponectin concentration and the susceptibility to type 2 diabetes in Thais[J]. Int J Vitam Nutr R, 2010, 80(3): 216-224. |
| [13] | Takaoka M, Suzuki H, Shioda S, et al. Endovascular injury induces rapid phenotypic changes in perivascular adipose tissue[J]. Arterioscler Thromb Vasc Biol, 2010, 30(8): 1576- 1582. |
| [14] | Aghamohammadzadeh R, Withers S, Lynch F, et al. Perivascular adipose tissue from human systemic and coronary vessels: the emergence of a new pharmacotherapeutic target[J]. Br J Pharmacol, 2012, 165(3): 670-682. |
| [15] | Yu X, Hirono KI, Ichida F, et al. Enhanced iNOS expression in leukocytes and circulating endothelial cells is associated with the progression of coronary artery lesions in acute Kawasaki disease[J]. Pediatr Res, 2004, 55(4): 688-694. |
| [16] | Fukazawa R, Ikegam E, Watanabe M, et al. Coronary artery aneurysm induced by Kawasaki disease in children show features typical senescence[J]. Circ J, 2007, 71(5): 709-715. |
| [17] | Addabbo F, Nacci C, De Benedictis L, et al. Globular adiponectin counteracts VCAM-1-mediated monocyte adhesion via AdipoR1/NF-kappaB/COX-2 signaling in human aortic endothelial cells[J]. Am J Physiol Endocrinol Metab, 2011, 301(6): E1143-E1154. |
| [18] | Mantzoros CS, Li T, Manson JE, et al. Circulating adiponectin levels are associated with better glycemic control, more favorable lipid profile, and reduced inflammation in women with type 2 diabetes[J]. Clin Endocrinol Metab, 2005, 90(8): 4542- 4528. |
| [19] | Yamauchi T, Kamon J, Minokoshi, et al. Adiponection stimulates glucose atilizationandfatty-acidoxidation by activating AMPactivated protein kinase[J]. Nature Med, 2002, 8( 11): 1288- 1295. |
| [20] | 张园海, 陆文文, 陈其, 等. 川崎病患儿血脂代谢变化的检测及分析[J]. 中国实用儿科杂志, 2004, 9(5): 303. |
| [21] | 王献民, 李焰, 柳颐龄. 川崎病患儿并发冠状动脉病变的危险因素分析[J]. 中国当代儿科杂志, 2012, 14(12): 938-941. |
| [22] | Ashouri N, Takahashi M, Dorey F, et al. Risk factors for nonresponse to therapy in Kawasaki disease[J]. J Pediatr, 2008, 153(3): 365-368. |
| [23] | Ou CY, Tseng YF, Lee CL, et al. Significant relationship between serum high- sensitivity C-reactive protein, high-density lipoprotein cholesterol levels and children with Kawasaki disease and coronary artery lesions[J]. Formos Med Assoc, 2009, 108( 9): 719-724. |
| [24] | Ouchi N, Kihara S, Funahashi T, et al. Obesity, adiponectin and vascular inflammatory disease[J]. Curr Opin Lipidol, 2003, 14(6): 561-566. |
| [25] | Honkanen VE, Mccrindle BW, Laxer RM, et al. Clinical relevance of the risk factors for coronary artery inflammation in Kawasaki disease[J]. Pediatr Cardiol, 2003, 24(2): 122-126. |
| [26] | Kemmotsu Y, Saji T, Kusunoki N, et al. Serum adipokine profiles in Kawasaki disease[J]. Mod Rheumatol, 2012, 22(1): 66-72. |
 2015, Vol. 17
2015, Vol. 17