2. 青岛大学附属医院检验科, 山东 青岛 266003;
3. 青岛大学附属医院内分泌科, 山东 青岛 266003;
4. 青岛大学附属医院产前诊断中心, 山东 青岛 266003
先天性甲状腺功能减退症(congenitalhypothyroidism,CH)是最常见的新生儿内分泌疾病,发病率约为1/3 000~1/4 000[1]。当甲状腺功能不足时,可引起代谢障碍、生理功能低下、生长发育迟缓、智能障碍等,严重影响新生儿的生长和智力发育。CH 主要由甲状腺激素合成异常(约15%)或甲状腺发育不全(thyroid dysgenesis,TD,约85%)引起。大量研究表明甲状腺发育不全,包括缺如(5%)、异位(30%~45%) 和发育不良(35%~40%)[2],与PAX8、甲状腺转录因子1(TTF-1)、甲状腺转录因子2(TTF-2)等甲状腺转录因子[3] 的基因突变有密切关系。另外,甲状腺激素合成异常(临床表现为甲状腺肿大)与影响碘代谢和甲状腺激素合成和分泌等过程的基因突变有关,主要包括甲状腺过氧化酶(TPO)、甲状腺球蛋白(TG)、Na/I 同向载体(NIS)、碘酪氨酸脱碘酶(DEHAL1)、双氧化酶2(dualoxidase2,DUOX2)等基因,这些基因突变的遗传方式多为常染色体隐性遗传[4]。在甲状腺激素合成异常导致CH 相关的基因突变中,DUOX2 基因突变越来越受到国外学者的关注。
人DUOX2 位于染色体15q15.3 区域,长度约为22 kb,由34 个外显子组成。其翻译的DUOX2前体蛋白由一个氨基酸长度为26 的信号肽和随后的1 522 个氨基酸组成[5]。DUOX2 蛋白是一种在甲状腺滤泡细胞质膜顶部表达的膜蛋白,C 端包括一个六次跨膜的α 螺旋结构和一个FAD 与NADPH 结合位点,N 端包括过氧化物酶样结构及一个跨膜螺旋结构[6]。DUOX2 的得名源于其C 端区域与NADPH 氧化酶2(NOX2)有50% 相似性,且氨基末端为一个过氧化物酶样结构(与TPO有43% 相似性)[7,8,9]。 DUOX2 是钙依赖性辅酶II(Ca2+/NADPH)氧化酶的催化活性部分,催化合成过氧化氢(H2O2)。国外许多研究证实DUOX2的功能缺失突变会导致甲状腺H2O2无法生成,最终造成CH[10]。但目前国内关于DUOX2 基因突变的研究很少,本研究选取了10 例经新生儿筛查确诊为CH 伴甲状腺肿大的患儿作为研究对象,对其基因突变的类型和特点进行分析,为新生儿CH 的基因筛查、产前诊断和基因治疗提供一定的理论基础。1 资料与方法1.1 研究对象
来自济南市新生儿疾病筛查中心的10 例CH患儿作为研究对象,其中男性6 例,女性4 例,年龄7±3 岁。入选标准:新生儿筛查中促甲状腺激素(TSH) ≥ 20 μIU/mL 者,再取静脉血测TSH、FT3、FT4,确定CH 者进行99mTc 甲状腺扫描或B 超检查,甲状腺位置正常且肿大者。同时区分永久性和暂时性CH,其中7 例为伴甲状腺肿大永久性CH,3例为伴甲状腺肿大暂时性CH。该研究获得了青岛大学医学院伦理委员会的批准和患儿家属的知情同意。1.2 基因组DNA 提取
取患儿外周静脉血2 mL 置于柠檬酸钠抗凝管,采用TIANGEN 产DNA 提取试剂盒全血型提取外周血基因组DNA。利用Nanodrop2000 微量紫外分光光度计(Thermo Scientific)对提取的DNA进行纯度和浓度检测,显示OD 值为1.82~1.98,浓度最低60.0 ng/μL,最高368.8 ng/μL。1.3 PCR 扩增
利用Primer 5 软件设计引物扩增DUOX2 所有外显子,由Invitrogen 公司合成引物(表 1)。PCR 反应体系:20 μL PCR 反应缓冲液中含200 nMdNTPs,80 ng DNA 模板,上、下游引物0.5 μM,1.25 U Taq 聚合酶,1×reaction buffer(10 mM TrisHCl,pH 8.3,50 mM KCl,2.5 mM MgCl2)。PCR反应条件:95 ℃ 预变性 5 min,35 个循环中,94℃ 45 s,55~65℃ 45 s,72℃ 45 s,72℃ 终延伸7 min,降温至4℃。
| 表1 DUOX2 基因的引物及其扩增产物长度 |
PCR 扩增产物经2% 琼脂糖凝胶电泳分离观察PCR 产物扩增情况,利用UVP 凝胶成像仪进行图像扫描,于相应位置处见单一条带。PCR 产物送至上海申速生物有限公司进行直接测序。1.5 生物信息学分析
用DNAMAN 软件和VECTOR NTI 软件进行生物信息学分析,将患儿DUOX2 基因测序结果与GenBank 中DUOX2 基因序列进行比对,从中发现患儿DUOX2 基因可能存在的新突变位点,为分析中国人群DUOX2 基因突变类型和特点提供依据。2 结果2.1 PCR 扩增产物检测结果
所有PCR 扩增产物经过琼脂糖凝胶电泳鉴定,加入DNA 标准品作为对照,紫外灯下可见目的片段扩增条带清晰单一,反应产物的长度与所设计的各片段的大小预期值符合,进行DNA 测序。2.2 DUOX2 基因所有外显子DNA 测序结果
10 例CH 伴甲状腺肿大患儿均进行DUOX2基因所有外显子DNA 测序,在1 例永久性CH 患儿中发现DUOX2 基因第28 外显子发生了G>A的杂合性突变(c.G3632A),在3 例患儿(2 例永久性CH 患儿,1 例暂时性CH 患儿)中发现DUOX2 基因第17 外显子发生了T>C 的杂合性突变(c.T2033C)。其他CH 患儿均未发现DUOX2基因的突变。 2.3 生物信息学分析
经过生物信息学分析发现,第28 外显子突变位于cDNA3632(c.G3632A),导致第1211 密码子的精氨酸变为组氨酸(p.R1211H)(图 1),第17 外显子突变位于cDNA2033(c.T2033C),导致第678 密码子的组氨酸变为精氨酸(p.H678R)(图 2)。同时,在人、小鼠、大鼠、绵羊、猪种群中,利用DNAMAN 软件进行DUOX2 蛋白多重序列比对,发现第28 外显子突变位于相对保守的区域,第17外显子突变位于非保守区域。
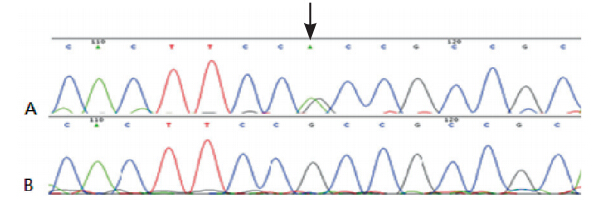 |
图 1 DUOX2 第28 外显子的部分测序图 A:基因突变测序图,突变位点为A/G 杂合双峰(箭头所示);B:正常基因测序图,为GG 纯合。 |
 |
图 2 DUOX2 第17 外显子的部分测序图 A:突变基因测序图,突变位点为C/T 杂合双峰(箭头所示);B:正常基因测序图,为TT 纯合。 |
CH 是新生儿最常见的内分泌疾病,甲状腺激素合成缺陷是CH 的致病因素之一。碘的氧化及有机化是甲状腺激素合成的中心环节及限速阶段,此过程需要TPO 和H2O2的参与。只有在H2O2存在的条件下,TPO 才能将无机碘离子氧化成有机碘,并催化有机碘与TG 中的酪氨酸残基反应生成一碘酪氨酸,进而产生3,5- 二碘酪氨酸。在此过程中H2O2作为电子受体发挥作用[11]。H2O2由DUOX2 催化合成,一旦DUOX2 基因发生突变,造成其功能缺失,不能正常合成H2O2,使碘不能氧化和有机化,就会造成甲状腺激素合成不足,最终导致CH 的发生。
自从2002 年[12] 在CH 患者中首次进行DUOX2 基因突变研究开始,迄今为止已经发现了包括错义突变、无义突变、剪接位点突变和缺失突变在内的20 多种不同类型DUOX2 基因突变。Moreno 等[12] 对8 例过氯酸盐释放试验为阳性的暂时性CH 伴甲状腺肿大患者进行DUOX2 基因突变检测,发现了3 例DUOX2 基因杂合突变(Q686X,R701X,S965fsX29),另外在1 例永久性CH 患者中发现R434X 的纯合突变。Vigone 等[10] 发现2例碘有机化缺陷的永久性CH 患者中存在R842X和R376W 的DUOX2 复合等位基因突变。Varela等[13] 对17 例碘转运缺陷的CH 患者中也发现1 例携带有DUOX2 复合等位基因突变的永久性CH 患者,其突变为p.Q36H/p. S965fsX29,该患者是由于Q36H 突变使DUOX2 活性完全丧失而引起的永久性CH。根据以上报道,研究人员曾初步推测DUOX2 基因型与表现型的关系,即DUOX2 基因单等位基因杂合突变可引起暂时性CH 及复合等位基因突变可引起永久性CH。但后来,随着病例报道的增加,基因型- 表现型的关系与该预测的情况相比,越来越复杂。Pfarr 等[14] 报道了1 例暂时性CH 伴甲状腺肿大患者存在复合等位基因杂合突变(ins602 g -fsX300/D506N),其父亲携带ins602 g 杂合突变,但甲状腺功能正常,而未表现出临床症状的母亲和一个兄弟也携带有突变(D506N)。此外,据Chiesa 等[15] 报道,在一个日本家系中,有4 个同胞兄弟姐妹具有复合等位基因突变(L479SfsX2/K628RfsX10),其中3 人为暂时性CH,临床表现为出生时甲状腺激素水平低,甲状腺轻度肿大,7、9 岁时L-T4 治疗终止后,甲状腺功能测定均正常。第四个同胞出生时TSH水平暂时较高,2个月后在停止L-T4 治疗的情况下却有所降低。同时,Maruo 等[16] 在2例暂时性CH 患者中也发现了两例复合杂合突变(H678R/L1067S;A649E/R885Q)。
卢德国等[17] 曾从山东沿海地区选取了10 例暂时性CH 伴甲状腺肿大患儿,进行DUOX2 基因突变筛查,在1 例CH 患儿中发现DUOX2 基因单个等位基因的杂合性突变(c.C2101T),该突变导致第701 密码子精氨酸变为终止密码(p. R701X),该突变为无义突变。本研究选取的研究对象来自山东内陆地区(济南地区),且患儿临床表型多为永久性CH 伴甲状腺肿大。本研究对10 例CH 伴甲状腺肿大患儿进行DUOX2 基因所有外显子DNA 测序,结果发现两种DUOX2 基因单个等位基因的杂合性突变,分别是第28 外显子突变位于cDNA3632(c.G3632A),导致第1211密码子的精氨酸变为组氨酸(p.R1211H),以及第17 外显子突变位于cDNA2033(c.T2033C),导致第678 密码子的组氨酸变为精氨酸(p.H678R),均为错义突变。精氨酸为脂肪族氨基酸,组氨酸为杂环族氨基酸,基因突变导致的氨基酸的改变可能导致蛋白质空间结构的改变,结构决定功能,因此本研究所发现突变可能会导致蛋白质功能的改变,是否为致病突变需要进一步做功能试验验证。本研究所发现突变均为杂合性突变,研究结果提示DUOX2 基因单个等位基因突变可能引起蛋白质功能的改变而导致CH。
| [1] | De Felice M, Di Lauro R. Thyroid development and its disorders: genetics and molecular mechanisms[J]. Endocr Rev, 2004, 25(5): 722-746. |
| [2] | Vilain C, Rydlewski C, Duprez L, et al. Autosomal dominant transmission of congenital thyroid hypoplasia due to loss-offunction mutation of PAX8[J]. J Clin Endocrinol Metab, 2001, 86(1): 234-238. |
| [3] | Van Vliet G. Development of the thyroid gland: lessons from congenitally hypothyroid mice and men[J]. Clin Genet, 2003, 63(6): 445-455. |
| [4] | Rubio IG, Galrao AL, Pardo V, et al. A molecular analysis and long-term follow-up of two siblings with severe congenital hypothyroidism carrying the IVS30+1G>T intronic thyroglobulin mutation[J]. Arq Bras Endocrinol Metabol, 2008, 52(8): 1337-1344. |
| [5] | Morand S, Agnandji D, Noel-Hudson MS, et al. Targeting of the dual oxidase 2 N-terminal region to the plasma membrane[J]. J Biol Chem, 2004, 279(29): 30244-30251. |
| [6] | Moreno JC, Pauws E, van Kampen AH, et al. Cloning of tissuespecific genes using serial analysis of gene expression and a novel computational substraction approach[J]. Genomics, 2001, 75(1-3): 70-76. |
| [7] | De Deken X, Wang D, Many MC, et al. Cloning of two human thyroid cDNAs encoding new members of the NADPH oxidase family[J]. J Biol Chem, 2000, 275(30): 23227-233. |
| [8] | Dupuy C, Kaniewski J, Deme D, et al. NADPH-dependent H2O2 generation catalyzed by thyroid plasma membranes. Studies with electron scavengers[J]. Eur J Biochem, 1989, 185(3): 597- 603. |
| [9] | Dupuy C, Virion A, De Sandro V, et al. Activation of the NADPH-dependent H2O2-generating system in pig thyroid particulate fraction by limited proteolysis and Zn2+ treatment[J]. Biochem J, 1992, 283(Pt 2): 591-595. |
| [10] | Vigone MC, Fugazzola L, Zamproni I, et al. Persistent mild hypothyroidism associated with novel sequence variants of the DUOX2 gene in two siblings[J]. Hum Mutat, 2005, 26(4): 395. |
| [11] | Vaisman M, Rosenthal D, Carvalho DP. Enzymes involved in thyroid iodide organification[J]. Arq Bras Endocrinol Metabol, 2004, 48(1): 9-15. |
| [12] | Moreno JC, Bikker H, Kempers MJ, et al. Inactivating mutations in the gene for thyroid oxidase 2 (THOX2) and congenital hypothyroidism[J]. N Engl J Med, 2002, 347(2): 95-102. |
| [13] | Varela V, Rivolta CM, Esperante SA, et al. Three mutations (p.Q36H, p.G418fsX482, and g.IVS19-2A>C) in the dual oxidase 2 gene responsible for congenital goiter and iodide organification defect[J]. Clin Chem, 2006, 52(2): 182-191. |
| [14] | Pfarr N, Korsch E, Kaspers S, et al. Congenital hypothyroidism caused by new mutations in the thyroid oxidase 2 (THOX2) gene[J]. Clin Endocrinol, 2006, 65(6): 810-815. |
| [15] | Chiesa A, Rivolta CM, Targovnik HM, et al. Clinical, biochemical, and molecular findings in Argentinean patients with goitrous congenital hypothyroidism[J]. Endocrine, 2010, 38(3): 377-385. |
| [16] | Maruo Y, Takahashi H, Soeda I, et al. Transient congenital hypothyroidism caused by biallelic mutations of the dual oxidase 2 gene in Japanese patients detected by a neonatal screening program[J]. J Clin Endocrinol Metab, 2008, 93(11): 4261-4267. |
| [17] | 卢德国, 车峰远, 贾秋桦, 等. DUOX2 基因突变引起先天性甲状腺功能减低伴甲状腺肿大的研究[J]. 中国优生与遗传杂志, 2012, 20(9): 15-17. |
 2015, Vol. 17
2015, Vol. 17



