支气管肺发育不良(bronchopulmonary dysplasia, BPD)是早产儿最常见的并发症,已经成为新生儿 重症监护病房最棘手的问题之一。虽然 BPD 的发 病机制不完全清楚,但新生肺暴露在高氧环境中 通过氧毒作用所致的肺损伤是重要的原因之一 [1]。 国内外研究表明高浓度氧所致的氧化应激损伤在 BPD 的发生和发展中起着极其重要的作用 [2, 3]。目 前缺乏有效的治疗方法。
近年来发现 I 型肺泡上皮细胞参与肺水肿形 成、肺泡及间质纤维蛋白沉积,并影响急性肺损 伤与急性呼吸窘迫综合征的转归 [4]。晚期糖基化 终末产物受体(receptor for advanced glycation endproducts,RAGE)是一种多配体受体,属于细胞表 面分子免疫球蛋白超家族成员,RAGE 位于 I 型肺 泡上皮细胞基底侧细胞膜,是其损伤标志物 [4]。 RAGE 有两种形式:第一种为全长 RAGE,又称膜 RAGE,包括膜外域、跨膜域和膜内域;第二种是 可溶性 RAGE(sRAGE),缺乏跨膜域,被释放到 细胞外和血浆中,可作为潜在的 I 型肺泡上皮细胞 损伤标志物,循环中 sRAGE 水平增高与急性肺损 伤及急性呼吸窘迫综合征的严重程度相关 [5]。本课 题组前期研究表明 RAGE-NF-κB 通路在高氧诱导 的肺损伤中具有重要作用,通过下调 RAGE-NF-κB 通路对肺损伤产生保护作用 [6]。因此,RAGE-NF- κB 通路在 BPD 的发病机制中逐渐受到关注。
临床上糖皮质激素广泛应用于新生儿 BPD 的 治疗,系统激素治疗虽可改善不能撤机患儿肺功 能、降低对氧的依赖性、促进拔管和缩短机械通 气时间,但因其作用机制仍不明确,目前仍存在 较多争议。本研究将在前期研究基础上,研究糖 皮质激素对高氧诱导肺损伤时 RAGE-NF-κB 信号 通路的影响,从而探讨激素治疗 BPD 相关机制。
1 材料与方法 1.1 试剂及仪器TRIzol(美国 Invitrogen 公司);反转录 - 聚 合酶链反应(RT-PCR)试剂盒(大连 TaKaRa 公 司);抗 RAGE 单克隆抗体(英国 Abcam 公司); 抗 NF-κB 抗体及抗 β- 肌动蛋白抗体(美国 Sigma 公司);ELISA 试剂盒(武汉博士德公司);CY- 100 数字测氧仪(浙江省建德市利达仪器厂)。所有引物由上海生物工程公司合成。
1.2 新生大鼠高氧肺损伤模型制备与样本收集日龄 1 d 新生 Sprague-Dawley 大鼠 24 只,雌 雄不限,体重 10~15 g,由南京医科大学动物实验 中心提供。按随机数字表法将 24 只新生大鼠随机 分为空气对照组、高氧模型组和激素干预组,各 组 8 只。按本实验室方法新生大鼠于生后即置于 95% 氧浓度下暴露 7 d 制成模型 [7],空气对照组仅 生后暴露于同室内空气中饲养 7 d,激素干预组于 造模后尾静脉注射地塞米松 1 mg/kg,隔天 1 次, 共 3 次,高氧模型组及空气对照组动物均同时尾 静脉注射相同体积的生理盐水。3 组喂养新生大鼠 的母鼠每 24 h 互换,以避免母鼠因氧中毒影响新 生鼠的哺乳,记录大鼠生长情况。
各组大鼠均于实验第 13 天称重后,腹腔注 射 10% 水 合 氯 醛(8 mL/kg) 处 死; 采 用 眼 球 放 血法留取血 1~2 mL;切断腹主动脉进一步放血。 颈正中暴露气管,剪开一小口插入导管并固定, 向导管内缓缓注入 1 mL 预冷生理盐水反复回抽 3 次,回收率 80%~90%,留取支气管肺泡灌洗液 (bronchoalveolar lavage fluid,BALF)。快速剪开胸 腔,取出双侧肺脏,肉眼观察后,生理盐水冲洗; 左上肺制成肺组织匀浆,右上肺组织以 4% 多聚甲 醛固定,石蜡包埋后连续切片,厚度为 6 μm,供 免疫组化和组织学检查用。
1.3 ELISA 法 测 定 血 清 及 BALF 中 TNF-α、sRAGE 含量采血后室温下静置 2 h,再置 4℃冰箱 3~4 h, 待血液凝固血块收缩后,4 000 rpm 离心 10 min, 取上清,保存于 -20℃冰箱中。取 BALF 于 1 h 内 4 000 rpm 离心 10 min,取上清,保存于 -20℃冰箱 中。采用 ELISA 法完全按试剂盒说明书检测血清 及 BALF 中 TNF-α 和 sRAGE 含量。
1.4 RT-PCR 法检测肺组织匀浆 RAGE mRNA、NF-κB mRNA 的表达应 用 TRIzol 试 剂 常 规 一 步 法 提 取 肺 组 织 标 本 总 mRNA。RAGE 引 物 序 列: 上 游: 5'-GGTGCTGGTTCTTGCTC-3',下游:5'-TCCCTCG- CCTGTTAGTT-3',扩增产物长度为 235 bp; NF-κB 引物序列:上游 5'-GAAGAAGCGAGACCTGGAG-3', 下游 5'-TCCGGAACACAATGGCCAC-3',扩增 产物长度 398 bp;内参 β-actin 引物序列:上游:5'-GATGACAAGCAGCCCTAT-3',下游: 5'-TCCATGCCAATTTACAAC-3',扩增产物长度 450 bp。取 PCR 产物 5 μL 在 1.5% 琼脂糖凝胶上 电泳,在凝胶成像系统中分别计算 RAGE mRNA、 NF-κB mRNA 与 β-actin 的灰度值比值即代表 RAGE mRNA 和 NF-κB mRNA 相对表达量。
1.5 Westem blot 检测 RAGE 蛋白和 NF-κB 蛋白的表达肺 组 织 匀 浆 10 000 rpm 离 心 10 min 后,取 上清测蛋白浓度,加上样缓冲液并于沸水中煮沸 5 min 后以 10% SDS- 聚丙烯酰胺凝胶进行电泳分 离,然后把胶上的蛋白电转移到醋酸纤维膜上,5% 无脂奶粉封闭,与待测蛋白的特异性抗体(稀释 度均为 1 : 500)孵育杂交,4℃过夜洗膜后,再加 辣根过氧化物酶标记的二抗,室温孵育 1 h,洗膜 后进行显色,曝光于 X 线胶片上,在图像分析系 统分别计算目的蛋白条带灰度值与内参灰度值的 比值代表目的蛋白的相对表达量。
1.6 肺组织病理检查苏木精-伊红染色后检测肺组织病理学改变, 按文献 [8] 的方法,光镜下依据肺泡间隔水肿、肺 泡出血、肺泡内纤维蛋白沉积和肺泡内细胞浸润 4 方面进行肺损伤病理学评分,每个方面分别计 0~3 分;每只大鼠分别切取 4 张切片,每张切片观察 不重叠的 10 个视野,分别记录病理学评分的值, 4 张切片的平均值即代表该大鼠的病理学评分。
1.7 统计学分析采用 SPSS 13.0 统计学软件对所有数据进行统 计学比较分析,计量资料以均数 ± 标准差(x± s) 表示,多组间比较采用 One-way ANOVA 分析,组 间两两比较采用 LSD-t 检验,P<0.05 为差异有统 计学意义。
2 结果 2.1 大鼠生长情况高氧模型组和激素干预组新生鼠活动逐渐减 少,反应迟钝,但全部成活;激素干预组较高氧 模型组上述情况有所改善。
2.2 大鼠肺组织损伤评分空气对照组大鼠肺组织结构完整,基本无 炎性细胞渗出;高氧模型组可见炎性细胞渗出、 肺泡间隔水肿增厚;而激素干预组水肿、炎性细 胞浸润以及出血等病理情况均较高氧模型组减轻 (图 1)。3 组肺组织损伤评分差异有统计学意义 ( F=37.68,P<0.01),其中高氧模型组肺组织损 伤评分(3.3±0.7)高于空气对照组(0.7±0.4) 和激素干预组(1.1±0.4),且激素干预组肺组织 损伤评分亦高于空气对照组(均 P<0.05)。
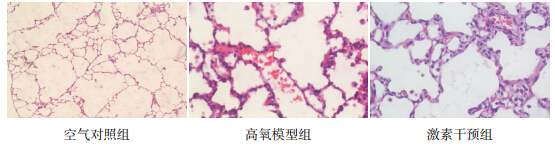 |
图 1 各组大鼠肺组织病理切片(苏木精 - 伊红染色,×100)对照组大鼠肺组织结构完整,基本无炎性细胞渗出;高氧模型组可见大量炎性细胞浸润、出血和肺泡壁水肿增厚;激素干预组上述病理情况均较高氧模型组有所减轻。 |
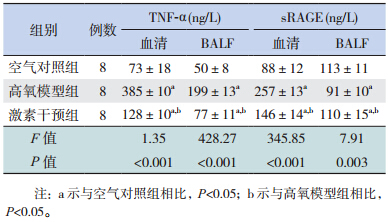
ELISA 检测结果显示 3 组间血清中 TNF-α 和 sRAGE 水平的差异有统计学意义(均 P<0.01); 高氧模型组和激素干预组明显高于对照组,而激 素干预组明显低于高氧模型组(均 P<0.05)。
同时 3 组大鼠间BALF中TNF-α、sRAGE 水 平的差异有统计学意义(均 P<0.01);高氧模型 组和激素干预组 TNF-α 明显高于对照组,sRAGE 低于对照组,而激素干预组 TNF-α 明显低于模型 组,sRAGE 高于模型组(均 P<0.05)。见表 1。
| 表 1 各组新生大鼠血清和 BALF 中 TNF-α 和 sRAGE水平比较(x± s) |
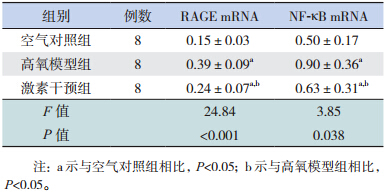
RT-PCR 检测结果显示,3 组间肺组织 RAGE mRNA、NF-κB mRNA 表达差异均有统计学意义 (均 P<0.05);高氧模型组和激素干预组明显高 于对照组,而激素干预组明显低于高氧模型组(均 P<0.05)。见表 2。
| 表 2 各组新生大鼠肺组织 RAGE mRNA 和 NF-κBmRNA 的表达比较(x± s) |
Western blot 结果显示,3 组间肺组织 RAGE、 NF-κB(NF-κB p65)蛋白表达差异均有统计学意 义(均 P<0.01),高氧模型组和激素干预组明显 高于对照组,而激素干预组明显低于高氧模型组 (均 P<0.05),见图 2。
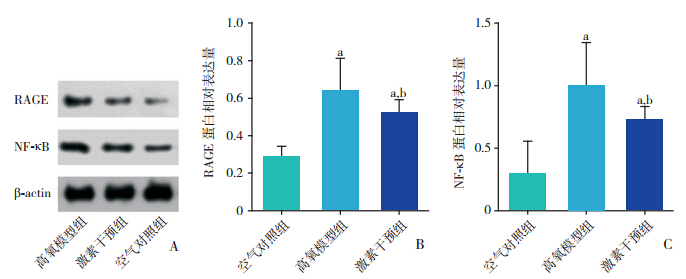 |
图 2 各组大鼠肺组织 RAGE 和 NF-κB 蛋白水平表达A 为 Western blot 电泳条带图;B~C 为蛋白相对表达量统计图,a 示与空气对照组相比,P<0.05;b 示与高氧模型组相比,P<0.05。 |
随着辅助机械通气的广泛应用及肺表面活性 物质的问世,早产儿,特别是超低出生体重儿的 存活率明显得到了提高,随之 BPD 的发病率也逐 年增加。研究认为肺泡发育障碍是其主要的病理 改变,其发病机制与肺发育不成熟、高浓度氧、 感染、呼吸机相关性肺损伤和细胞凋亡等有关 [9, 10]。
RAGE 的生理作用与肺泡气体交换、细胞铺 展、细胞增殖以及细胞外基质黏附等有关 [11]。病 理状态下,细胞膜上的 RAGE 与配体结合后可启 动多条信号通路,其中以 NF-κB 通路最为重要。 RAGE-NF-κB 通路激活及随后多种促炎症因子的 转录是一种正反馈环,它通过一种正向的对基因 启动子的直接调控增加 RAGE 基因在细胞表面的 表达,使细胞持续活化,最终导致组织细胞的损 害 [12]。研究表明肺泡中 sRAGE 水平可作为 I 型肺 泡上皮细胞损伤的标志,评价肺损伤的严重性和 评估疗效 [13]。Lizotte 等 [14] 发现肺组织中 RAGE 含 量随肺组织成熟度增加而逐渐升高,高氧可抑制 RAGE 表达;并认为这可能与高氧抑制肺泡发育 致Ⅰ型肺泡上皮细胞数量下降有关,而支气管肺 发育不良的病理损伤程度可能与 sRAGE 的丧失或 sRAGE/RAGE 的比例失衡有关。
系统激素治疗 BPD,可改善不能撤机患儿肺 功能、降低对氧的依赖性、促进拔管和缩短机械 通气时间,对治疗 BPD 有较好的疗效。此外,糖 皮质激素能促进肺表面活性物质的合成及肺抗氧化酶的生成,能减少肺水肿和炎症反应,减少炎 性细胞的浸润,抑制纤维细胞的增生 [15, 16],但其 机制仍不明确。
本研究发现,应用糖皮质激素干预后,肺组 织 RAGE、sRAGE、NF-κB 蛋 白 及 mRNA 表 达 明 显降低,血清中 sRAGE 含量明显升高。由此,我 们认为高氧可启动 RAGE-NF-κB 信号通路,从而 引起肺的损伤,而糖皮质激素治疗后可抑制 RAGE 及其可溶性形式,减少促炎症因子的表达,从而 破坏 RAGE-NF-κB 通路的正反馈环,下调这一信 号通路从而发挥肺保护作用。sRAGE 具有阻断 RAGE 信号、保护组织和细胞免受配体相关性损伤 的能力,其发挥诱饵受体作用,与肺损伤密切相 关。有实验研究发现,肺泡中 sRAGE 水平可作为 I 型肺泡上皮细胞损伤的标志物,评价损伤的严重 性和疗效评估 [17]。而在成人研究中 sRAGE 与慢性 肺疾病肺功能密切相关 [18]。故我们推测 sRAGE 的 水平亦可能作为监测 BPD 肺损伤程度及评价预后 的指标。
综上所述,糖皮质激素可通过下调 RAGE-NF- κB 通路,从而发挥保护肺组织,治疗 BPD 的作用。
| [1] | 侯伟, 刘海燕, 李丹, 等. 新生大鼠高氧肺损伤血管内皮生 长因子蛋白及其mRNA 表达变化研究[J]. 中国当代儿科杂 志, 2008, 10(2): 207-210. |
| [2] | Britton JR. Altitude, oxygen and the definition of bronchopulmonary dysplasia[J]. J Perinatol, 2012, 32(11): 880-885. |
| [3] | 党红星. 氧化应激与支气管肺发育不良研究进展[J]. 国际儿 科学杂志, 2012, 39(5): 433-437. |
| [4] | Guo WA, Knight PR, Raghavendran K. The receptor for advanced glycation end products and acute lung injury/acute respiratory distress syndrome[J]. Intensive Care Med, 2012, 38(10): 1588-1598. |
| [5] | Christie JD, Shah CV, Kawut SM, et al. Plasma levels of receptor for advanced glycation end products, blood transfusion, and risk of primary graft dysfunction[J]. Am J Respir Crit Care Med, 2009, 180(10): 1010-1015. |
| [6] | Tian Z, Li Y, Ji P, et al. Mesenchymal stem cells protects hyperoxia-induced lung injury in newborn rats via inhibiting receptor for advanced glycation end-products/nuclear factor kappaB signaling[J]. Exp Biol Med(Maywood), 2013, 238(2): 242-247. |
| [7] | 田兆方, 张志敏, 李玉红. GMCSF 对高氧暴露新生大鼠肺组 织RAGE-NF-κB 通路的影响[J]. 中华医学杂志, 2011, 30(8): 2143-2147. |
| [8] | Matute-Bello G, Winn RK, Jonas M, et al. Fas (CD95) induces alveolar epithelial cell apoptosis in vivo: implications for acute pulmonary inflammation[J]. Am J Pathol, 2001, 158(1): 153-161. |
| [9] | 轩哲, 薛辛东, 富建华. 早产儿支气管肺发育不良的防治新 进展[J]. 中国当代儿科杂志, 2010, 12(5): 412-416. |
| [10] | Ambalavanan N, Mourani P. Pulmonary hypertension in bronchopulmonary dysplasia[J]. Birth Defects Res A Clin Mol Teratol, 2014, 100(3): 240-246. |
| [11] | Yatime L, Andersen GR. Structural insights into the oligomerization mode of the human receptor for advanced glycation end-products[J]. FEBS J, 2013, 280(24): 6556-6568. |
| [12] | Reynolds PR, Wasley KM, Allison CH. Diesel particulate matter induces receptor for advanced glycation end-products(RAGE) expression in pulmonary epithelial cells, and RAGE signaling influences NF-kappaB-mediated inflammation[J]. Environ Health Perspect, 2011, 119(3): 332-336. |
| [13] | 吉萍, 俞敏. 晚期糖基化终末产物受体与肺发育及肺损伤[J]. 国际儿科学杂志, 2013, 40(5): 454-457. |
| [14] | Lizotte PP, Hanford LE, Enghild JJ, et al. Developmental expression of the receptor for advanced glycation end-products (RAGE) and its response to hyperoxia in the neonatal rat lung[J]. BMC Dev Biol, 2007, 7: 15. |
| [15] | THOMAS W, SPEER CP, 钱莉玲, 等. 支气管肺发育不良的防 治—证据及临床应用[J]. 中国当代儿科杂志, 2007, 9(3): 276-277. |
| [16] | 齐骥. 糖皮质激素防治早产儿支气管肺发育不良的进展及争 议[J]. 中国循证儿科杂志, 2011, 6(3): 237-240. |
| [17] | Su X, Looney MR, Gupta N, et al. Receptor for advanced glycation end-products (RAGE) is an indicator of direct lung injury in models of experimental lung injury[J]. Am J Physiol Lung Cell Mol Physiol, 2009, 297(1): L1-L5. |
| [18] | Iwamoto H, Gao J, Pulkkinen V, et al. Soluble receptor for advanced glycation end-products and progression of airway disease[J]. BMC Pulm Med, 2014, 14: 68. |
 2015, Vol. 17
2015, Vol. 17