支气管哮喘(简称哮喘)是气道慢性炎症性 疾病,其特点为气道可逆性阻塞和气道高反应性。 核因子-κB(NF-κB)是一种广泛存在于体内的多 种细胞的核转录因子,参与多种炎症相关因子的 基因转录。抑制 NF-κB 的活化,进而阻断炎症因 子的产生途径,可达到减轻哮喘气道炎症的目的。
糖皮质激素(GC)是目前公认治疗哮喘最有 效的药物。吸入性 GC 主要作用在气道的上皮细胞, 在细胞水平,GC 通过抑制趋化因子和黏附分子的 生成来阻断炎症细胞向气道募集,从而减少气道炎 症细胞的数量。在基因水平,GC 能够促进抑制蛋 白 I κB-α表达上调,抑制 NF-κB 依赖基因的转录 [1]。 本研究拟通过建立哮喘小鼠模型,探讨布地奈德 (Budesonide,BUD)雾化吸入治疗哮喘小鼠的机制。 1 材料与方法 1.1 主要试剂及仪器
BUD 混悬液由阿斯利康制药有限公司提供; 糖皮质激素受体(GR)免疫组化检测试剂盒购自 武汉博士德生物工程有限公司;NF-κB(P-65)免 疫组化检测试剂盒及小鼠二步法检测试剂盒购自 北京中杉金桥生物技术有限公司;卵清蛋白(OVA) 购自上海博舜生物科技有限公司;压缩雾化机购 自德国百瑞公司。 1.2 实验动物及分组
健康 6~8 周龄的雄性 BALB/c 小鼠共 24 只, 体重 23±3 g,由中南大学实验动物学部提供,符 合二级动物标准,饲养于中南大学实验动物学部。 按照完全随机方法将小鼠分为生理盐水对照组(对 照组)、哮喘模型组(哮喘组)和 BUD 治疗组(BUD 组),每组 8 只。 1.3 小鼠哮喘模型的建立
参照 Mayuzumi 等[2] 的方法制备小鼠哮喘模 型。哮喘组小鼠分别于第 1、14 天腹腔注射 OVA 混悬液(100 μg OVA+10 mg 氢氧化铝 +0.2 mL 生 理盐水)0.2 mL 致敏,并于第 14 天以 2% OVA 溶 液5 mL 雾化吸入激发1 次,第25 天起予以1% OVA 溶液 5 mL 雾化吸入激发,每日 1 次,每次 30 min,连续激发 10 d,小鼠出现呼吸急促、烦躁 不安、腹肌痉挛、两便失禁为阳性反应。BUD 组 致敏及激发步骤同哮喘组,并从第 25 天起于每次 激发前 30 min 雾化吸入 BUD 雾化液 5 mL(含 BUD 1 mg),每日 1 次,连续 10 d;对照组腹腔注射致 敏以及雾化吸入激发均以等量生理盐水替代。 1.4 嗜酸性粒细胞计数
于末次雾化24 h 后处死小鼠,开胸,结扎左肺, 以 1 mL 生理盐水灌洗右肺并回收灌洗液,重复灌 洗 2 次,收集的灌洗液以 2 000 r/min 离心 10 min, 收集上清液储存于 -20℃;细胞用 0.8 mL 嗜酸性 粒细胞(EOS)稀释液(2% 伊红溶液 5 mL+ 丙酮 5 mL+ 双蒸水 90 mL)重悬,取 0.1 μL 重悬液对细 胞计数板进行充池,然后在光镜下行 EOS 计数。 1.5 小鼠肺组织病理标本的制备
灌洗完毕后,分离小鼠结扎的左肺,浸入 4% 多聚甲醛固定 24 h,梯度酒精脱水、透明、浸蜡、 石蜡包埋,行小鼠肺组织切片,厚度约 3 μm,常 规苏木精 - 伊红染色,光镜下观察病理改变。 1.6 免疫组化检测小鼠肺组织 GR 和 NF-κB 水平
将已固定的肺组织常规脱水、浸蜡、包埋后 切片,厚度约 5~8 μm;载玻片采用多聚赖氨酸防 脱片处理;捞片后置烤箱中,58℃约 1 h,使切片 紧密黏附于玻片上;切片常规脱蜡;3% H2O2去 离子水孵育 10 min,以消除内源性过氧化物酶活 性;蒸馏水洗,PBS 浸泡 5 min;微波抗原修复; 4% 山羊血清封闭,37℃温箱孵育 30 min;甩掉多 余液体,不洗;滴加一抗工作液,37℃孵育 2 h,4℃ 过夜;PBS 洗 4 遍;滴加生物素标记的二抗,37℃ 孵育 1 h,PBS 洗 3 遍;滴加链霉素抗生物素蛋白 -过氧化物酶溶液,37℃温箱孵育 30 min,PBS 洗涤; DAB 显色,苏木素复染;封片,普通光镜下观察。 每只动物随机取 3 张切片,每张切片随机取 5 个 高倍镜视野,计数每个视野阳性细胞数,算出平 均数即为每张切片阳性细胞的百分比。 1.7 统计学分析
采用 SPSS 17.0 统计软件对数据进行统计学分 析。计量资料用均数 ± 标准差(x±s)表示,多 组间比较采用单因素方差分析,组间两两比较采 用 SNK-q检验,P<0.05 为差异有统计学意义。 2 结果 2.1 临床症状
哮喘组小鼠激发后均出现不同程度的呼吸急 促、烦躁不安等症状,对照组及 BUD 组小鼠未见 明显异常表现。 2.2 各组小鼠 EOS 计数比较
哮喘组小鼠支气管肺泡灌洗液(BALF) 中 EOS 的 数 量(19.1±2.0×106/L)与对照组 (2.0±1.4×106/L)相比明显增加(P<0.05); BUD 治疗后,BALF 中 EOS 数量(10.6±1.6×10 6/L) 与哮喘组比较明显减少(P<0.05),但仍高于对照 组(P<0.05)。 2.3 各组小鼠肺组织病理改变情况
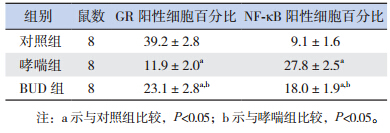
对照组小鼠气道黏膜未见明显水肿,支气管 管腔光滑,气道及周围血管组织无明显炎性细胞 浸润,肺泡腔内未见炎性分泌物。哮喘组小鼠气 道黏膜可见水肿明显,黏膜上皮细胞肿胀,气道 管腔缩小,甚至完全闭塞,气道腔内可见炎性分 泌物,气道周围血管扩张充血,气道黏膜层、黏 膜下层以及血管周围组织可见大量的炎症细胞浸 润,以 EOS、单核细胞及淋巴细胞为主,另外可 见气道平滑肌增厚。BUD 组小鼠气道仍可见炎症 变化,但与哮喘组相比明显减轻。见图 1。
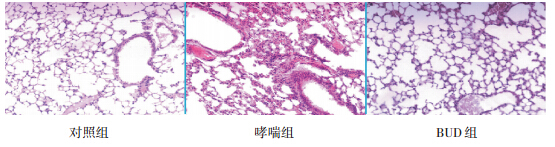 |
图 1 各组小鼠肺组织病理改变(苏木精 - 伊红染色,×100) 对照组小鼠肺组织未见明显炎症细胞浸润,支气 管管腔光滑,肺泡腔内无明显炎性分泌物;哮喘组小鼠气道周围血管扩张充血,支气管、肺泡等组织可见大量的炎症细胞浸润, 气道平滑肌增厚;BUD 组小鼠肺组织仍可见少量炎性细胞浸润以及血管充血,但较哮喘组明显好转。 |
哮喘组小鼠气道壁细胞中 GR 阳性细胞百分 比较对照组明显减少(P<0.05);BUD 组小鼠气 道壁细胞中 GR 阳性细胞百分比较哮喘组明显升 高,但仍低于对照组(P<0.05);相反,哮喘组 小鼠气道壁细胞中 NF-κB 阳性细胞所占百分比较 对照组明显增多,而 BUD 组小鼠气道壁细胞中 NF-κB 阳性细胞所占百分比与哮喘组比较明显减 少,但仍高于对照组(P<0.05)。见表 1,图 2。
| 表 1 各组小鼠肺组织 GR 和 NF-κB 水平比较 (x±s,%) |
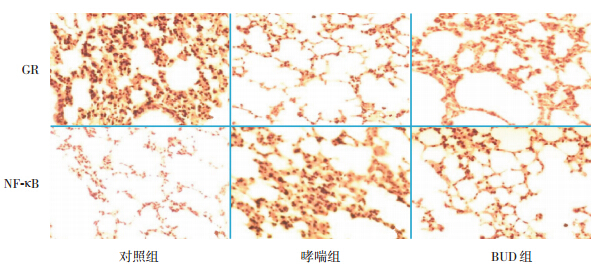 |
图 2 小鼠肺组织免疫组化结果(DAB 显色,×100) 哮喘组小鼠气道壁细胞中 GR 阳性细胞较对照组明显减少; BUD 组小鼠气道壁细胞中 GR 阳性细胞较哮喘组明显升高,但仍低于对照组;相反,哮喘组小鼠气道壁细胞中 NF-κB 阳性细 胞较对照组明显增多,而 BUD 组小鼠气道壁细胞中 NF-κB 阳性细胞较哮喘组明显减少,但仍高于对照组。图中棕色颗粒为阳 性细胞。 |
哮喘是一种以 EOS 浸润为特征的气道炎症性 疾病 ,伴有多种炎症介质和细胞因子参与。由于哮 喘发病机制复杂,哮喘动物模型在研究中发挥了 重要的作用。本研究采用 OVA 混悬液雾化吸入激 发 BALB/c 小鼠建立哮喘模型,结果显示小鼠激发 后均出现不同程度的呼吸急促、烦躁不安等症状, 病理观察显示哮喘组小鼠气道黏膜明显水肿,气 道管腔缩小,甚至闭塞,气道腔内可见炎性分泌物, 气道黏膜层、黏膜下层以及血管周围组织可见大 量 EOS、单核细胞及淋巴细胞浸润,气道平滑肌 增厚,BALF 中 EOS 数量增多,提示小鼠哮喘模型 制备成功。
GC 是目前应用最为广泛的甾体类抗炎药物, 其在哮喘治疗中的作用已成为国际共识[3]。本研究 结果显示与哮喘组比较,BUD 吸入治疗后,小鼠 肺部炎性细胞浸润明显减轻,BALF 中 EOS 数量明 显减少,但与对照组比较 BALF 中 EOS 仍有明显 增高,提示 BUD 吸入治疗有明显的疗效,但单一 使用吸入糖皮质激素不能完全控制气道炎症。
NF-κB 是重要的促炎细胞因子的转录调节 器,NF-κB 活化在哮喘的发病过程中发挥重要的 作用。多种与哮喘发生有关的细胞因子和酶类, 如 IL-1β、IL-4、巨噬细胞趋化蛋白-1(MCP-1)、 TNF-α、巨噬细胞炎性蛋白质-1α(MIP-1α)、环 氧合酶(COX-2)、细胞黏附分子-1(ICAM-1)等, 其基因都受到 NF-κB 的调节 [4-5]。
有证据表明,GC 能够促进抑制蛋白 IκB-α表 达的上调,阻断 NF-κB 的活化,抑制 NF-κB 依赖 的基因转录[1],达到减轻气道炎症、控制哮喘的目 的。而 GC 需要通过与 GR 结合才能发挥抗炎作用。 已证实在气道中 GR 主要存在于上皮细胞和支气管 平滑肌内,未激活的 GR 以蛋白复合物的形式存在, GC 与 GR 结合后,受体 / 激素复合物移行至胞核, 形成同型二聚体,与相对应的顺式作用 DNA 序 列即糖皮质激素应答元件(glucocorticoid-response elements,GREs)相结合,进而阻断或者刺激靶基 因的转录[6] 。NF-κB 与 GR 结合形成复合物调节多 种基因的转录,包括 GR 本身的基因转录[7]。研究 发现,COPD 患者的外周血白细胞中,GR 水平明 显低于正常对照组,在重症哮喘患者的外周血单 核细胞中,GR 的亲和力也是下降的,经过治疗后, 哮喘患者外周血白细胞中的 GR 水平上调[8]。
有研究表明,GR 和 NF-κB 可能在功能上互为 转录拮抗因子,机制可能为:(1)NF-κB和GR 之间的直接物理联系,NF-κB p65 的 RHD 结构域 和 GR 的 DBD 结构域参与两者间的直接作用,互 相抑制其转录活化功能;(2)NF-κB与GR竞争 有限的转录辅助因子,如 CREB 结合蛋白(CBP), CBP 在两者的转录活化过程中都是必需的,而数 量有限,二者通过竞争抑制对方的活性;(3)GC 可直接结合 I κB-α基因启动子上的 GC 结合位点, 活化 I κB-α基因的启动子,促使 I κB-α表达的上 调,进而抑制 NF-κB 依赖的基因转录 [9]。本研究 免疫组化结果显示与对照组相比,哮喘小鼠气道 壁细胞中 GR 的表达减少,而 NF-κB 的表达增加; 经 BUD 雾化治疗后,与哮喘组相比,BUD 组小鼠 气道壁细胞中 GR 表达增加,NF-κB 的表达减少; 说明 BUD 雾化治疗哮喘的机制可能与上调 GR 水 平和抑制 NF-κB 的活性有关,通过抑制 NF-κB活 化,阻断炎症因子的作用,抑制气道的炎症反应, 使哮喘患者的病情得到缓解。
| [1] | Edwards MR, Bartlett NW, Clarke D, et al. Targeting the NFkappaB pathway in asthma and chronic obstructive pulmonary disease[J]. Pharmacol Ther, 2009, 121(1): 1-13. |
| [2] | Mayuzumi H, Ohki Y, Tokuyama K, et al. Age-related difference in the persistency of allergic airway inflammation and bronchial hyperresponsiveness in a murine model of asthma[J]. Int Arch Allergy Immunol, 2007, 143(4): 255-262. |
| [3] | Papadopoulos NG, Arakawa H, Carlsen KH, et al. International consensus on (ICON) pediatric asthma[J]. Allergy, 2012, 67(8): 976-997. |
| [4] | Murphy D M , O' Byrne PM . Recent advances in the pathophysiology of asthma[J]. Chest, 2010, 137(6): 1417-1426. |
| [5] | 顾丹, 白春学. 核因子κB 与支气管哮喘发病关系及其临床 意义中华哮喘杂志(电子版)[J]. 2009, 3(3): 216-219. |
| [6] | Kadmiel M, Cidlowski JA. Glucocorticoid receptor signaling in health and disease[J]. Trends Pharmacol Sci, 2013, 34(9): 518-530. |
| [7] | Adcock IM, Gilbey T, Gelder CM. Glucocorticoid receptor localization in normal and asthmatic lung[J]. Am J Respir Crit Care Med, 1996, 154(3): 771-782. |
| [8] | 柳涛, 彭敏, 蔡柏蔷. 核转录因子κB 和糖皮质激素受体在慢 性阻塞性肺疾病患者稳定期的相互作用[J]. 中国医学科学院 学报, 2010, 32(2): 147-150. |
| [9] | Ratman D, Vanden Berghe W, Dejager L, et al. How glucocorticoid receptors modulate the activity of other transcription factors: a scope beyond tethering[J]. Mol Cell Endocrinol, 2013, 380(1-2): 41-54. |
 2015, Vol. 17
2015, Vol. 17