动脉导管未闭(patent ductus arteriosus,PDA) 在低出生体重的早产儿中较为常见,正常体重的 新生儿生后3 d 内导管自发性关闭,早产儿会持 续更长时间[1]。生后第3 天早产儿PDA 的发生率 为40%~60%,胎龄不同,发生率存在差异[2, 3, 4, 5]。 由于早产儿肺循环毛细血管通透性高、心力储备 低、重要脏器对低灌注敏感,PDA 早产儿易发生 支气管肺发育不良(bronchopulmonary dysplasia,BPD)、肺出血、充血性心力衰竭、脑室周围白质 软化(periventricular leukomalacia,PVL)、坏死性 小肠结肠炎(necrotizing enterocolitis,NEC)、早产 儿视网膜病(retinopathy of prematurity,ROP)、早 产儿骨发育不良、肾功能不全等情况[6, 7]。此外,PDA 可以导致气管插管和机械通气时间延长及其 他相关问题,而早期关闭导管在心肺方面的正性 作用早有报道[8]。目前关于早产儿PDA 的治疗时 机选择有3 种:(1)无论是否有导管开放的证据,生后尽早预防性药物治疗;(2)无临床表现但超 声证实导管开放;(3)出现PDA 临床症状或明显 的血流动力学改变。治疗手段包括保守治疗、药 物治疗及手术结扎。一旦PDA 发生,保守治疗是 我们最先采取的措施,但对于不同胎龄、体重及 导管直径的早产儿,其效果尚不明确;早产儿动 脉导管的平滑肌过少,药物治疗的作用有限,其 副作用可能加重PDA 引起的重要脏器低灌注所致 的并发症,如肠缺血及坏死、脑室出血等;随着 对先天性心脏病的早期诊断及其病理生理学的深 入认识,外科手术逐渐成为早期治疗手段之一,随着心脏外科的发展,早产儿PDA 结扎术后并发 症发生率越来越低,但总体来说,外科手术的风 险仍较药物治疗高。本文主要针对25~34 周早产 儿PDA 的不同治疗方式进行探讨,包括对手术及 非手术治疗患儿的病史、临床资料、病死率及并 发症等相关因素的分析,同时总结手术治疗的经验。
1 资料与方法 1.1 研究对象选取2013 年1 月至2014 年12 月在中国医科 大学附属盛京医院收治的19 例行手术治疗的PDA 早产儿为手术组,同期未进行手术治疗的PDA 早产儿19 例为非手术组,所有患儿均在出现临床症 状后进行心脏超声检查,生后72 h 导管仍未自发性 关闭定义为PDA。入选标准:(1)胎龄25~34 周 (175~238 d);(2)PDA 直径≥ 2.0 mm;(3)排 除先天性紫绀型心脏病或48 h 内死亡的病例; (4)所有病例均出现导管开放的临床症状。
1.2 调查资料(1)病史资料:包括患儿胎龄、出生体重、 性别、1 min 及5 min Apgar 评分;孕母年龄及是否 有妊娠期高血压、妊娠期糖尿病、胎膜早破病史。
(2)临床资料:包括临床发现PDA 时间(表 现为听诊发现心脏杂音)、超声确诊PDA 时间、 手术时间、PDA 直径、左心房/ 主动脉根部(LA/ AO)比值、导管直径的平方/ 出生体重(d2/BW) 比值、辅助通气时间、是否药物治疗及是否存在 肺出血、新生儿呼吸窘迫综合征、早发型败血症、 晚发型败血症。其中手术治疗组中包括药物无效 组及直接手术组,药物无效组是指1~2 疗程药物 治疗后临床症状无缓解或加重的早产儿。
(3)死亡及主要合并症情况:包括死亡、脑 白质损伤、颅内出血、BPD、NEC 的发生情况。
1.3 检查仪器所有患儿均完善心脏超声及头部磁共振检查, 心脏超声采用GE voluson E8、GE V730 及Medison Accuvix 彩色超声诊断仪,头部磁共振检查采用 Philips Intera Achieva 3.0T 磁共振仪。
1.4 统计学分析采用SPSS 19.0 统计软件对数据进行统计学 分析,符合正态分布的计量资料以均数± 标准差 (x±s)表示,两组间比较采用t 检验;不符合正 态分布的计量资料以中位数(四分位间距)[P50(P25, P75)] 表示,两组间比较采用Mann-Whitney U 检 验;计数资料采用百分率(%)表示,两组间比较 采用χ2 检验或校正χ2 检验或Fisher 确切概率法, P<0.05 为差异有统计学意义。
2 结果 2.1 治疗方式及结局两组患儿在出现临床症状后均首先采用保守 治疗,包括控制液体量、维持恰当的血氧饱和度等。 手术组19 例患儿中,先应用布洛芬治疗无效后再行手术13 例,其中9 例使用布洛芬治疗1 疗程, 4 例治疗2 疗程(用法为首剂10 mg/kg 口服,首剂 后24 h、48 h 分别给予5 mg/kg 口服),术后因心 力衰竭死亡1 人;因存在用药禁忌而直接手术治 疗6 例。非手术组19 例患儿中,采用布洛芬治疗 6 例,均治疗1 疗程,无死亡病例。
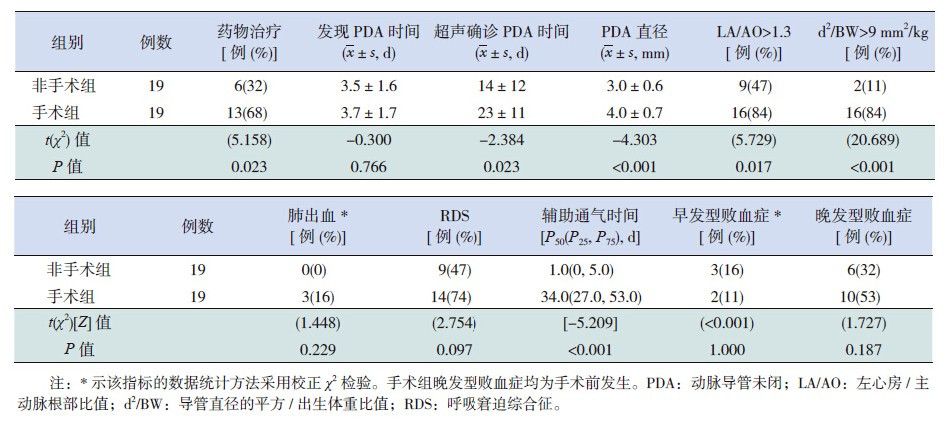
2.2 两组病史资料分析非手术组早产儿胎龄及出生体重均大于手术 组(P<0.01),且生后1 min 及5 min Apgar 评分 均高于手术组(P<0.05);而性别、胎膜早破发生 率及母孕期妊高症、糖尿病发生率在两组间比较 差异均无统计学意义(P>0.05)。见表 1。
| 表 1 两组病史资料比较 |
手术组患儿PDA 直径、超声确诊时间及辅助 通气时间均大于非手术组,且药物治疗、LA/AO 比值>1.3 及d2/BW 比值>9 mm2/kg 的发生率均高 于非手术组(P<0.05);而临床发现PDA 时间以 及肺出血、RDS、早发型败血症和晚发型败血症发 生率在两组间比较差异均无统计学意义(P>0.05)。 见表 2。
| 表 2 两组临床资料比较 |
手术组早产儿BPD 发生率高于非手术组 (P<0.01);而死亡、脑白质损伤、颅内出血和 NEC 发生率在两组间比较差异均无统计学意义 (P>0.05)。见表 3。
| 表 3 两组病死率及主要并发症比较 [ 例(%)] 组 |
一直以来,PDA 与早产儿病死率及不良预后 之间的关系是我们试图关闭动脉导管的原因。PDA 中导管水平的左向右分流引起肺血流量增加,从 而加重肺脏疾病,增加肺出血可能性,PDA 在早 产儿药物抵抗性低血压、肾功能损伤、颅内出血 及PVL[9] 中也是一项独立的危险因素。对于胎龄 小、低出生体重患儿的PDA 治疗尤为重要,这是 因为:(1)导管自发性关闭的几率非常低[10]; (2)对药物治疗的反应非常差[11];(3) 他们 更容易发生明显血流动力学异常,出现心肺合并 症[12]。本研究选择25~34 周的早产儿作为研究对 象,结果发现在胎龄及出生体重方面,两组患儿 有明显的统计学差异,手术组早产儿胎龄更小、 体重更低,与目前研究观点一致[13]。在孕母年龄、 妊娠期高血压、糖尿病及胎膜早破等孕期疾病史 方面,手术组与非手术组相比差异无统计学意义。 出生Apgar 评分手术组低于非手术组,考虑与手 术组患儿胎龄小,神经功能发育更不完善相关, 且Apgar 评分存在一定主观性,因此不能认为其与 PDA 是否需要手术治疗相关。
在PDA 用药时机方面,预防性应用药物未发 现明显短期及长期效果,目前新生儿医生不推荐 应用。对于超声诊断,临床无症状性PDA,目前 也不推荐使用布洛芬或吲哚美辛药物治疗。对于 有症状或影响血流动力学的PDA,目前倾向于保 守治疗失败后再应用药物治疗[14]。PDA 临床评估 包括心脏杂音、心率增快、心前区搏动增强、脉 压差增大及呼吸困难(对氧需求增加及通气条件 的反复调节)[15]。此外,影响血流动力学的PDA 也可以通过心脏超声诊断,需要满足以下标准: (1) 证实存在左向右分流;(2)LA/AO 比值 >1.3;(3) 导管直径>1.5 mm;(4) 心室舒张期主动脉存在双向双期分流[16]。本研究中所有患 儿导管直径均大于1.5 mm,非手术组9 例患儿 LA/AO 比值大于1.3,6 例临床症状表现为心脏 杂音及心率增快,接受药物治疗后好转。手术组 16 例患儿LA/AO 比值大于1.3,13 例接受药物治疗, 临床上除心脏杂音、心率增快外,心前区搏动增强、 肝脏增大、尿量减少及无法脱离辅助通气也为主 要表现。药物治疗均为保守治疗失败后进行。
尽管在PDA 管理上液体控制被广泛推荐[17], 但其利弊并无系统评估。液体限制可以减少循环 血量及肺循环负荷,从而提高呼吸功能[18],但同 时因为左心室前负荷降低,左心心排出量减少, 也可以引起系统血流量下降[19]。目前没有足够的 证据支持可以使用利尿剂预防及治疗血流动力学 显著的PDA(haemodynamically significant patent ductus arteriosus,hsPDA)引起的充血性心力衰竭。 恰当的氧合(SaO2 90%~95%,过高的SaO2 可导致 ROP 的发生)对于PDA 关闭有利,因此对于血氧 饱和度低于正常的早产儿,建议吸氧治疗,在一 项回顾性研究中[20],血氧饱和度83%~89% 组与 89%~94% 组相比,发生HS-PDA 的几率更高。药 物治疗中,吲哚美辛是目前在关闭导管中最为常 用的环氧化酶(COX)抑制剂,其疗效与胎龄、 出生体重有关。Gersony 等[21] 发现在使用吲哚美辛 的早产儿中,体重1 000~1750 g 的PDA 关闭率为 80%~86%,小于1 000 g 为54%。吲哚美辛的禁忌 症包括已经证实或高度怀疑的重症感染,NEC,活 动性出血尤其是胃肠道及颅内出血,凝血障碍, 血小板减少,肾功能不全以及导管依赖性的先天 性心脏病。另一种COX 抑制剂布洛芬越来越多的 应用于临床,研究表明1 疗程的布洛芬可以关闭 45%~92% 的导管,2 疗程及3 疗程的关闭率分别 为40%~54% 及19%~66%[22, 23, 24]。布洛芬的禁忌症包 括肾功能不全,高胆红素血症,胃肠道穿孔,严重的血小板减少[25]。与吲哚美辛相比,布洛芬在 导管关闭率、病死率、颅内出血及BPD 发生上无 差异,但肾毒性及外周血管收缩等方面的发生率 较低[26, 27],目前没有两者在长期神经系统预后方 面的差别比较。近几年来,扑热息痛作为前列腺 素合成酶抑制剂,成为另一类药物选择,在一项 胎龄24~32 周的早产儿研究中,其导管关闭率为 83.3%~100%[28, 29]。由于临床应用扑热息痛的资料 有限,其有效性及安全性仍有待评估。自1963 年 开展第1 例动脉导管结扎手术以来,许多作者提 出早产儿PDA 的外科手术治疗是安全有效的,但 仍可能存在一些短期合并症,如单侧声带麻痹、 横隔麻痹,术中出血,乳糜胸,气胸,术后短期 内的心肺功能不全,肾上腺功能障碍及脊柱侧弯 等。直到现在,关闭症状性PDA 的策略仍在讨论 中,标准尚未确定,关闭时间也存在争议[30],先 开始药物治疗还是手术治疗也很难决定[31],目前 手术治疗主要应用于药物治疗失败或存在药物禁 忌症的患儿,但手术时间仍存在争议。本研究中, 手术组13 例应用布洛芬治疗,非手术组6 例,两 组患儿统计学分析提示差异有统计学意义,手术 组药物治疗例数更多,考虑与手术组患儿PDA 临 床症状更明显、保守治疗效果不佳相关。在超声 确诊PDA 时间方面,非手术组更早,考虑与手术 组患儿胎龄小,生命体征不稳定,早期无法外出 进行超声检查相关。此外,手术组直径明显大于 非手术组,LA/AO 比值大于1.3 的病例更多,说明 直径大、症状性或血流动力学异常的PDA 自发关 闭的机会低,出现心肺功能障碍的可能性大,最 终接受手术治疗的可能性高。但应注意,由于早 产儿本身就容易存在呼吸暂停及对氧需求时间较 长等情况,如果超声显示导管直径小(<2 mm), 临床症状与导管的相关性较难把握,故本研究中 所选病例直径均≥ 2 mm。辅助通气时间手术组明 显高于非手术组,且手术组术前所有病例均未脱 离辅助通气,术后有2 例患儿分别在第18、31 天, 其余17 例患儿均在术后10 d 内停止辅助通气,提 示对于长期需要辅助通气的PDA 患儿,手术治疗 是最好的选择。此外,两组患儿在肺出血、RDS、 败血症的发生方面差异无统计学意义,但在晚发 型败血症中,手术组的发生率(53%)高于非手术 组(32%),考虑与手术组患儿胎龄较小,免疫功能更低,辅助通气时间长等因素相关,对于存在 绒毛膜羊膜炎及(或)败血症的早产儿,PDA 更 需积极治疗,因为败血症不仅减少导管自发性关 闭的可能性,也可以引发关闭导管的再开放[32]。 本研究中两组患儿在病死率、脑白质损伤、颅内 出血、NEC 的发生率上比较差异无统计学意义, 手术组患儿BPD 发生率更高,除考虑可能与该组 患儿PDA 直径大、分流量多相关外,胎龄小、机 械通气时间长也是其主要因素。
近年来,随着早产儿麻醉及围手术期管理的 进步,外科手术技术学及方法学的改进与完善, 外科手术已经成为PDA 早期治疗手段之一。有报 道提出如果接受2 个疗程的布洛芬治疗后仍存在 双向分流则应该进行手术治疗,否则PDA 的不良 预后发生率将随着时间的延长而增加[33]。也有研 究分析了导管直径和PDA 治疗疗效之间的关系, 以d2/BW 比值>9 mm2/kg 界定为手术治疗的参考[34]。 本研究中手术组16 例比值>9 mm2/kg,明显多于 非手术组,与上述研究相符。早期手术治疗可缩 短新生儿开始肠道内营养的时间,加快体重增长[1]。 但由于早产儿的解剖、生理发育不成熟,手术的 耐受性差,转运途中高危性,动脉导管组织菲薄, 稍有不慎就可能导致破裂,这些均为手术的限制 因素。随着心脏外科技术的发展,早产儿PDA 结 扎术后并发症发生率已经越来越低。本研究中手 术组患儿均顺利完成手术,1 例术前即存在反复心 功能衰竭,术后仍无法纠正死亡,1 例术后1 d 发 生左侧气胸,经胸腔闭式引流等处理后痊愈,其 余17 例患儿手术效果良好,心肺功能均得到了明 显改善,并逐渐脱离辅助通气和氧气,恢复正常 生长。本文通过19 例患儿的手术治疗,总结了一 定的经验。首先,术前新生儿科、心脏外科、麻 醉科共同会诊,对患儿手术风险充分评估;对合 并肺炎或其他感染的早产儿术前控制好感染;建 立静脉和动脉通路,方便术中监测相关指标。早 产儿体表面积相对较大,皮下脂肪少,易发生低 体温,需要注意从病房转移至手术室过程中的保 暖;同时在转运过程中配以监护设备,严密监测 患儿的生命体征。手术中根据早产儿的自身特点, 选择合适的手术器械,加强术中保暖,尽量缩短 手术时间。术中注意控制输液量及输液速度,避 免输液过快引起心衰。麻醉师密切监测心率、血压等指标,尤其是经皮血氧饱和度,早产儿略长 时间压迫左肺往往导致血氧下降,影响心肌收缩, 等麻醉师充分膨肺,血氧饱和度恢复正常后再继 续手术。同时还应当注意严格无菌操作,以降低 术后感染的发生率,保证治疗效果[35, 36]。术后转运 车送回新生儿病房,注意保暖,严密监测生命体征。 高血压是PDA 术后常见并发症,本研究手术组共 有3 例出现收缩压高于100 mm Hg,应用硝普纳持 续静脉输注后逐渐降至正常。此外需要严格控制 液体出入量,避免血流动力学波动,一般术后第1 天液体入量控制在每小时3~4 mL/kg,并严密观察 尿量及性状,每小时尿量应≥ 1 mL/kg,监测血气 分析,了解酸碱平衡及电解质情况。术后还容易 出现肺不张及气胸等肺部并发症,需密切观察肺 部体征,监测血氧饱和度,加强呼吸道管理,定 时翻身拍背,避免痰液粘堵。此外,由于手术创 伤使机体处于高代谢状态,能量消耗增加,需予 以营养支持,如果术前已经开始肠道喂养,一般 术后6 h 根据情况开始部分胃肠喂养,逐渐增加奶 量,能量不足部分肠外营养补足。心导管介入治 疗年长儿PDA 技术已经很成熟,早产儿PDA 介入 治疗的普及及规范化尚在探索中,需要对封堵器 进一步的设计和开发[37]。本研究中手术组接受手 术治疗时间为16~56 d,结局与非手术组差异不大。 目前国外对手术疗效研究的群体胎龄及体重均小 于国内,由于群体差异,手术风险性亦不同,因 此手术指征、时间选择和结局也可能会存在差异。
近年来,B 型利钠肽(B-typenatriuretic peptide,BNP)、B 型利钠肽原(proBNP) 和 N 端B 型利钠肽原(NT-proBNP) 开始在预测 hsPDA 发生方面发挥作用,Lee 等[38] 认为,出生 后24 h 血BNP 水平能预测hsPDA 的发生,出生 后24 h BNP 的阈值(cutoff level)为200 pg/mL 和 900 pg/mL,预测hsPDA 发生的敏感度分别为 83.9% 和54.8%,特异度则为61.9% 和95.2%。 在指导治疗策略选择上,Hsu 等[39] 指出高的基线 BNP 水平预示hsPDA 患儿对吲哚美辛的反应性差 而需要外科治疗,基线BNP 水平>1 805 pg/mL 预 测hsPDA 早产儿对吲哚美辛治疗无反应的敏感度 和特异度分别为88% 和87%。但是,BNP 和NTproBNP 的水平除受胎龄和日龄影响外,心功能 不全、肺动脉高压、败血症、BPD 等疾病同样对其测量值有影响;同时,由于测量方法和所用仪 器不同,正常测量值范围尚无统一标准。此外, Letzner 等[40] 在一项关于C 端内皮素原-1(CTproET- 1)的研究中认为,CT-proET-1 在确定早产 儿PDA 是否需要干预上有应用前景。生物标记物 在早产儿hsPDA 发生、药物治疗的反应及早产儿 PDA 治疗策略的选择上的作用值得我们进一步研 究。
早期PDA 治疗的策略应该根据临床、超声、 血流动力学的特点等进行个体化分析。对药物治 疗无好转或存在药物禁忌症者,尤其是胎龄小、 体重低、导管直径大、对血流动力学有影响、需 要长期机械通气的患儿,外科手术结扎是有效的 治疗方法。明确治疗时机,甚至跳过药物治疗环 节而直接接受手术治疗,既可避免药物治疗不良 反应发生,又减少因延误手术时机而造成的不良 后果。经过充分的术前准备,配合规范娴熟的外 科技巧,加强术后管理,PDA 手术治疗是安全可 行的。本研究由于总样本量及直接手术样本量较 少,对哪些早产儿适合直接手术治疗,哪些适合 药物治疗无效后行手术治疗未能进行分析,这将 是我们下一步研究的重点。
| [1] | Hsiao CC, Wung JT, Tsao LY, et al. Early or late surgical ligation of medical refractory patent ductus arteriosus in premature infants[J]. J Formos Med Assoc, 2009, 108(1):72-77. |
| [2] | Evans N. Preterm patent ductus arteriosus:should we treat it?[J]. J Paediatr Child Health, 2012, 48(9):753-758. |
| [3] | Clyman RI, Couto J, Murphy GM. Patent ductus arteriosus:are current neonatal treatment options better or worse than no treatment at all?[J]. Semin Perinatol, 2012, 36(2):123-129. |
| [4] | Meyer S. PDA in neonates-please doctor act individually![J]. Acta Paediatr, 2012, 101(4):145-146. |
| [5] | Schena F, Ciarmoli E, Mosca F. Patent ductus arteriosus:wait and see?[J]. J Matern Fetal Neonatal Med, 2011, 24(3):2-4. |
| [6] | Mezu-Ndubuisi OJ, Agarwal G, Raghavan A, et al. Patent ductus arteriosus in premature neonates[J]. Drugs, 2012, 72(7):907-916. |
| [7] | Saldeno YP, Favareto V, Mirpuri J. Prolonged persistent patent ductus arteriosus:potential perdurable anomalies in premature infants[J]. J Perinatol, 2012, 32(12):953-958. |
| [8] | Markham M. Patent ductus arteriosus in the premature infant:a clinical dilemma[J]. Newborn Infant Nurs Rev, 2006, 6(3):151-157. |
| [9] | Sarkar S, Dechert R, Schumacher RE, et al. Is refractory hypotension in preterm infants a manifestation of early ductal shunting?[J]. J Perinatol, 2007, 27(6):353-358. |
| [10] | Koch J, Hensley G, Roy L, et al. Prevalence of spontaneous closure of the ductus arteriosus in neonates at a birth weight of 1000 grams or less[J]. Pediatrics, 2006, 117(4):1113-1121. |
| [11] | Alexander F, Chiu L, Kroh M, et al. Analysis of outcome in 298 extremely low-birth-weight infants with patent ductus arteriosus[J]. J Pediatr Surg, 2009, 44(1):112-117. |
| [12] | Jhaveri N, Moon-Grady A, Clyman RI. Early surgical ligation versus a conservative approach for management of patent ductus arteriosus that fails to close after indomethacin treatment[J]. J Pediatr, 2010, 157(3):381-387. |
| [13] | Hammerman C, Aramburo MJ. Prolonged indomethacin therapy for the prevention of recurrences of patent ductus arteriosus[J]. J Pediatr, 1990, 117(5):771-776. |
| [14] | Abdel-Hady H, Nasef N, Shabaan AE, et al. Patent ductus arteriosus in preterm infants:do we have the right answers?[J]. Biomed Res Int, 2013, 2013:676192. |
| [15] | Davis P, Turner-Gomes S, Cunningham K, et al. Precision and accuracy of clinical and radiological signs in premature infants at risk of patent ductus arteriosus[J]. Arch Pediatr Adolesc Med, 1995, 149(10):1136-1141. |
| [16] | Lago P, Bettiol T, Salvadori S, et al. Safety and efficacy of ibuprofen versus indomethacin in preterm infants treated for patent ductus arteriosus:a randomised controlled trial[J]. Eur J Pediatr, 2002, 161(4):202-207. |
| [17] | Wyllie J. Treatment of patent ductus arteriosus[J]. Semin Neonatol, 2003, 8(6):425-432. |
| [18] | De Buyst J, Rakza T, Pennaforte T, et al. Hemodynamic effects of fluid restriction in preterm infants with significant patent ductus arteriosus[J]. J Pediatr, 2012, 161(3):404-408. |
| [19] | Bell EF, Acarregui MJ. Restricted versus liberal water intake for preventing morbidity and mortality in preterm infants[J]. Cochrane Database Syst Rev, 2014, (12):CD000503. |
| [20] | Noori S, Patel D, Friedlich P, et al. Effects of low oxygen saturation limits on the ductus arteriosus in extremely low birth weight infants[J]. J Perinatol, 2009, 29(8):553-557. |
| [21] | Gersony WM, Peckham GJ, Ellison RC, et al. Effects of indomethacin in premature infants with patent ductus arteriosus:results of a national collaborative study[J]. J Pediatr, 1983, 102(6):895-906. |
| [22] | Kushnir A, Pinheiro JM. Comparison of renal effects of ibuprofen versus indomethacin during treatment of patent ductus arteriosus in contiguous historical cohorts[J]. BMC Clin Pharmacol, 2011, 11:8. |
| [23] | Richards J, Johnson A, Fox G, et al. A second course of ibuprofen is effective in the closure of a clinically significant PDA in ELBW infants[J]. Pediatrics, 2009, 124(2):287-293. |
| [24] | van der Lugt NM, Lopriore E, Bokenkamp R, et al. Repeated courses of ibuprofen are effective in closure of a patent ductus arteriosus[J]. Eur J Pediatr, 2012, 171(11):1673-1677. |
| [25] | Keady S, Grosso A. Ibuprofen in the management of neonatal Patent Ductus Arteriosus[J]. Intensive Crit Care Nurs, 2005, 21(1):56-58. |
| [26] | Ohlsson A, Walia R, Shah SS. Ibuprofen for the treatment of patent ductus arteriosus in preterm and/or low birth weight infants[J]. Cochrane Database Syst Rev, 2010, (4):CD003481. |
| [27] | Jones LJ, Craven PD, Attia J, et al. Network meta-analysis of indomethacin versus ibuprofen versus placebo for PDA in preterm infants[J]. Arch Dis Child Fetal Neonatal Ed, 2011, 96(1):45-52. |
| [28] | Oncel MY, Yurttutan S, Uras N, et al. An alternative drug (paracetamol) in the management of patent ductus arteriosus in ibuprofen-resistant or contraindicated preterm infants[J]. Arch Dis Child Fetal Neonatal Ed, 2013, 98(1):94. |
| [29] | Oncel MY, Yurttutan S, Degirmencioglu H, et al. Intravenous paracetamol treatment in the management of patent ductus arteriosus in extremely low birth weight infants[J]. Neonatology, 2013, 103(3):166-169. |
| [30] | Hansen TW. Patency of the ductus arteriosus in the newborn-Now you want it, now you don't[J]. Pediatr Crit Care Med, 2007, 8(3):302-303. |
| [31] | Malviya M, Ohlsson A, Shah S. Surgical versus medical treatment with cyclooxygenase inhibitors for symptomatic patent ductus arteriosus in preterm infants[J]. Cochrane Database Syst Rev, 2008, (1):CD003951. |
| [32] | Schena F, Ciarmoli E, Mosca E. Patent ductus arteriosus:wait and see?[J]. J Matern Fetal Neonatal Med, 2011, 24(3):2-4. |
| [33] | Vida VL, Lago P, Salvatori S, et al. Is there an optimal timing for surgical ligation of patent ductus arteriosus in preterm infants?[J]. Ann Thorac Surg, 2009, 87(5):1509-1515. |
| [34] | Tschuppert S, Doell C, Arlettaz-Mieth R, et al. The effect of ductal diameter on surgical and medical closure of patent ductus arteriosus in preterm neonates:size matters[J]. J Thorac Cardiovasc Surg, 2008, 135(1):78-82. |
| [35] | 朱燕林, 郭立琳, 徐瑞燚, 等. 极低体重早产儿动脉导管未闭的治疗[J]. 临床心血管病杂志, 2011, 27(9):700-702. |
| [36] | Boo NY, Cheah IG. Risk factors associated with necrotising enterocolitis in very low birth weight infants in Malaysian neonatal intensive care units[J]. Singapore Med J, 2012, 53(12):826-831. |
| [37] | Baruteau AE, Hascoet S, Baruteau J, et al. Transcatheter closure of patent ductus arteriosus:past, present and future[J]. Arch Cardiovasc Dis, 2014, 107(2):122-132. |
| [38] | Lee JH, Shin JH, Park KH, et al. Can early B-type natriuretic peptide assays predict symptomatic patent ductus arteriosus in extremely low birth weight infants?[J]. Neonatology, 2013, 103(2):118-122. |
| [39] | Hsu JH, Yang SN, Chen HL, et al. B-type natriuretic peptide predicts responses to indomethacin in premature neonates with patent ductus arteriosus[J]. J Pediatr, 2010, 157(1):79-84. |
| [40] | Letzner J, Berger F, Schwabe S, et al. Plasma C-terminal proendothelin-1 and the natriuretic pro-peptides NT-proBNP and MR-proANP in very preterm infants with patent ductus arteriosus[J]. Neonatology, 2012, 101(2):116-124. |
 2015, Vol. 17
2015, Vol. 17