机械通气在新生儿重症监护病房(neonatal intensive care unit,NICU)已成为一种有效治疗呼 吸衰竭的手段,但气管插管是一种疼痛刺激,而 新生儿对疼痛的感知比婴儿和成人更弥漫、强烈 和持久,可使患儿烦躁不安,产生人机对抗[1]。疼 痛对于新生儿,尤其是接受大量致痛性操作的早 产儿和危重儿可造成一系列的近期和远期不良影 响,其中包括急性应激和对中枢神经系统的永久 损伤和情感紊乱等,反复有创操作产生的疼痛会 影响早产儿中枢神经系统的正常神经发育,使其皮质脊髓传导束结构发育异常,疼痛阈值降低[2], 易引起未成熟脑发育受损,表现为大脑皮层变薄[3]、 大脑白质及皮层下灰质成熟度异常及代谢异常[4]、 精神运动发育迟缓[5]、学龄期视觉感知障碍[6, 7]。 为提高我市NICU 救治患儿的生命质量,使新生儿 避免疼痛经历和减轻疼痛对新生儿生理的短期和 神经系统发育的长期影响,必须对新生儿疼痛进 行早期评估和有效的干预。
目前研究对新生儿期疼痛所导致患儿神经系 统发育的长期影响并未涉及。本文旨在对贵阳市 妇幼保健院NICU 行机械通气的新生儿进行疼痛评 估,并进行药物干预及长期随访,了解疼痛对新 生儿生理或神经系统发育的不良影响,从而提高 新生儿救治的生命质量。
1 资料与方法 1.1 研究对象选取2010 年12 月至2011 年2 月入住贵阳市 儿童医院NICU 行机械通气的新生儿30 例为研究 对象,其中男23 例,女7 例;胎龄为28~39 周; 出生体重1 050~4 070 g;生后1 min Apgar 评分为 2~10 分。所有患儿通气时间均在24 h 以上,疾病 包括:新生儿肺炎、新生儿呼吸窘迫综合征、新 生儿吸入性肺炎、新生儿湿肺。详细记录这些入选患儿的性别、胎龄、出生体重、疾病及病情程度、 日龄、母孕期合并症等一般情况。
1.2 分组将机械通气的30 例新生儿随机分为芬太尼 组和对照组,每组15 例,除常规治疗外,芬太尼 组先予芬太尼1 次静脉推注(2 μg/kg),推注时 间>10 min,然后予芬太尼静脉持续滴注(每小时 2 μg/kg),根据患儿疼痛的程度调整剂量;对照 组不使用镇痛剂。本研究已获得所有新生儿监护 人知情同意书。
1.3 生理指标在患儿接受机械通气时,记录两组患儿在用 药前、用药后30 min、2 h、4 h 的心率、呼吸频率、 血压及经皮氧饱和度的变化。
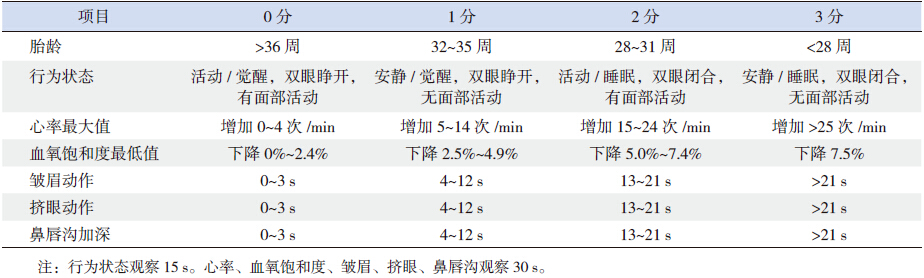
1.4 疼痛评价在患儿接受气管插管时,由经统一培训的固 定人员,在用药前,用药后30 min、2 h、4 h 采用 PIPP 评分表对疼痛进行评分并记录。新生儿PIPP 评分由3 个面部表情(皱眉、挤眼、鼻唇沟)、 2 个生理指标(心率和SpO2)、2 个相关指标(行 为状态、胎龄)共7 个指标组成。评分值为0~3 分, 早产儿总分为21 分,足月儿总分为18 分。6 分为 极微或没有疼痛,7~12 分为中度疼痛,>12 分为 重度疼痛,≥ 7 分则应镇痛治疗[8]。PIPP 具体内 容及评分标准见表 1。
| 表 1 PIPP 评分标准 |
对这30 例新生儿出院后3、6、9、12 月龄进 行随访,采用CDCC 婴幼儿智能发育量表测定其 智力发育指数(mental development index,MDI)和 精神运动发育指数(psychomotor development index, PDI),了解疼痛对患儿远期神经精神发育的影响。
1.6 统计学分析1.6 统计学分析 采用SPSS 11.0 统计软件对数据进行统计学分 析。计量资料以均数± 标准差(x±s)表示,两 组间比较采用t 检验,P<0.05 为差异有统计学意义。
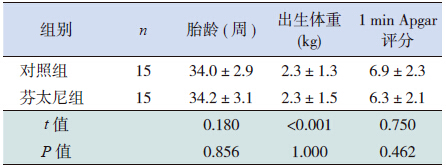
2 结果 2.1 两组患儿一般情况两组患儿胎龄、出生体重和生后1 min Apgar 评分比较差异无统计学意义(P>0.05),见表 2。
| 表 2 两组患儿一般情况比较 (x±s) |
两组患儿血压在用药前后均维持在正常范围, 没有发生低血压现象,统计学分析结果显示两组 患儿的血压在用药前后比较差异均无统计学意义 (P>0.05),见表 3。
| 表 3 两组患儿平均动脉压变化比较 (x±s,mm Hg) |
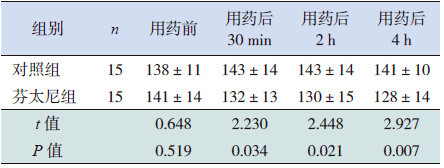
两组患儿用药前心率比较差异无统计学意义 (P>0.05),芬太尼组在用药后30 min、2 h、4 h 心率均低于对照组(P<0.05),见表 4。
| 表 4 两组患儿心率变化比较 (x±s,次/min) |
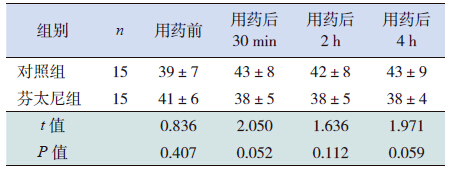
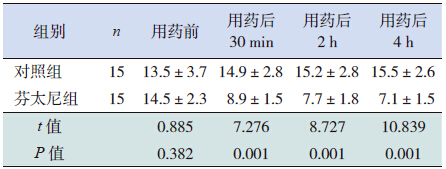
两组患儿在用药前和用药后30 min 呼吸频 率比较差异无统计学意义(P>0.05),芬太尼组 患儿在用芬太尼后2 h、4 h 呼吸频率低于对照组 (P<0.05),见表 5。
| 表 5 两组患儿呼吸频率变化比 (x±s,次/min) |
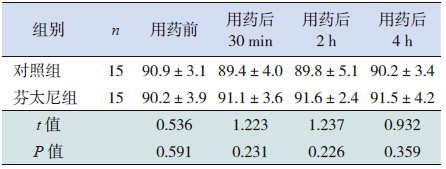
两组患儿的经皮氧饱和度在用药前后均维持 在正常范围,芬太尼组的经皮氧饱和度在用药前 后较对照组稍高,但差异无统计学意义(P>0.05), 见表 6。
| 表 6 两组患儿经皮氧饱和度的比较 (x±s,%) |
两组患儿用药前PIPP 评分比较差异无统计学 意义(P>0.05),芬太尼组在使用芬太尼后各时间 点PIPP 评分逐渐降低,与对照组相比差异有统计 学意义(P<0.01),见表 7。
| 表 7 两组患儿PIPP 评分比较 (x±s) |
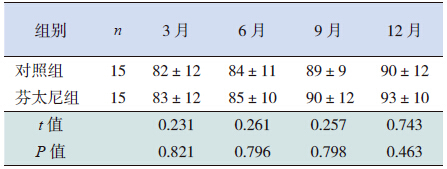
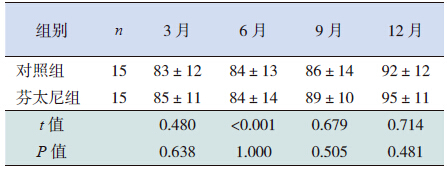
两组患儿在3、6、9、12 月龄时随访MDI 和 PDI 显示:芬太尼组MDI 及PDI 均高于对照组, 但差异均无统计学意义(P>0.05)。见表 8~9。
| 表 8 机械通气后两组患儿各月龄MDI 比较 (x±s) |
| 表 9 机械通气后两组患儿各月龄PDI 比较 (x±s) |
有研究报告指出,收入NICU 的新生儿中有 27%需要呼吸支持[9],虽然机械通气的开展大大提 高了病人的存活率,但研究表明机械通气对于新 生儿来说不仅是一种不愉快的疼痛经历,也是一 种刺激源,甚至是潜在的的危险因素[10]。有研究 发现,机械通气会使新生儿产生一系列的病理生 理反应,如心率增快,血压、颅内压升高,一过 性氧饱和度下降,甚至诱发颅内出血、神经系统 发育不良等[11]。新生儿在机械通气时常有鼻唇沟 加深、蹙眉等痛苦表情,以及烦躁不安、人机对 抗等表现,并伴有唾液皮质醇和血儿茶酚胺水平 升高[12]。研究表明,机械通气能激活下丘脑-垂 体-肾上腺轴,可能与患儿成年后心血管疾病和2 型糖尿病的发生有关[13]。这种疼痛经历不仅对新 生儿的急性疾病转归带来不良影响,还会给新生 儿长期的神经系统发育等带来不良后果。因此, 减少机械通气中患儿的疼痛感是综合治疗的重要 部分,减少疼痛不仅可以减少人机对抗,更能改 善远期神经发育预后。
目前人们对于机械通气的镇痛研究最广泛、 最深入的是阿片类药物吗啡和芬太尼。芬太尼是 一种合成的苯基哌啶类药物,对心血管系统影响 小,对呼吸抑制轻微,在新生儿体内蛋白结合率 低,比吗啡起效快、代谢时间短、适用范围广, 而且没有吗啡的低血压等副作用[14]。其作用机 制可能与抑制促肾上腺皮质激素的分泌而使内分 泌系统较少地对疼痛发生反应有关,每小时0.5~ 2 μg/kg 输注量可止痛,芬太尼除了具有镇痛等作 用外,同时伴有许多不良反应,如胸壁僵硬、尿 潴留和低血压等,以及阿片类药物共有的成瘾性、 依赖性和戒断反应等。但在本研究中并未出现这 些不良反应,说明本研究药物剂量及给药间隔时 间均在安全范围内,同时考虑亦与积极有效的护 理有关,即在充分保障了用药效果的同时,尽可 能的减少了对新生儿的伤害。
Stoppa 等[15] 对18 例机械通气新生儿用小剂 量持续静脉滴注瑞芬太尼,发现注射药物半小时 后,患儿心率下降、血氧饱和度上升,而且在整 个静脉滴注过程及以后均未发生不良反应。本研 究同样显示,芬太尼组患儿呼吸、心率均较对照 组明显下降,而经皮氧饱和度较对照组而言虽无 统计学意义上的显著性差异,但仍呈现上升趋势, 说明芬太尼能有效缓解机械通气新生儿的疼痛反 应,而且芬太尼在镇痛的同时具有一定的镇静作 用,减轻疼痛所带来的心率加快、烦躁不安、氧 饱和度下降等不良影响,有利于临床治疗的顺利 完成,并尽可能地减少其他镇静药物的使用。本 研究结果亦与王均华等[16] 一致,即就新生儿而言, 芬太尼镇痛作用明显,能明显减轻患儿机械通气 状态下的烦躁不安,改善通气和换气功能,达到 辅助治疗的目的。
新生儿低血压是芬太尼引发的常见不良反应, 可能造成机体重要脏器灌流不足,尤其影响了大 脑和心脏的血液供应,亦可致内分泌紊乱、呼吸 窘迫等症[17]。
本研究两组患儿血压均维持在正常范围,未 显示芬太尼致血压差异,虽与陈春等[18] 研究结果 一致,但亦不排除与样本量过小等情况有关。研 究表明,母亲分娩过程中使用镇痛药物可加重芬 太尼的低血压反应,这在早产儿中更加明显,因此还需结合患儿在孕后期及分娩过程中母亲镇痛 药物的使用情况综合分析[19]。值得注意的是,芬 太尼半衰期较长,持续静脉滴注镇痛时应警惕蓄 积作用对患儿呼吸功能的影响[20],因此应当密切 观察患儿的临床表现,适时调整呼吸机参数及药 物剂量,参考药动学参数可能有益于指导临床芬 太尼的使用。
目前国内大部分医院在新生儿机械通气治疗 过程中的镇静剂剂量及使用时间均无详细规范和 说明,因此临床上选择可靠且有效的疼痛评估工 具十分重要。目前针对新生儿疼痛评估量表主要 基于对其行为和生理指标改变,本研究中使用的 PIPP 量表由加拿大Toronto 和McGill 大学制定, 主要通过观察新生儿行为及生理指标进行疼痛的 评估[8]。一项Meta 研究结果发现,与吗啡、咪达 唑仑等常规镇痛镇静药物相比,芬太尼在发挥镇 痛作用的同时,还能够减轻机械通气新生儿的行 为和生理学反应,并明显降低疼痛评分,结论是 对于新生儿镇痛而言,芬太尼可作为阿片类药物 的首选[21]。而在本研究中,对患儿使用芬太尼后 其PIPP 评分较对照组明显降低,因此同样认为芬 太尼对于新生儿镇痛的治疗有着重要意义。
新生儿在出生后一段时间神经系统仍在不断 发育,此时接受重复持续的伤害刺激可能使其应 急调控系统发生改变,影响脑部发育,而记忆生 命早期的疼痛经历将导致成年后疼痛行为反应能 力的异常。及早识别及减轻疼痛对于新生儿远期 预后极为重要,为了探讨机械通气疼痛刺激对患 儿身心发育的长期影响,本研究中使用CDCC 婴 幼儿智能发育量表对患儿进行随访。该量表是结 合我国儿童的实际情况编制而成的,是评价0~3 岁儿童智能发育的诊断性量表,用来评价和分析 儿童的早期发展[22],它用不同的发育指数MDI 和 PDI 对小儿的智能和神经精神运动发育水平作出评 价。本研究中对两组患儿在3、6、9 及12 月龄时 进行CDCC 检测,MDI 和PDI 结果表明,芬太尼 组的PDI 及MDI 均高于对照组,但两者间结果比 较差异并无统计学意义,分析其原因可能与随访 的患儿例数过少有关,有待临床较大样本研究。
综上所述,机械通气导致新生儿的“不愉快” 经历不仅表现为表情痛苦、烦躁不安、人机对抗 等,亦影响其神经系统发育,本研究认为芬太尼能够有效减少机械通气患儿的疼痛和不适感,保 证临床治疗的顺利完成,甚至可作为一种保护性 措施,有益于患儿远期生长发育。然而,在实际 医疗操作中还应加强对机械通气患儿的综合性管 理,如保暖、保静治疗及其他保护性护理操作等, 以求最大限度减少对患儿的有害刺激,这将有助 于维持患儿的安静状态,减少药物使用时间。此外, 最近还有研究发现使用芬太尼治疗的新生儿需要 更长的时间才能到达足量的肠道喂养,分析可能 与激活了胃肠道 μ 受体,导致喂养不耐受发生率 增加有关[23]。
总之,芬太尼可以作为机械通气新生儿的一 种常用治疗手段,但仍应注意用药期间的相关不 良发应,以及过度镇静后导致上机时间延长而由 此引发的住院费用过高、呼吸机相关肺炎发生率 增加等情况,故仍需要临床医生密切关注患儿的 表现,积极评估用药效果并适时停药。
| [1] | Nemergut ME, Yaster M, Colby CE. Sedation and analgesia to facilitate mechanical entilation[J]. Clin Perinatol, 2013, 40(3):539-558. |
| [2] | Zwicker JG, Grunau RE, Adams E, et al. Score for neonatal acute physiology-II and neonatal pain predict corticospinal tract development in premature newborns[J]. Pediatr Neurol, 2013, 48(2):123-129. |
| [3] | Ranger M, Chau CM, Garg A, et al. Neonatal pain-related stress predicts cortical thickness at age 7 years in children born very preterm[J]. PLoS One, 2013, 8(10):e76702. |
| [4] | Brummelte S, Grunau RE, Chau V, et al. Procedural pain andbrain development in premature newborns[J]. Ann Neurol, 2012, 71(3):385-396. |
| [5] | Grunau RE, Whitfield MF, Petrie-Thomas J, et al. Neonatal pain, parenting stress and interaction, in relation to cognitive and motor development at 8 and 18 months in preterm infants[J]. Pain, 2009, 143(1-2):138-146. |
| [6] | Doesburg SM, Chau CM, Cheung TP, et al. Neonatal painrelated stress, functional cortical activity and visual-perceptual abilities in school-age children born at extremely low gestation alage[J]. Pain, 2013, 154(10):1946-1952. |
| [7] | Walker SM. Biological and neurodevelopmental implications of neonatal pain[J]. Clin Perinatol, 2013, 40(3):471-491. |
| [8] | de Oliveira MV, de Jesus JA, Tristao RM. Psychophysical parameters of a multidimensional pain scale in newborns[J]. Physiol Meas, 2012, 33(1):39-49. |
| [9] | Johnston CC, Collinge JM, Henderson SJ, et al. A crosssectional survey of pain and pharmacological analgesia in Canadian neonatal intensive Cage units[J]. Clin J Pain, 1997, 13(4):308-312. |
| [10] | Bellù R, de Waal KA, Zanini R. Opioids for neonates receiving mechanical ventilation[J]. Cochrane Database Syst Rev, 2008, 23(1):CD004212. |
| [11] | Elserafy FA, Alsaedi SA, Louwrens J, et al. Oral sucrose and a pacifier for pain relief during simple procedures in preterm infants:a randomized controlled trial[J]. Ann Saudi Med, 2009, 29(3):184-188. |
| [12] | Anand KJ, Barton BA, McIntosh N, et al. Analgesia and sedation in preterm neonates who require ventilatory support:results from the NOPAIN trial. Neonatal Outcome and Prolonged Analgesia in Neonates[J]. Arch Pediatr Adolesc Med, 1999, 153(4):331-338. |
| [13] | Grunau RE, Haley DW, Whitfield ME, et al. Altered basal eortisol levels at 3, 6, 8 and 18 months in infants born at extremely low gestational age[J]. J Pediatr, 2007, 150(2):151-156. |
| [14] | Hall RW, Boyle E, Young T. Do ventilated neonates require pain management?[J]. Semin Perinatol, 2007, 31(5):289-297. |
| [15] | Stoppa F, PerroRa D, Tomasello C, et al. Low dose remifentanyl infusion for analgesia and sedation in ventilated newborns[J]. Minerva Anestesiol, 2004, 70(11):753-761. |
| [16] | 王均华, 王立, 王欣玲, 等. 瑞芬太尼应用于新生儿机械通气疗效差异性的Meta 分析[J]. 中国急救医学, 2013, 20(5):519-523. |
| [17] | Karlsen AP, Pedersen DM, Trautner S, et al. Safety of intranasal fentanyl in the out-of-hospital setting:a prospective observational study[J]. Ann Emerg Med, 2014, 63(6):699-703. |
| [18] | 陈春, 时亚平, 周微芬, 等. 芬太尼对机械通气早产儿的镇痛作用[J]. 中国临床药理学杂志, 2010, 26(6):413-416. |
| [19] | Tibboel D, Anand KJ, van den Anker JN. The pharmacological treatment of neonatal pain[J]. Semin Fetal Neonatal Med, 2005, 10(2):195-205. |
| [20] | 陈自励, 李凤英. 新生儿临床用药[M]. 第2 版. 北京:人民卫生出版社, 2008:157-158. |
| [21] | Aranda JV, Carlo W, Hummel P, et al. Analgesia and sedation during mechanical ventilation in neonates[J]. Clin Ther, 2005, 27(6):877-899. |
| [22] | 鲍秀兰. 新生儿行为和0-3 岁教育[M]. 北京:中国少年儿童出版社, 1996:120-211, 221-240. |
| [23] | Bellù R, de Waal K, Zanini R. Opioids for neonates receiving mechanical ventilation:a systematic review and metaanalysis[J]. Arch Dis Child Fetal Neonatal Ed, 2010, 95(4):F241-F251. |
 2015, Vol. 17
2015, Vol. 17