2. 桂林医学院附属医院病理科, 广西 桂林 541001;
3. 桂林医学院附属医院检验科, 广西 桂林 541001
手足口病(hand foot and mouth disease,HFMD) 是一种主要由肠道病毒71 型(enterovirus 71, EV71)和柯萨奇病毒A16 型(coxsackievirus A16, CA16)感染引起的好发于婴幼儿的传染病[1]。重 症病例可累及中枢神经系统、呼吸系统和循环系 统,出现脑干脑炎等并发症[2, 3],导致病人死亡。 本课题组既往研究表明,重症EV71 严重感染病例 存在着炎症反应综合征的临床表现[4]。有研究报 道,EV71 感染单核细胞可致Toll 样受体(toll like receptor,TLR)2、7、8 表达上调[5],但尚无体内 试验的报道。为探索TLR7、8 是否参与EV71 感 染病人的炎症反应综合征,本研究对EV71 重症感 染死亡病例脑和肺组织切片中TLR7、8 的表达状 况进行了研究。
1 资料与方法 1.1 研究对象选取2010 年3 月至2012 年11 月来自桂林市 各县市级医院因EV71 感染死亡并于本院病理科尸 检的9 例患儿为研究对象。所有死亡病例都具有 手足口病的临床表现,同时均经RT-PCR 法在肛 拭子中检测到EV71 病毒核酸,符合卫生部《肠道 病毒EV71 感染诊疗指南(2008 年版)》确诊标 准[6]。对照组为同期我院非感染死亡儿童病例7 例, 其中外伤后失血性休克死亡儿童4 例,先天性心 脏病死亡儿童3 例(猝死2 例,术后死亡1 例), 均未合并感染性疾病。本课题经桂林医学院附属 医院伦理委员会审核批准,所有死亡患儿家属均 已签署尸检知情同意书。
1.2 实验主要试剂兔抗人TLR7 单克隆抗体和兔抗人TLR8 单克 隆抗体(北京博奥森公司),羊抗鼠/ 兔快速免疫 组化MaxVision TM 检测试剂盒及DAB 显色试剂盒 (福州迈新生物技术开发公司)。
1.3 免疫组化尸检取肺、脑组织,中性甲醛固定,石蜡包 埋,3 μm 切片常规脱蜡。每例标本取3 张切片, 每连续切5 片取一张。免疫组化SP 法染色步骤严 格按照抗体说明书所附的免疫组化操作流程进行。 用已知的阳性组织做阳性对照,用PBS 代替一抗 作阴性对照。
1.4 结果判定Olympus 正置荧光显微镜下随机选取5 个不重 叠的高倍镜(×400)视野,免疫组化阳性结果(细 胞核或细胞质中出现棕黄色颗粒)的判定标准为: (1)阳性细胞的百分比:<1% 计0 分;1%~10% 计1 分;10%~30% 计2 分;31%~60% 计3 分; >60% 计4 分。(2)阳性细胞的染色强弱得分: 基本不着色计0 分;淡黄色计1 分;黄色或棕褐 色计2 分;深棕色计3 分。(1)+(2)即为标本 的免疫组化阳性表达水平评分:0~1 分为阴性(-), 2~3 分为弱阳性(+),4~5 分为阳性(2+),6~7 分为强阳性(3+)。所有切片均由课题组内的一 位病理科副主任医师和一位硕士研究生在不了解 患者临床资料的情况下独立观察判断,对独立判 断不一致的病例再共同进行观察。
1.5 图像处理分析每张切片随机选取5 个高倍镜视野拍照, 采用Image Pro Plus version 6.0(IPP)图像分析软 件,测定阳性信号积分光密度值(integrated optical density,IOD),对免疫组化结果进行半定量分析。
1.6 统计学分析采用SPSS 18.0 统计软件包对实验数据进行统 计学分析。非正态分布计量资料采用中位数(四 分位间距)[P50(P25,P75)] 表示,两个独立样本 的比较采用Mann-Whitney U 检验;EV71 组内不同 因子在相同组织中的表达比较采用配对样本比较 的Wilcoxon 符号秩检验,P<0.05 为差异有统计学 意义。
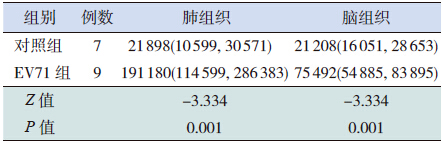
2 结果 2.1 TLR7 在肺和脑组织中的表达TLR7 在EV71 组和对照组肺、脑组织中均有 阳性表达。肺组织中TLR7 的阳性表达位于单核- 巨噬细胞、淋巴细胞胞浆,部分中性粒细胞也有 阳性表达,部分支气管壁上皮细胞、少数肺泡上 皮细胞亦显阳性。TLR7 在EV71 组肺组织中呈强 阳性表达,在对照组肺组织中呈弱阳性到阳性表 达。脑组织中TLR7 的阳性表达主要在神经细胞、 小胶质细胞以及部分淋巴细胞的胞浆。TLR7 在 EV71 组脑组织中呈强阳性表达,在对照组脑组织 中呈弱阳性表达(图 1)。EV71 组及对照组肺及脑组织TLR7 IOD 值见表 1,EV71 组TLR7 在肺和 脑组织中均呈强阳性高表达状态,与对照组比较 差异有统计学意义(P=0.001)。
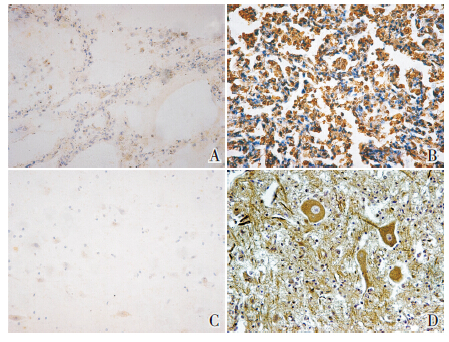 |
图 1 TLR7 在肺和脑组织中的表达(IHC,×400) A: 对照组肺组织;B:EV71 组肺组织;C: 对照组脑组织; D:EV71 组脑组织。TLR7 在EV71 组肺、脑组织中呈强阳性表 达,而在对照组肺、脑组织中呈弱阳性至阳性表达。棕黄色颗粒 系TLR7 阳性表达细胞。 |
| 表 1 TLR7 在肺和脑组织中的表达IOD 值 [P50(P25, P75)] |
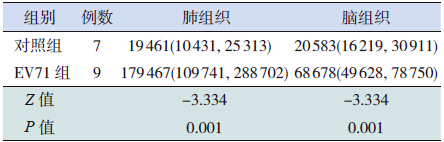
TLR8 在EV71 组和对照组肺、脑组织中均有 阳性表达。肺组织中TLR8 的阳性表达主要位于 炎症细胞的胞浆部分,呈棕色到棕褐色不等,少 许支气管壁肺泡上皮细胞也显阳性着色。TLR8 在 EV71 组肺组织中呈强阳性表达,在对照组肺组织 中呈弱阳性到阳性表达。脑组织中TLR8 的阳性 表达主要表现在神经细胞、胶质细胞以及部分淋 巴细胞的胞浆,呈棕黄色到棕褐色不等。TLR8 在 EV71 组脑组织中呈强阳性表达,在对照组脑组织 中呈弱阳性到阳性表达(图 2)。EV71 组及对照 组肺及脑组织TLR8 IOD 值见表 2,EV71 组TLR8 在肺和脑组织中均呈强阳性高表达状态,与对照 组比较差异有统计学意义(P=0.001)。
 |
图 2 TLR8 在肺和脑组织中的表达(IHC,×400) A:对照组肺组织;B:EV71 组肺组织;C:对照组脑组织;D: EV71 组脑组织。TLR8 在EV71 组肺、脑组织中呈强阳性表达, 而在对照组肺、脑组织中呈弱阳性至阳性表达。棕黄色颗粒系 TLR8 阳性表达细胞。 |
| 表 2 TLR8 在肺和脑组织中的表达IOD 值 [P50(P25, P75)] |
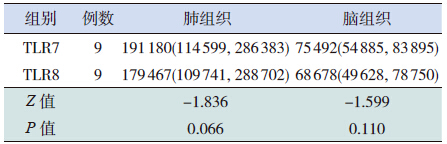
TLR7、8 在EV71 组的肺组织中均呈强阳性 表达,二者的IOD 值差异无统计学意义(P=0.066)。 TLR7、8 高表达于EV71 感染后的脑组织中,二者 的IOD 值差异亦无统计学意义(P=0.110)。见表 3。
| 表 3 TLR7、8 在EV71 组肺和脑组织中的表达比较 [P50(P25, P75)] |
EV71 是导致手足口病最主要的病毒, 2008~2009 年国家传染病信息管理数据显示轻症 手足口病EV71 阳性率为52.6%,重症者阳性率为83.5%,死亡患者阳性率为96.1%[7]。EV71 属于单 股正链小RNA 病毒,是小核糖核酸病毒科肠道病 毒属的成员。危重型手足口病的临床特征符合全 身炎症反应综合征(systemic inflammatory response syndrome,SIRS)的4 个诊断指标,EV71 脑干脑炎 合并肺水肿患儿的全身炎症反应往往伴随着异常 大量的IL10、IL13、INF-α 和IFN-γ 产生[8, 9, 10, 11]。越 来越多的研究表明重症EV71 感染合并肺水肿患 儿,既有促炎因子IL-1、IL-6、TNF-α、IFN-γ 释 放增加,也有抗炎因子IL-10、IL-13 分泌亢进及 CD3+、CD4+T 淋巴细胞、自然杀伤细胞(NK)等 细胞免疫的抑制[12, 13, 14]。TLRs 是一类重要的模式识 别受体,在人类有10 种,即TLR1~10[15]。在TLRs 家族中识别病毒的主要有TLR2、TLR3、TLR4、 TLR7/8、TLR9 等。TLR7/8 主要识别ssRNA 病毒, TLR3 识别dsRNA 病毒,TLR9 识别病毒的染色体 基因CPG DNA 序列,TLR2 和TLR4 也涉及病毒包 膜糖蛋白的识别[16, 17, 18]。已知鼻病毒、埃可病毒、 轮状病毒、柯萨奇病毒、禽流感病毒在不同的细 胞通过上调TLRs 表达诱导促炎因子产生,启动抗 病毒免疫或炎症反应[19, 20, 21, 22]。在EV71 感染中,TLRs 同样也能启动抗病毒免疫。Gong 等[5] 研究发现, 分别用活的EV71 病毒体外感染、紫外线灭活的 EV71 处理巨噬细胞,均可以使得TLR2、TLR7 和 TLR8 mRNA 的表达上调,还可以诱导巨噬细胞释 放前炎症细胞因子IL-1、IL-6、IL-8、TNF-α。认 为EV71 感染时,巨噬细胞通过TLRs 激活,诱导 产生大量促炎因子,参与EV71 感染炎症反应的病 理过程。
本研究发现TLR7、8 在EV71 感染后的肺组 织中的阳性表达均显著高于正常对照组中的肺组 织。TLR7、8 在EV71 组脑组织中的阳性表达均明 显高于对照组脑组织,推测TLR7、8 在EV71 感 染后的中枢神经系统及肺部病变中具有促进作用, 可能与EV71 感染所致手足口病的发病机制关系密 切,但其具体机制如何,仍需进一步探讨其下游 信号传导分子。
因本课题研究资源仅限尸体解剖肺、脑组织 蜡块,实验方法及所测因子尚不够全面,故研究 存在一定的局限性,我们下一步将从Toll 样受体 介导的炎症信号通路的角度,体外单核细胞株模 拟感染、患者血原代单核细胞分离培养及干预等多层次多方面进行研究。争取为EV71 感染所致手 足口病的临床诊治工作提供更多的理论及实验室 依据,为获得更多更有效的治疗措施开拓新的方 向。
| [1] | Zhu J, Luo Z, Wang J, et al. Phylogenetic analysis of Enterovirus 71 circulating in Beijing, China from 2007 to 2009[J]. PLoS One, 2013, 8(2):e56318. |
| [2] | 刘忠强, 李熙鸿, 王慧卿, 等. 重症手足口病患儿合并心肺功能衰竭的危险因素及治疗体会[J]. 中国当代儿科杂志, 2012, 14(8):589-592. |
| [3] | Zhang J, Sun J, Chang Z, et al. Characterization of hand, foot, and mouth disease in China between 2008 and 2009[J]. Biomed Environ Sci, 2011, 24(3):214-221. |
| [4] | Jiang M, Wei D, Ou WL, et al. Autopsy findings in children with hand, foot, and mouth disease[J]. Nengl J med, 2012, 367(1):91-92. |
| [5] | Gong X, Zhou J, Zhu W, et al. Excessive proinflammatory cytokine and chemokine responses of human monocyte-derived macrophages to enterovirus 71 infection[J]. BMC Infect Dis, 2012, 12:224. |
| [6] | 中华人民共和国卫生部办公室. 肠道病毒(EV71) 感染诊疗指南(2008 年版)[J]. 临床儿科杂志, 2008, 26(6):551-552. |
| [7] | Zhang J, Sun J, Chang Z, et al. Characterization of hand, foot, and mouth disease in China between 2008 and 2009[J]. Biomed Environ Sci, 2011, 24(3):214-221. |
| [8] | Wang SM, Lei HY, Huang KJ, et al. Pathogenesis of enterovirus 71 brainstem encephalitis in pediatric patients:roles of cytokines and cellular immune activation in patients with pulmonary edema[J]. J Infect Dis, 2003, 188(4):564-570. |
| [9] | Denizot M, Neal JW, Gasque P. Encephalitis due to emerging viruses:CNS innate immunity and potential therapeutic targets[J]. J Infect, 2012, 65(1):1-16. |
| [10] | Chen LC, Shyu HW, Chen SH, et al. Enterovirus 71 infection induces Fas ligand expression and apoptosis of Jurkat cells[J]. J Med Virol, 2006, 78(6):780-786. |
| [11] | Chen Z, Li R, Xie Z, et al. IL-6, IL-10 and IL-13 are associated with pathogenesis in children with Enterovirus 71 infection[J]. Int J Clin Exp Med, 2014, 7(9):2718-2723. |
| [12] | Wang SM, Lei HY, Huang MC, et al. Modulation of cytokine production by intravenous immunoglobulin in patients with enterovirus 71-associated brainstem encephalitis[J]. J Clin Virol, 2006, 37(1):47-52. |
| [13] | Wu J, Cui D, Yang X, et al. Increased frequency of circulating follicular helper T cells in children with hand, foot, and mouth disease caused by enterovirus 71 infection[J]. J Immunol Res, 2014, 2014:651872. |
| [14] | Li W, Teng G, Tong H, et al. Study on risk factors for severe hand, foot and mouth disease in China[J]. PLoS One, 2014, 9(1):e87603. |
| [15] | Jouhi L, Renkonen S, Atula T, et al. Different toll-like receptor expression patterns in progression toward cancer[J]. Front Immunol, 2014, 5:638. |
| [16] | Lu X, Xu Q, Bu X, et al. Relationship between expression of toll-like receptors 2/4 in dendritic cells and chronic hepatitis B virus infection[J]. Int J Clin Exp Pathol, 2014, 7(9):6048-6055. |
| [17] | Dhanasekaran S, Biswas M, Vignesh AR, et al. Toll-like receptor responses to Peste des petits ruminants virus in goats and water buffalo[J]. PLoS One, 2014, 9(11):e111609. |
| [18] | Ohto U, Shibata T, Tanji H, et al. Structural basis of CpG and inhibitory DNA recognition by Toll-like receptor 9[J]. Nature, 2015, 520(7549):702-705. |
| [19] | Triantafilou K, Orthopoulos G, Vakakis E, et al. Human cardiac inflammatory responses triggered by Coxsackie B viruses are mainly Toll-like receptor (TLR) 8-dependent[J]. Cell Microbiol, 2005, 7(8):1117-1126. |
| [20] | Triantafilou K, Vakakis E, Orthopoulos G, et al. TLR8 and TLR7 are involved in the host's immune response to human parechovirus 1[J]. Eur J Immunol, 2005, 35(8):2416-2423. |
| [21] | Xu J, Yang Y, Wang C, et al. Rotavirus and coxsackievirus infection activated different profiles of toll-like receptors and chemokines in intestinal epithelial cells[J]. Inflamm Res, 2009, 58(9):585-592. |
| [22] | Barjesteh N, Behboudi S, Brisbin JT, et al. TLR ligands induce antiviral responses in chicken macrophages[J]. PLoS One, 2014, 9(8):e105713. |
 2015, Vol. 17
2015, Vol. 17