2. 上海市儿童医院/上海交通大学附属儿童医院感染控制办公室, 上海 200062;
3. 上海市儿童医院/上海交通大学附属儿童医院信息科, 上海 200062
社区获得性肺炎(community-acquired pneumonia,CAP)是严重威胁儿童健康的常见病和 多发病之一。近几年,肺炎一直位列我国5 岁以 下儿童死因前5 位[1, 2, 3]。因此,明确儿童CAP 病例 的致病微生物构成、流行规律及临床特征,从而 寻求有效降低CAP 患病率和病死率的方法成为首 要任务。传统观念认为,CAP 的主要病原体为细菌, 随着抗菌药物的广泛应用以及肺炎链球菌疫苗接 种的普及,近年来的研究表明CAP 病原学中细菌 感染比例有所下降,而非典型病原体感染的比例 却根据检测方法的不同而大相径庭[4]。同时,由于 传染性非典型肺炎(SARS)、甲流及中东呼吸综 合征(MERS)的暴发流行使得病毒感染在CAP 中 也越来越受到重视。鉴于此,本研究对上海交通 大学附属儿童医院普陀院区呼吸科CAP 住院患儿 致病微生物的构成、在不同性别、年龄、季节间 的分布情况及其与临床特征的相关关系进行调查 和分析,旨在了解和探索该地区儿童CAP 病例的 病原学现况及临床特点,为制定儿童CAP 防控和 诊疗决策提供参考依据。
1 资料与方法 1.1 研究对象通过基于大数据的小儿CAP 临床诊断治疗决 策支持系统,选取2014 年5 月至2015 年5 月上海 交通大学附属儿童医院普陀院区呼吸科所有CAP 住 院患儿作为研究对象。CAP 诊断标准参考《儿童社 区获得性肺炎管理指南(2013 修订)》[5],同时排除: (1)支气管炎、支气管哮喘、支气管异物、肺结核、 肺部真菌病、肺寄生虫病、间质性肺疾病、免疫异 常性肺疾病、呼吸系统先天性肺疾病、肺部肿瘤、 肺炎合并脑膜炎等其他系统疾病的病例;(2)无 影像检查结果者;(3)病原学检测不完整的CAP 患儿;(4)接种肺炎链球菌疫苗后5 d 内患儿。
共1 155 例儿童CAP 病例纳入本研究,其中 男670 例(58.01%),女485 例(41.99%),男 女比例为1.38 : 1。患儿年龄为1 个月至14 岁,平 均年龄为3.1±2.8 岁。其中1 岁以下患儿338 例 (29.26%),1 岁~ 168 例(14.55%),2 岁~ 463 例(40.09%),6~14 岁186 例(16.10%)。 按照入院季节划分,春季(3~5 月)、夏季(6~8 月)、 秋季(9~11 月)、冬季(12~2 月) 的住院患儿 分别为214 例(18.53%)、241 例(20.87%)、 383 例(33.16%)、317(27.45%)例。
1.2 标本采集方法(1)痰标本:患儿于入院后第1 天、第2 天 由检验科专业技师使用无菌吸痰器采集急性期痰 液,置消毒试管内,并立即送检,行常规检测及 细菌培养。
(2)咽拭子:用压舌板轻压舌部,以轻快的 动作,迅速擦拭咽及两侧腭弓部的分泌物后,将 拭子插入试管中塞紧,并及时送检。
(3)肺泡灌洗液:留取行支气管肺泡灌洗的 患儿灌洗液5~6 mL,用于革兰染色、抗酸染色、 细菌培养和肺炎链球菌(SP)抗原检测。
(4)尿标本:留取患儿早晨清洁中段尿约 10~20 mL,置于无菌杯中,用于SP 尿抗原检测。
(5)血标本:入院 4 h 内采集静脉血用于 常规检测及相关病原学等检测;当患儿体温在 38℃ ~38.5℃之间并处于上升阶段时,同时采集双 份血标本用于血细菌培养。
1.3 病原学检测方法及阳性判定检测方法和结果判定均严格按照试剂盒说明书进行操作。
(1)肺炎支原体(MP)检测:同时采用间 接免疫荧光法(IFA)(试剂盒由郑州安图生物工 程股份有限公司提供)和被动凝集法(赛乐迪亚- 麦可Ⅱ诊断试剂盒,富士瑞必欧株式会社),若 血清MP-IgM 阳性和(或)急性期和恢复期双份血 清MP-Ab 呈4 倍以上升高或降低,则为MP 阳性。
(2)肺炎衣原体(CP)检测:仅采用IFA 法, 若血清CP-IgM 阳性,则为CP 阳性。
(3)呼吸道病毒检测:同时应用IFA 检测血 清腺病毒(ADV)、呼吸道合胞病毒(RSV)、流 感病毒A 型(INFA)、流感病毒B 型(INFB)和 副流感病毒1、2、3 型(PIVs)的IgM 抗体以及 酶联免疫吸附试验(ELISA)法(试剂盒由欧蒙医 学实验诊断股份公司提供)检测痰液中的上述病 毒。若其中一项检测方法结果显示阳性,则判定 该病原体阳性。
(4)细菌培养与检测:细菌培养均采用双 份血、肺泡灌洗液、痰和咽拭子标本进行培养, 即选取合格标本接种于血琼脂平板和巧克力平板 两种培养基(培养基均由赛默飞世尔生物化学制 品有限公司提供),置于37℃孵箱培养72 h 至 7 d。SP 检测的同时采用胶体金法(试剂盒由美艾 利尔公司提供)检测尿液、肺泡灌洗液中的SP 抗 原。将尿液、肺泡灌洗液中有一项SP 抗原检测结 果与细菌培养进行比对。培养细菌包括肺炎链球 菌、流感嗜血杆菌、肺炎克雷伯菌、金黄色葡萄 球菌、人葡萄球菌、表皮葡萄球菌、溶血葡萄球菌、 鲍曼不动杆菌、大肠埃希菌等(以下统称细菌)。 细菌培养结果与血常规、C 反应蛋白(CRP)、降 钙素原(PCT)等感染指标进行对比,同时结合临 床表现、影像学资料与治疗转归情况,综合评估 与判断细菌感染。
1.4 影像学资料入院病人均有胸部X 线检查和(或)肺部CT 影像学资料,均由2 位影像学医师阅片并与临床 医师共同评定影像学检查结果。
1.5 统计学分析数据采用SPSS 16.0 统计软件进行统计学处 理与分析。计量资料以均数± 标准差(x±s)表 示,计数资料以例数和百分率表示。两个或多个 样本率的比较采用χ2 检验,相关分析采用非条件 logistic 回归分析方法。P<0.05 为差异具有统计学 意义。
2 结果 2.1 标本收集情况(1)血标本:共1 155 份(100%)。其中血培 养801 份;MP-Ab、MP-IgM、ADV-IgM、RSV-IgM、 INFA-IgM、INFB-IgM 和PIVs-IgM 血清检测1 142 份; CP-IgM 检测1 155 份;MP-Ab 双份血清检测245 份。
(2)痰标本:共1 081 份(93.59%)。其中 细菌培养1 044 份,ADV、RSV、INFA、INFB 和 PIVs 检测1 010 份。
(3) 尿标本: 共947 份(81.99%),用于 SP 抗原检测。
(4)肺泡灌洗液标本:共81 份(7.01%)。 其中细菌培养80 份;ADV、RSV、INFA、INFB 和PIVs 检测37 份;SP 抗原检测41 份。
(5)咽拭子标本:共65 份(5.62%)。用于 细菌培养。
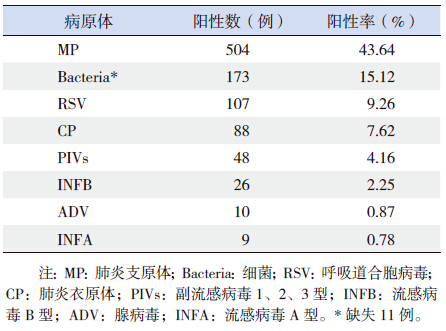
2.2 病原学检测结果在1 155 个样本中,病原学检测阳性数为 758 例,总阳性率为65.63%。其中,MP 检出率最 高(43.64%),排在第二位的是细菌(15.12%), RSV 和CP 的阳性率分别为9.26% 和7.62%;检出 阳性数最低的病原体是ADV 和INFA(表 1)。混 合感染病例为185 例,混合感染率为16.02%。其 中以MP 与CP 以及MP 与细菌的混合感染最常见, 各占混合感染病例的24.9%(46/185),排在第三 位的是MP 混合RSV 感染,占7.0%(13/185)。
| 表 1 病原学检测阳性率 (n=1 155) |
男女患儿的病原体检测阳性数分别为423 (63.1%)和335 例(69.1%),两者比较差异具 有统计学意义(χ2=4.397,P=0.036)。其中,男患 儿MP 阳性率低于女患儿(P=0.020);其余病原 体检出率,不同性别间比较差异未见统计学意义 (均P>0.05),见表 2。
| 表 2 不同性别患儿病原体感染情况 [n(%)] |
<1 岁组患儿的病原体阳性率最低,为51.8% (175 例),1 岁~ 组61.9%(104 例),2 岁~ 组 70.8%(328 例),病原体阳性率最高的是6~14 岁组, 为81.2%(151 例),各组间阳性率差异具有统计 学意义(χ2=55.317,P<0.001)。其中,MP 阳性 率为6~14 岁组最高,<1 岁组最低; 细菌、RSV 和PIVs 的检出率则以<1 岁组最高(表 3)。
| 表 3 不同年龄组病原学检测阳性率情况 [n(%)] |
不同季节总的病原体检出率分别为:春季147 例(68.7%),夏季157 例(65.1%),秋季247 例(64.5%),冬季207 例(65.3%),各季节间 比较差异无统计学意义(χ2=1.150,P=0.765)。其中, MP 检出率夏秋季明显高于春冬季;细菌和RSV 的 检出率则是春冬季明显高于夏秋季(表 4)。
| 表 4 不同季节病原学检测阳性率情况 [n(%)] |
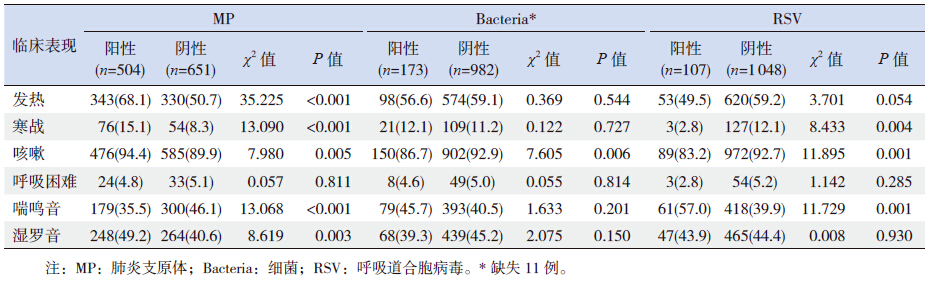
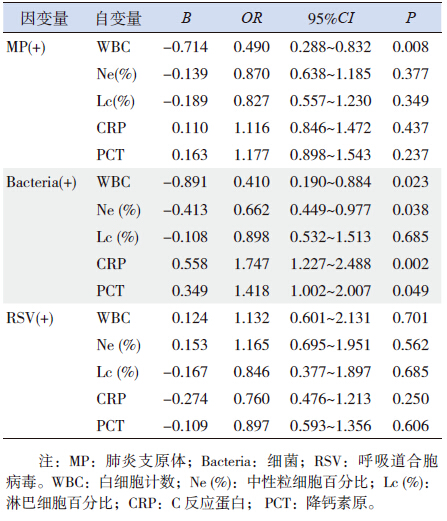
为了进一步探索CAP 患儿不同致病微生物感 染的临床特征差异,本研究分别对阳性率排在前3 位的MP、细菌、RSV 与临床表现、感染指标之间 的相关关系做了分析。结果显示,MP 阳性者中出 现发热、寒战、咳嗽、湿罗音的比例均高于阴性者; RSV 阳性者较阴性者更易出现喘鸣音;细菌检测 阳性者出现咳嗽的比例低于阴性(均P<0.05), 见表 5。从各项感染指标与MP、细菌、RSV 检出 之间的相关关系来看,在调整性别、年龄混杂因 素后,CRP、PCT 与细菌感染相关;WBC 计数与 MP 和细菌感染相关(表 6)。
| 表 5 MP、细菌和RSV 感染与临床表现之间的相关分析 [n(%)] |
| 表 6 MP、细菌和RSV 与感染指标之间的相关分析 |
近年来,国内对儿童CAP 病原学相关研究 不在少数,但大多数研究集中于采用单一IFA、 ELISA 或PCR(聚合酶链式反应)方法对血/ 鼻咽分泌物中致病微生物进行检测[6, 7]。方法学以及标 本类型的单一无疑会大大降低致病微生物检测的 灵敏度。因此,本研究采用多种病原学检测手段 联合使用的方法检测CAP 住院患儿血、痰液、咽 拭子、肺泡灌洗液及尿液中的常见呼吸道致病微 生物,不仅在一定程度上提高了病原体检出率, 有助于进一步明确儿童CAP 致病微生物的构成, 同时也加强了本研究结果的真实性、可靠性。
本研究结果显示,1 155 例CAP 住院患儿的 病原学检测总阳性率为65.63%。其中MP 的检 出率为43.64%,该比例接近于同年南京[6] 和广 西[8] 的研究报道( 分别为40.78% 和45.4%), 而高于2013 年文献报道的13.53%[7] 和2014 年的 28.66%[9]。说明近年来MP 在我国儿童CAP 致病微 生物中占主要,且感染率呈现上升趋势。这一结 果不仅向临床工作者提示了儿童CAP 病原谱的变 迁,更有助于其正确选择初始抗菌药物,做出最 佳诊疗决策。从致病微生物在不同性别间的分布 上来看,女患儿的MP 感染率高于男患儿(47.6% vs 40.8%),而其余致病微生物在不同性别间的检 出率均无差别,这可能与不同性别对MP 的易感 性不同有关。MP 在5 岁以上儿童中的检出率高于 幼儿,且夏秋季高于春冬季,与以往研究结果一 致[7]。这提示公共卫生部门要警惕夏秋季节学校等学龄期儿童聚集地发生MP 感染的流行和暴发。 与MP 的流行特征不同的是,RSV 则在1 岁以下婴 儿中的检出率明显高于大龄儿童,且春冬季高于 夏秋季。尽管本研究中RSV 的检出率不到10%, 但是已有研究结果表明,RSV 是1 岁以下婴儿重 症肺炎的危险因素(OR=1.672)[10],且RSV 阳性 者48 h 内发生肺炎治疗失败的风险远高于阴性者 (RR=1.85)[11],需引起儿科医生的关注。此外, 从不同致病微生物的临床特征来看,MP、RSV 阳 性与阴性患儿在发热、咳嗽以及肺部听诊等方面 均有一定差异。这可能对临床诊治具有一定的参 考价值。尤其是RSV 阳性的CAP 患儿出现喘息的 比例高于阴性者,同时传统的感染指标(如血常 规、CRP、PCT 等)亦不能指示RSV 感染与否。 这提示儿科医生在面对1 岁以下喘息患儿时,需 做好鉴别诊断。近年来国内研究报道儿童CAP 病 例痰培养的细菌检出率较高(2010 年:26.4%[12]; 2013 年:35.38%[13])。然而,本研究尽管采用了 多种标本进行细菌培养及SP 抗原检测联合的方 法,细菌阳性率也仅为15.12%。这一结果可能与 患儿入院前的抗生素使用有关,也可能在一定程 度上提示了国内CAP 患儿细菌感染率呈现了下降 趋势。相关分析结果表明,传统反映全身感染的 指标,如CRP、PCT 等,与MP 和RSV 的感染并 不存在关联性,但对于细菌感染有较好的指示作 用。这对于临床精准使用抗菌素具有一定的指导 意义。本研究中CAP 患儿的病原体混合感染率为 16.02%。其中以MP 合并CP、细菌或RSV 较常见。 国外文献报道,非典型病原体与呼吸道病毒的混 合感染是重症肺炎的重要危险因素(OR=4.36)[14]。 因此,临床上需特别关注1 岁以下RSV 阳性CAP 患儿,尤其是病原学检测提示混合感染,做到及 早治疗,降低重症肺炎的发生率。同时也进一步 提示了MP 感染在儿童CAP 中占据着越来越重要 的地位。
本研究通过基于大数据的小儿CAP 临床诊断 治疗决策支持系统选取研究对象,不仅实现了临 床数据收集和管理的完整性与高效性,也保证了数据分析结果的准确性和可靠性。同时,研究结 果除了有助于指导临床诊疗、儿童呼吸道感染监 测及疫苗研制等方面外,对数字化小儿CAP 临床 诊断治疗标准化的建立、完善和推广也具有重要 意义。
| [1] | Rudan I, Chan KY, Zhang JS, et al. Causes of deaths in children younger than 5 years in China in 2008[J]. Lancet, 2010, 375(9720):1083-1089. |
| [2] | 冯江, 袁秀琴, 朱军, 等. 中国2000-2010 年5岁以下儿童死亡率和死亡原因分析[J]. 中华流行病学杂志, 2012, 33(6):558-561. |
| [3] | 邵瑜, 韩萍. 2008-2014 年北京市海淀区5岁以下儿童死亡监测分析[J]. 疾病监测, 2015, 30(4):325-328. |
| [4] | Musher DM, Thorner AR. Community-acquired pneumonia[J]. N Engl J Med, 2014, 371(17):1619-1628. |
| [5] | 中华医学会儿科学分会呼吸学组. 儿童社区获得性肺炎管理指南(2013 修订)( 上) [J]. 中华儿科杂志, 2013, 51(10):745-752. |
| [6] | Chen K, Jia R, Li L, et al. The aetiology of community associated pneumonia in children in Nanjing, China and aetiological patterns associated with age and season[J]. BMC Public Health, 2015, 15:113-118. |
| [7] | 柯莉芹, 王凤美, 李银洁, 等. 儿童肺炎支原体肺炎流行病学特征[J]. 中国当代儿科杂志, 2013, 15(1):33-36. |
| [8] | 陈刚, 韦欢, 何永玲, 等. 儿童非典型肺炎病原体免疫球蛋白检测及病原学分析[J]. 中华医院感染学杂志, 2015, 25(5):1172-1174. |
| [9] | 郭磊, 丁效国. 儿童社区获得性肺炎病原学调查及耐药性分析[J]. 儿科药学杂志, 2014, 20(7):42-45. |
| [10] | 丁小芳, 张兵, 钟礼立, 等. 儿童重症社区获得性肺炎病毒学检测和危险因素分析[J]. 中国当代儿科杂志, 2012, 14(6):449-453. |
| [11] | Kelly MS, Smieja M, Luinstra K, et al. Association of respiratory viruses with outcomes of severe childhood pneumonia in Botswana[J]. PLoS One, 2015, 10(5):e0126593. |
| [12] | 王应建, 刘洁, 方芳, 等. 儿童社区获得性肺炎病原微生物分布研究[J]. 中国当代儿科杂志, 2010, 14(6):449-453. |
| [13] | 刘翔腾, 王桂兰, 罗序锋, 等. 儿童社区获得性肺炎病原微生物分布特点分析[J]. 中国当代儿科杂志, 2013, 12(3):184-187. |
| [14] | Huong Ple T, Hien PT, Lan NT, et al. First report on prevalence and risk factors of severe atypical pneumonia in Vietnamese children aged 1-15 years [J]. BMC Public Health, 2014, 14:1304-1311. |
 2015, Vol. 17
2015, Vol. 17