2. 上海市出生缺陷重点实验室, 上海 201102
心室肌致密化不全(noncompaction of the ventricular myocardium,NCVM)是一种少见的先天性心室肌发育不全性心脏病。心肌的致密化是正常的人类心脏胚胎发育过程。在人类胚胎的第6周,心脏内出现丰富的肌小梁;胚胎第12周,肌小梁开始致密化;胚胎第18周,肌小梁的致密化过程完成[1]。若致密化过程受阻,则导致肌小梁疏松,形成过度突出的肌小梁和深陷的小梁间隐窝。1975年,Dusek等[2]首先报道了出生后持续存在的海绵样心肌;1984年,Engberding等[3]首先采用经胸二维超声心动图对此类患者进行了产前诊断;1990年,Chin等[4]首先提出“NCVM”的命名以及超声心动图诊断标准。2006年美国心脏病学会(AHA)将NCVM归类为原发性的遗传性心肌病[5],2008年欧洲心脏病协会(ESC)将NCVM归为未分类的遗传性心肌病[6]。NCVM主要的临床表现包括心功能不全、心律失常、血栓和栓塞。既往,由于认知不足而导致NCVM的漏诊或误诊;近年来,随着人们对NCVM认识的逐渐增加,则出现了由于诊断标准不统一而导致NCVM的过度诊断。Kohli等[7]发现,既往研究中[4, 8, 9]关于NCVM的诊断标准之间相关性差,在199例患者中,仅29.8%同时符合上述3个不同文献中的诊断标准。尽管目前NCVM的诊断标准仍存在争议,但基于Paterick等[10]的测量方法与心脏磁共振诊断NCVM的相关性好,因此,本研究采用该方法对NCVM患儿进行诊断,旨在阐明NCVM的超声心动图特征。
1 资料与方法 1.1 研究对象选取2006年5月至2015年5月,在我院接受超声心动图检查、且诊断为NCVM 的患儿53例为研究对象,其中男28例,女25例,首次诊断年龄为15 d至18岁。
1.2 仪器与方法采用Philips/iE33超声诊断仪(Philips Ultrasound,USA)或GE/Vivid 7超声诊断仪(GE Healthcare,USA),探头频率4~12 MHz。在安静状态下(不合作的患儿予以10%水合氯醛口服镇静,剂量为25 mg/kg),患儿取仰卧位或半左侧卧位接受超声心动图检查。调整频率、聚焦、增益等技术设置以获得最佳的超声心动图图像。采用经胸二维超声心动图多个切面观、并叠加彩色多普勒进行诊断。采用M型超声Teichholtz法测量左室射血分数以评价心功能。
1.3 诊断标准定性诊断标准:过度突出的肌小梁和深陷的小梁间隐窝,且心腔内的血流与肌小梁间的隐窝互相沟通。定量诊断标准:采用Paterick等[10]的测量方法,即在舒张末期,于胸骨旁心室短轴切面观、同一心肌节段测得的疏松部(N)/致密部(C)比值≥2,作为NCVM的定量诊断标准;N定义为肌小梁顶部与心外膜表面之间的距离,C定义为隐窝底部与心外膜表面之间的距离。
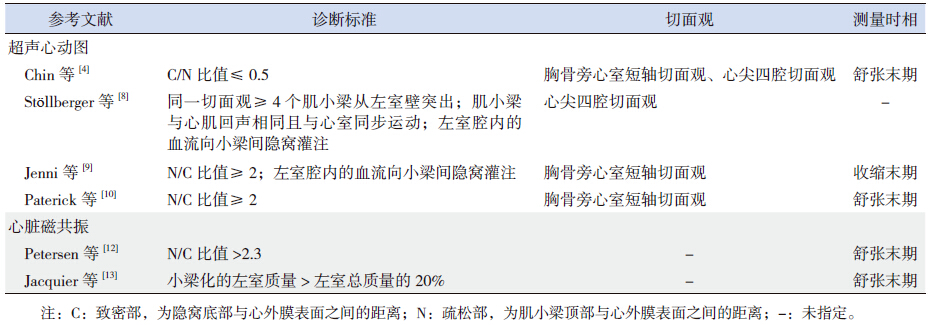
2 结果 2.1 超声心动图对NCVM的定性诊断在53例NCVM 患儿中,单纯性NCVM 41例(77%),合并先天性心脏病12例(23%)。合并的先天性心脏病包括室间隔缺损4例、房间隔缺损2例、动脉导管未闭2例、先天性纠正型大动脉换位伴Ebstein畸形1例、主动脉缩窄1例、主动脉瓣狭窄1例、完全性房室间隔缺损1例。二维超声心动图均观测到过度突出的肌小梁和深陷的小梁间隐窝,彩色多普勒显示心腔内的血流与肌小梁间的隐窝互相沟通(图 1),隐窝内的血流不与冠状循环相通。NCVM累及的部位依次是心尖部(100%)、左室侧壁中间段(98%,52/53)、左室后壁中间段(49%,26/53)、左室下壁中间段(42%,22/53)、室间隔中部(34%,18/53)、左室侧壁基底部(32%,17/53)、左室后壁基底部(23%,12/53)、左室下壁基底部(23%,12/53)、室间隔基底段(11%,6/53)和右室游离壁(9%,5/53)。
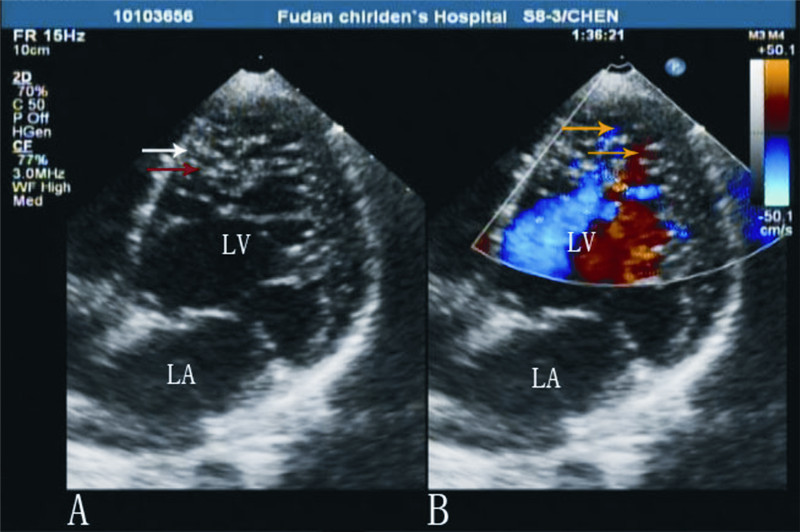 |
图 1 NCVM 的超声心动图表现 心尖部四腔切面观,A:二维超声心动图,显示过度突出的肌小梁(红色箭头所示)和深陷的小梁间隐窝(白色箭头所示);B:叠加彩色多普勒,显示心腔内的血流与肌小梁间的隐窝互相沟通(黄色箭头所示)。LA:左心房;LV:左心室。 |
在舒张末期,采用胸骨旁心室短轴切面观,测量同一心肌节段的N/C比值(图 2)。53例NCVM患儿的N/C比值为4.3±1.9(2.1~10.0)。
 |
图 2 超声心动图测量NCVM患儿的N/C比值 舒张末期心室短轴切面观;LV:左心室;P1:后内侧乳头肌;P2:前外侧乳头肌;N:疏松部;C:致密部。 |
在53例NCVM患儿中,44例伴有心功能不全(83%),这些患儿的左室射血分数为43%±9%(正常值≥55%)。在心功能不全的NCVM患儿中,均有左室内径增大,并伴有二尖瓣功能性反流。
3 讨论NCVM是先天性的心肌发育不全性心脏病,应在儿童早期得到诊断,使之获得规范化的治疗和随访管理,从而改善患者的预后。超声心动图、心室造影、心脏磁共振、多层螺旋CT、核素显像等心血管影像技术均可观察心肌的形态,其中,超声心动图具有无创伤性、方便、价廉的优势,在NCVM的首次诊断与随访中具有重要的价值,是诊断NCVM最常用的影像学诊断工具[11]。
NCVM具有特征性的超声心动图表现,包括过度突出的肌小梁和深陷的小梁间隐窝。但是,学者们对NCVM的诊断标准目前尚未取得共识,存在多个超声心动图和心脏磁共振的诊断标准,在测量的心动周期时相、选择的切面观和具体的诊断指标方面,均存在争议[4, 8, 9, 10, 12, 13](表 1)。我们采用Paterick等[10]的方法,即在舒张末期、在胸骨旁心室短轴切面观、同一心肌节段的N/C比值≥2,作为诊断NCVM的定量诊断标准。理由是,采用舒张末期作为测量的时相,与美国超声心动图学会(ASE)推荐的在舒张末期测量室壁厚度的建议一致[14]。此外,Paterick等[10]发现,在NCVM患者中,疏松部的心肌收缩力减弱,即舒张末期与收缩末期的疏松部心肌厚度变化较小;而致密部的心肌收缩力尚在一定程度上保存,即收缩末期致密部的心肌厚度较舒张末期有较明显的增厚。因此,若采用收缩末期作为测量时相[8],敏感性相对降低、特异性相对增高;而采用舒张末期作为测量时相[4, 10],则敏感性相对增高、特异性相对降低。同时,Paterick等[10]发现,在胸骨旁心室短轴切面观测量舒张末期N/C比值≥2作为诊断标准,与心脏磁共振的诊断相关性好。由于NCVM的诊断缺乏“金标准”(例如可信的生物标志物等),很难评判哪种诊断标准更准确。我们建议,调整频率、聚焦、增益、亮度、对比度等技术设置以获得最佳的超声心动图图像,采用胸骨旁左心长轴、心尖四腔以及心室短轴等多个切面观、在不同的心肌节段水平探测心肌的厚度和形态,运用彩色多普勒技术显示心腔内的血流状况,在舒张末期选用心室短轴切面观测量N/C比值。值得强调的是,必须获得标准的心室短轴切面观以显示一个圆形的左室腔,因为在斜切获得的椭圆形图像上测量N/C比值可能会导致假阳性的结果。此外,勿将正常心脏的乳头肌和心尖部的心肌误认为未致密化的心肌。
| 表 1 NCVM不同的超声心动图和心脏磁共振诊断标准 |
由于胚胎期致密化过程的停滞阶段有个体差异,因此,未致密化的心肌节段亦存在差异。但是,NCVM累及的心肌节段有一定的分布规律。Oechslin等[15]的研究显示,NCVM累及心尖部、左室中部侧壁和下壁最常见,其次是左室中部前壁、室间隔中部,累及基底部较少见,未见累及右室。本研究显示,NCVM累及心尖部和左室侧壁中间段较常见,基底部较少见,亦有累及右室游离壁、但很少见。这种分布规律符合心肌致密化的胚胎发育过程,即心肌的致密化过程从右室到左室、从心底到心尖、从心外膜到心内膜[16]。理解NCVM的上述分布规律可避免漏诊。
除了心肌形态诊断,对NCVM患者心功能的判断也很重要。心功能状况取决于心脏的前、后负荷以及心肌的运动能力,若心肌形态结构异常,必然会影响心肌的收缩和舒张、进而影响心功能。Sousa等[17]在10例NCVM患者中,发现7例伴有左室收缩功能不全,占70.0%。刘保民等[18]在55例NCVM患者中,发现45例伴有左室收缩功能不全,占81.8%,这些患者的左室射血分数为(35±9)%。本研究显示,在53例NCVM患者中,44例伴有左室收缩功能不全,占83%,这些患者的左室射血分数为43%±9%。由此可见,大部分NCVM患者表现为心功能不全。也有学者将心功能正常的NCVM归类为“良性的NCVM”,这类患者的预后较好[11]。近年来,应变成像[19]、实时三维[20]等超声心动图新技术的发展,使对心肌局部功能的评价成为可能。尽管心肌局部的运动功能减退无助于NCVM与其他心肌病的鉴别、但仍有助于判断受累的心肌节段;特别是在整体心功能保存的情况下,局部心功能的减退可能有助于NCVM的诊断[21]。
| [1] | Varnava AM. Isolated left ventricular non-compaction: a distinct cardiomyopathy? [J]. Heart, 2001, 86(6): 599-600. |
| [2] | Dusek J, Ostádal B, Duskova M. Postnatal persistence of spongy myocardium with embryonic blood supply[J]. Arch Pathol, 1975, 99(6): 312-317. |
| [3] | Engberding R, Bender F. Identification of a rare congenital anomaly of the myocardium by two-dimensional echocardiography: persistence of isolated myocardial sinusoids[J]. Am J Cardiol, 1984, 53(11): 1733-1734. |
| [4] | Chin TK, Perloff JK, Williams RG, et al. Isolated noncompaction of left ventricular myocardium. A study of eight cases[J]. Circulation, 1990, 82(2): 507-513. |
| [5] | Maron BJ, Towbin JA, Thiene G, et al. Contemporary definitions and classification of the cardiomyopathies: an American Heart Association Scientific Statement from the Council on Clinical Cardiology, Heart Failure and Transplantation Committee; Quality of Care and Outcomes Research and Functional Genomics and Translational Biology Interdisciplinary Working Groups; and Council on Epidemiology and Prevention[J]. Circulation, 2006, 113(14): 1807-1816. |
| [6] | Elliott P, Andersson B, Arbustini E, et al. Classification of the cardiomyopathies: a position statement from the European Society Of Cardiology Working Group on Myocardial and Pericardial Diseases[J]. Eur Heart J, 2008, 29(2): 270-276. |
| [7] | Kohli SK, Pantazis AA, Shah JS, et al. Diagnosis of left-ventricular non-compaction in patients with left-ventricular systolic dysfunction: time for a reappraisal of diagnostic criteria? [J]. Eur Heart J, 2008, 29(1): 89-95. |
| [8] | St?llberger C, Finsterer J. Left ventricular hypertrabeculation/noncompaction[J]. J Am Soc Echocardiogr, 2004, 17(1): 91-100. |
| [9] | Jenni R, Oechslin E, Schneider J, et al. Echocardiographic and pathoanatomical characteristics of isolated left ventricular non-compaction: a step towards classification as a distinct cardiomyopathy[J]. Heart, 2001, 86(6): 666-671. |
| [10] | Paterick TE, Umland MM, Jan MF, et al. Left ventricular noncompaction: a 25-year odyssey[J]. J Am Soc Echocardiogr, 2012, 25(4): 363-375. |
| [11] | Towbin JA, Lorts A, Jefferies JL. Left ventricular non-compaction cardiomyopathy[J]. Lancet, 2015, 386(9995): 813-825. |
| [12] | Petersen SE, Selvanayagam JB, Wiesmann F, et al. Left ventricular non-compaction: insights from cardiovascular magnetic resonance imaging[J]. J Am Coll Cardiol, 2005, 46(1): 101-105. |
| [13] | Jacquier A, Thuny F, Jop B, et al. Measurement of trabeculated left ventricular mass using cardiac magnetic resonance imaging in the diagnosis of left ventricular non-compaction[J]. Eur Heart J, 2010, 31(9): 1098-1104. |
| [14] | Floria M, Tinica G, Grecu M. Left ventricular non-compaction-challenges and controversies[J]. Maedica (Buchar), 2014, 9(3): 282-288. |
| [15] | Oechslin EN, Attenhofer Jost CH, Rojas JR, et al. Long-term follow-up of 34 adults with isolated left ventricular noncompaction: a distinct cardiomyopathy with poor prognosis[J]. J Am Coll Cardiol, 2000, 36(2): 493-500. |
| [16] | Rosa LV, Salemi VM, Alexandre LM, et al. Noncompaction cardiomyopathy: a current view[J]. Arq Bras Cardiol, 2011, 97(1): e13-e19. |
| [17] | Sousa O, Silva G, Sampaio F, et al. Isolated left ventricular non-compaction: a single-center experience[J]. Rev Port Cardiol, 2013, 32(3): 229-238. |
| [18] | 刘保民, 贾玄慧, 魏亚娟, 等. 55例左心室心肌致密化不全临床和超声心动图特点分析[J]. 中国循环杂志, 2014, 29(1): 48-51. |
| [19] | 王纯, 邓又斌, 朱英, 等. 二维应变成像技术评价肥厚型心肌病患者伴有心肌致密化不全节段的收缩功能[J]. 中国超声医学杂志, 2011, 27(10): 910-912. |
| [20] | 潘翠珍, 舒先红, 赵维鹏, 等. 实时三维超声心动图评价左室心肌致密化不全患者左心室收缩同步性的应用价值[J]. 中华超声影像学杂志, 2011, 20(2): 108-111. |
| [21] | Thavendiranathan P, Dahiya A, Phelan D, et al. Isolated left ventricular non-compaction controversies in diagnostic criteria, adverse outcomes and management[J]. Heart, 2013, 99(10): 681-689. |
 2015, Vol. 17
2015, Vol. 17