过敏性紫癜(Henoch-Schönlein purpura,HSP)是儿童最常见的一种自身免疫性血管炎性疾病,好发于学龄儿童,可累及皮肤、胃肠道、关节、肾脏等多个系统[1]。研究表明,免疫功能紊乱是HSP发病的主要因素[2]。其中滤泡辅助性T细胞(follicular helper T cells,Tfh细胞)是新近发现的效应性CD4+T细胞亚群,主要辅助B细胞的分化并促进抗体类别转换[3];滤泡调节性T细(follicular regulatory T cells,Tfr 细胞)是源于Foxp3+调节性T细胞(Treg 细胞)的细胞,主要参与负性调控Tfh细胞及抑制生发中心B细胞分化[4]。Tfh细胞及Tfr细胞的异常表达参与了多种自身免疫性疾病的发病过程[5, 6, 7, 8, 9, 10],但其在儿童HSP发病中的作用尚未明确。本研究通过检测HSP患儿外周血Tfh细胞、Tfr细胞及相关调控因子表达的变化,旨在探讨其在HSP发病中的作用及可能机制。
1 资料与方法 1.1 研究对象研究对象为我院2013年1月至2014年10月收治的新发HSP患儿40例,均符合中华医学会儿科学分会免疫学组制定的HSP诊断标准[11],其中男24例,女16例,年龄6~14岁,中位年龄9.6岁,所有患儿均未接受肾上腺皮质激素及免疫抑制剂的治疗。对照组25例,其中男14例,女11例,年龄6~14岁,中位年龄9.8岁,为我院同期体检的健康儿童,既往无肾脏疾病、变态反应性疾病史,近期无明确感染征象。两组受试儿童性别、年龄的差异无统计学意义(P>0.05)。
本研究获得我院学术伦理委员批准,所有受试对象的法定监护人均签署知情同意书。
1.2 外周血Tfh细胞及Tfr细胞表达的检测HSP患儿于治疗前留取外周静脉血4 mL,对照组儿童随机留取外周静脉血4 mL,EDTA抗凝,Ficoll密度梯度离心法分离外周血单个核细胞(peripheral blood mononuclear cell,PBMC)。取两管分离好的PBMC悬液,分别加入10 μL的CD4-FITC、CXCR5-APC和ICOS-PECy5单克隆抗体(美国eBioscience公司产品),避光孵育30 min,加入500 μL的红细胞裂解液,其中1管PBMC悬液于PBS洗涤后进行流式细胞仪检测;另1管于PBS洗涤离心后加入Foxp3-PE(美国eBioscience公司产品),避光孵育15 min,PBS洗涤后进行流式细胞仪检测,分析Tfh(CD4+CXCR5+ICOS+)细胞和Tfr(CD4+Foxp3+CXCR5+ICOS+)细胞的表达。
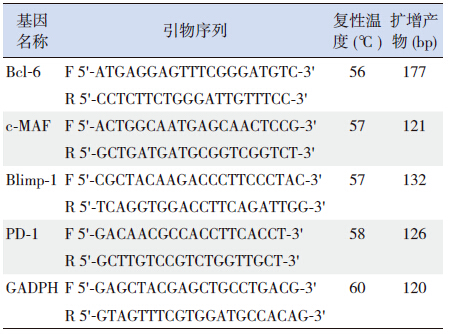
1.3 外周血B细胞淋巴瘤-6、c-MAF、B淋巴细胞诱导成熟蛋白-1及程序性死亡分子-1 mRNA表达的检测采用RT-PCR法进行检测。根据GenBank靶基因序列设计引物,以GAPDH为内参,具体见表 1,均由上海生工生物工程技术服务有限公司合成。采用免疫磁珠法分离PBMC中的CD4+T细胞和CD4+CD25+Treg细胞,提取细胞总RNA,并反转成cDNA第一链,取l μL cDNA进行PCR扩增30~40个循环,取5 μL 的B细胞淋巴瘤-6(B cell lymphoma 6,Bcl-6)、c-MAF、B淋巴细胞诱导成熟蛋白-1(B lymphocyte induced maturation protein 1,Blimp-1)、程序性死亡分子-1(programmed death-1,PD-1)及GAPDH扩增产物,2%琼脂凝胶电泳30 min,回收纯化后送检测序,结果与GenBank中靶基因mRNA序列一致。然后采用SYBR-Green试剂盒,罗氏480实时荧光定量PCR仪分别检测CD4+T细胞Bcl-6、c-MAF、Blimp-1、PD-1 mRNA以及CD4+CD25+Treg 细胞Blimp-1、PD-1 mRNA表达,采用Relative Quantification模式进行数据分析。
| 表 1 RT-PCR引物序列表 |
采用SPSS 13.0统计软件进行分析,计量资料以均数±标准差(x±s)表示。两组间均数的比较采用成组t检验,P<0.05为差异有统计学意义。
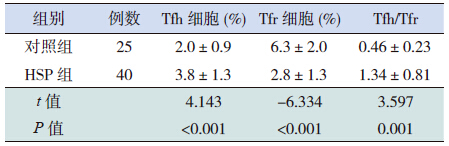
2 结果 2.1 两组外周血Tfh和Tfr细胞表达的比较HSP患儿外周血Tfh细胞比例较对照组显著升高(P<0.05),Tfr细胞比例较对照组显著下降(P<0.05),Tfh/Tfr比值显著升高(P<0.05),见表 2。
| 表 2 HSP组和对照组外周血Tfh和Tfr细胞比例及其比值的比较 (x±s) |
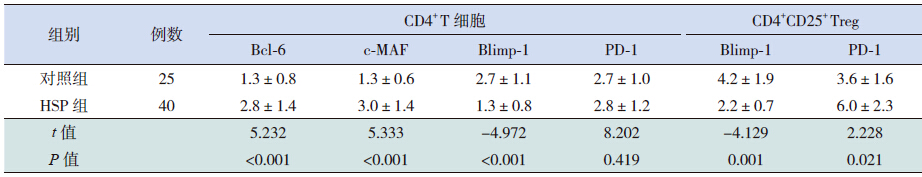
与对照组相比,外周血CD4+T细胞Bcl-6、c-MAF mRNA表达水平显著升高(P<0.05);Blimp-1 mRNA表达水平显著下降(P<0.05);CD4+CD25+Treg 的PD-1 mRNA表达水平显著升高(P<0.05),Blimp-1 mRNA表达水平显著下降(P<0.05),见表 3。
| 表 3 HSP组和对照组外周血Bcl-6、c-MAF、Blimp-1、PD-1 mRNA表达的比较 (x±s) |
HSP是由免疫复合物介导的系统性血管炎症疾病,其发病涉及体液免疫紊乱、T细胞亚群功能失调及细胞因子异常分泌等多种免疫失调,具体机制仍尚未完全明确。目前认为HSP患儿体内自身反应性B细胞过度活化导致IgA抗体过度产生是其发病的核心机制[12],但导致自身反应性B细胞过度活化的机制至今尚未阐明。
近年来学者们发现了的一种新的CD4+T细胞亚群,定位于淋巴滤泡,其表型为CD4+CXCR5+ICOS+,可辅助B细胞增殖、分化、产生免疫球蛋白并参与抗体类别转换,称之为Tfh细胞。Tfr细胞源于Foxp3+ Treg,免疫表型为CD4+Foxp3+CXCR5+ICOS+,主要参与负性调控Tfh细胞诱导生发中心B细胞的促生发中心反应,减少或抑制自身抗的生成。既往研究发现,多种自身免疫性疾病如免疫性血小板减少症、系统性红斑狼疮、Graves病、支气管哮喘、银屑病、强制性脊柱炎、干燥综合征等存在着Tfh和Tfr细胞的异常表达。新近研究发现,HSP患儿外周血中Tfh细胞比例升高[13],可能是导致HSP免疫功能紊乱的主要原因,但迄今尚无有关Tfr细胞在HSP发病中的作用研究。本研究发现,HSP患儿外周血Tfh细胞比例显著升高,与既往研究报道一致[13]。同时本研究亦发现,HSP患儿外周血Tfr细胞比例显著下降,Tfh/Tfr比值显著升高,提示Tfh及Tfr细胞异常表达可能参与了儿童HSP的发病过程。
本研究亦探讨了Tfh及Tfr细胞异常表达的可能机制,即检测了其相关调控因子Bcl-6、c-MAF、Blimp-1、PD-1 mRNA表达的变化。其中Bcl-6是决定Tfh细胞分化的转录调控因子,表达于生发中心B细胞和CD4+T细胞中,并介导调控二者的分化,其表达缺失可影响生发中心的形成以及B细胞对T细胞依赖抗原的应答;c-MAF具有诱导IL-21表达的能力,同时也可诱导CXCR5的表达,Bcl-6和c-MAF的共同表达可共同诱导CXCR4、PD-1及ICOS,进而促进Tfh发育和功能分化[14, 15]。Blimp-1作为Bcl-6的拮抗因子,是抑制Tfh的分化与发育的主要因素,Blimp-1能直接抑制B细胞和T细胞Bcl-6的表达,其活性也可被Bcl-6抑制;同时Blimp-1亦可促进Tfr细胞的免疫抑制功能[16]。PD-1是抑制Tfh的分化与发育的主要转录因子,同时PD-1的过度表达可抑制Tfr细胞的产生[17]。本研究结果提示HSP患儿外周血CD4+T细胞Bcl-6、c-MAF mRNA表达水平较对照组儿童显著升高,Blimp-1 mRNA表达水平较对照组儿童显著下降;CD4+CD25+Treg细胞的PD-1 mRNA表达水平较对照组显著升高,Blimp-1 mRNA表达水平较对照组儿童显著下降。推测上述因子的异常表达可能是导致Tfh细胞过表达及Tfr细胞抑制表达的重要原因。
总之,本研究显示Tfh细胞、Tfr细胞及其相关调控因子的异常表达参与了儿童HSP的发病过程,对其检测有助于进一步完善HSP的免疫学发病机制,并为该类疾病的治疗拓展新的思路,同时亦为其他自身免疫性疾病的机制探讨提供了方向。
| [1] | Chen O, Zhu XB, Ren P, et al. Henoch-Schönlein purpura in children: clinical analysis of 120 cases[J]. Afr Health Sci, 2013, 13(1): 94-99. |
| [2] | Trnka P. Henoch-Sch?nlein purpura in children[J]. J Paediatr Child Health, 2013, 49(12): 995-1003. |
| [3] | Ueno H, Banchereau J, Vinuesa CG. Pathophysiology of T follicular helper cells in humans and mice[J]. Nat Immunol, 2015, 16(2): 142-152. |
| [4] | Chung Y, Tanaka S, Chu F, et al. Follicular regulatory T cells expressing Foxp3 and Bcl-6 suppress germinal center reactions[J]. Nat Med, 2011, 17(8): 983-988. |
| [5] | 崔亚杰, 管玉洁, 刘炜, 等. 儿童原发免疫性血小板减少症患者外周血滤泡调节性和辅助性T细胞的变化[J]. 中华血液学杂志, 2014, 35(11): 980-984. |
| [6] | Zhang X, Lindwall E, Gauthier C, et al. Circulating CXCR5+CD4+ helper T cells in systemic lupus erythematosus patients share phenotypic properties with germinal center follicular helper T cells and promote antibody production[J]. Lupus, 2015. pii: 0961203314567750. [Epub ahead of print]. |
| [7] | Shan Y, Qi C, Zhao J, et al. Higher frequency of peripheral blood follicular regulatory T cells in patients with new onset ankylosing spondylitis[J]. Clin Exp Pharmacol Physiol, 2015, 42(2): 154-161. |
| [8] | Zhang J, Ren M, Zeng H, et al. Elevated follicular helper T cells and expression of IL-21 in thyroid tissues are involved in the pathogenesis of Graves' disease[J]. Immunol Res, 2015, 62(2): 163-174. |
| [9] | Niu J, Song Z, Yang X, et al. Increased circulating follicular helper T cells and activated B cells correlate with disease severity in patients with psoriasis[J]. J Eur Acad Dermatol Venereol, 2015. doi: 10.1111/jdv.13027. [Epub ahead of print]. |
| [10] | Szabo K, Papp G, Dezso B, et al. The histopathology of labial salivary glands in primary Sj?gren's syndrome: focusing on follicular helper T cells in the inflammatory infiltrates[J]. Mediators Inflamm, 2014, doi: 10.1155/2014/631787. [Epub ahead of print]. |
| [11] | 中华医学会儿科学分会免疫学组, 《中华儿科杂志》编辑委员会. 儿童过敏性紫癜循证诊疗建议[J]. 中华儿科杂志, 2013, 51(5): 502-507. |
| [12] | Jennette JC, Falk RJ, Bacon PA, et al. 2012 revised international Chapel Hill Consensus Conference Nomenclature of Vaseulitides[J]. Arthritis Rheum, 2013, 65(1): 1-11. |
| [13] | 孔凡贞. 急性期过敏性紫癜患儿Tfh细胞改变及意义初探[D].重庆: 重庆医科大学, 2012. |
| [14] | Johnston RJ, Poholek AC, DiToro D, et al. Bcl6 and Blimp-1 are reciprocal and antagonistic regulators of T follicular helper cell differentiation[J]. Science, 2009, 325(5943): 1006-1010. |
| [15] | Kroenke MA, Eto D, Locci M, et al. Bcl6 and Maf cooperate to instruct human follicular helper CD4 T cell differentiation[J]. J Immunol, 2012, 188(8): 3734-3744. |
| [16] | Cretney E, Xin A, Shi W, et al. The transcription factors Blimp-1 and IRF4 jointly control the differentiation and function of effector regulatory T cells[J]. Nat Immunol, 2011, 12(4): 304-311. |
| [17] | Sage PT, Francisco LM, Carman CV, et al. The receptor PD-l controls follicular regulatory T cells in the lymph nodes and blood[J]. Nat Immunol, 2013, 14(2): 152-161. |
 2015, Vol. 17
2015, Vol. 17