克罗恩病(Crohn's disease,CD)为一种原因不明的慢性、反复发作的非特异性胃肠道炎症肉芽肿性疾病,可累及胃肠道各部位,临床主要表现为腹痛、腹泻、瘘管和肛门病变[1]。近年来儿童 CD的发病率较前呈增长趋势[2]。由于CD的发病机制仍不明确,治疗多选用糖皮质激素及免疫抑制剂等常规方案。鉴于儿童生长发育的特殊性及常规治疗的疗效及副作用,目前迫切需要寻找一些更有效的治疗方案。
英夫利西单抗(Infliximab,IFX)是首个正式用于CD治疗的新型生物制剂[3],在中重度活动性CD、CD伴有瘘管形成等病例中,已有相当良好的治疗效果。目前国内也有一些应用IFX治疗CD的相关报道,但多限于成人患者的病例研究[4, 5],少数儿童病例研究也缺乏系统的临床及内镜研究资料和药物的安全性研究分析[6]。本研究总结我科确诊的CD患儿应用IFX治疗的临床资料,对其有效性及安全性进行分析,旨在为我国儿童CD患者应用IFX提供临床治疗参考。
1 资料与方法 1.1 一般资料本研究为单中心回顾性研究。选取于2011年1月至2014年12月于我院儿科消化病房住院并确诊为CD 的患儿共13例为研究对象,诊断标准按照2010 年中华医学会儿科学分会消化学组儿童炎症性肠病协作组制定的《儿童炎症性肠病诊断规范共识意见》[4]执行,其中男8例,女5例,年龄3.5~14岁;12例患儿行结肠镜检查并留取多处黏膜组织做病理检查,1例患儿经手术切除部分肠管进行病理检查。结肠镜显示12例患儿的结肠病变累及全结肠及直肠,病变呈非连续性,跳跃分布;所有患儿均符合临床诊断及病理组织学诊断标准。所有患儿均行包括T-spot.TB、肺部CT等检查以除外结核菌感染及其他慢性肠道感染性疾病、肠道恶性淋巴瘤。
1.2 临床疾病评估所有患儿在入院第1天检验白细胞(WBC)、血红蛋白(HB)、肝功能、血沉、C反应蛋白(CRP),评估儿童克罗恩病活动指数(PCDAI)[7]。病情程度和活动程度分为不活动、轻度、中/重度,不活动:0~10 分;轻度:11~30 分;中/重度:≥31 分[7]。
1.3 治疗方法患者均给予常规综合治疗,主要是营养支持治疗;并发感染者给予抗生素(甲硝唑等)、糖皮质激素(甲基强的松龙)、氨基水杨酸制剂(艾迪莎)、硫唑嘌呤(AZA)治疗,其中AZA为停用IFX后用于维持缓解治疗[1]。
IFX治疗前对患者进行了全面的评估,符合IFX治疗的适应证,在第0、2、6周及随后每隔8周静脉滴注IFX(每次5 mg/kg,西安杨森公司,注册证号S20120012),其中第0、2、6周为诱导治疗期,随后各周为维持治疗期,用药前静脉注射地塞米松(3~5 mg)以减少不良反应的发生;每次治疗前,都需要评估患儿体温、身高、体重、腹痛、腹泻及排便情况,全面体查,检测血常规、心肝肾功能、CRP及红细胞沉降率(ESR)等指标,并在应用IFX前由患儿一级亲属亲笔签署《知情同意书》,随病志保留备案;治疗30周后重新评估PCDAI、复查临床指标及消化内镜检查。对于不能完成30周治疗的患儿不计入本次研究。IFX剂量及疗程严格按照药物说明书及厂家给予的治疗指导意见执行。
1.4 疗效及安全性评估(1)临床疗效评估:治疗前后PCDAI 下降>25%判断为临床有效,PCDAI下降在 10%~25%之间为临床缓解,PCDAI 下降<10%为临床无效[8]。
(2)内镜疗效评估:治疗第 30 周末行肠镜检查,评估患者肠道黏膜愈合情况。参考 Mary等[9] 研究方法进行肠道黏膜愈合情况的评估。溃疡消失判断为完全愈合,肠道溃疡总面积较治疗前减少≥75%、溃疡<3个、溃疡直径<0.5 cm 判断为基本愈合,完全愈合与基本愈合统称为显效。愈合面积在50%~75%之间称为有效,愈合面积<50%称为无效。
(3)安全性评估:从开始治疗到治疗第30周,对所有患者随访,并在每次使用IFX前详细询问、记录发生过的不良反应及事件,评估包括神经系统、循环系统等在内的患儿各项临床指标,详细记录每次复查的理化检查指标。
1.5 统计学分析采用SPSS 13.0统计软件对数据进行统计学分析,计量资料以均数±标准差(x±s)表示,两组间比较采用配对t检验,P<0.05 为差异有统计学意义。
2 结果 2.1 临床疗效判定IFX治疗30周后,5例患儿(38%)达到临床有效,8例患儿(62%)为临床缓解,无临床无效病例。
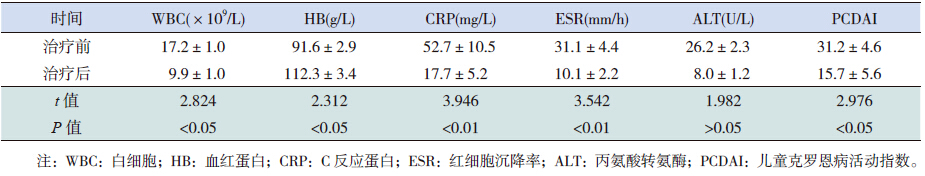
比较治疗前后的实验室检查指标,IFX治疗30周后,WBC计数、ESR、CRP水平及PCDAI均较治疗前显著降低(P<0.05),HB较治疗前升高(P<0.05),丙氨酸转氨酶在两组间比较差异无统计学意义(P>0.05),见表 1。
| 表 1 治疗前后实验室指标比较 (x±s) |
CD患儿治疗前,行肠镜检查示大肠黏膜充血水肿,血管纹理模糊,管腔狭窄;存在弥漫性糜烂及纵行溃疡,溃疡周围黏膜增生不平,溃疡表面附有白苔(图 1A~C);治疗后2例患儿复查结肠镜,1例为镜下完全黏膜痊愈(图 1D),1例与临床表现不同的是未获得黏膜缓解,判定为无效。
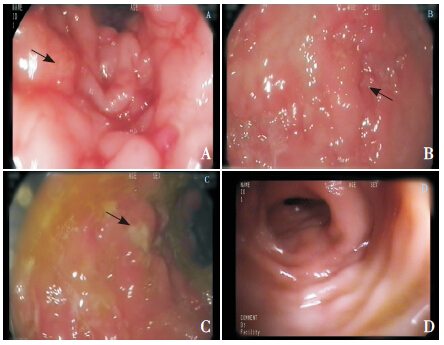 |
图 1 CD患儿治疗前后肠镜下表现 治疗前,图A显示大肠黏膜充血水肿(箭头所示),血管纹理模糊,管腔狭窄;图B显示弥漫性糜烂及纵行溃疡,溃疡周围黏膜增生不平(箭头所示);图C显示溃疡表面附有白苔(箭头所示)。图D显示治疗30周后黏膜水肿明显消退,无明显溃疡,血管纹理较清晰。 |
治疗开始至30周结束,所有患儿未出现大量便血,无患儿出现肠梗阻、瘘管和肛门病变,1例患儿治疗前有肛门瘘管,未经外科干预,治疗6周时瘘管封闭,30周时未再出现新瘘管。
2.4 不良反应情况治疗期间所有患儿未出现急性输液或过敏反应,1例患儿出现反复呼吸道感染,经控制感染后可继续IFX治疗。13例患儿均未出现药物说明书标注的呼吸道感染以外的其余不良反应。
3 讨论儿童CD目前病因仍不明确,与环境因素、感染及免疫功能紊乱等均可能有关。现在普遍接受的一种假说是环境因素作用于遗传易感个体,在肠道的正常菌群参与下,启动了肠道免疫及非免疫系统,最终导致免疫反应和炎症过程,引起肠道黏膜过度炎症反应,介导炎症损伤。促炎因子和抗炎因子之间的失衡被视为CD发病机制中的一个重要环节,通过特异性抑制促炎因子或使用调节性和抗炎症性细胞因子治疗CD已成为可能。
免疫反应相关细胞因子如 IL-1、IL-6、TNF-α 等在 CD 的发病过程中,发挥了重要的促炎作用,并充当肠黏膜损伤的介质[10]。TNF-α 是一种重要的促炎症因子和免疫调节因子,与CD的发病有着密切的关系。有研究表明 TNF-α 通过多项效应相互协同,促使单核细胞和激活的T细胞浸润肠黏膜并导致肉芽肿形成[11]。CD小肠黏膜中TNF-α含量增高,遍布整个肠黏膜并深入到固有膜,使CD 炎症累及肠壁全层,多为节段性分布[12],有终身复发倾向,部分患者迁延不愈,预后较差。与传统治疗相比,目前对CD更倾向于“降阶梯治疗”,即对于新发的、诊断明确的患者,早期积极应用最有效的治疗方案(生物制剂治疗),可改变疾病的自然病程,从而获得更好的临床疗效[13, 14, 15],减少患者对激素的依赖,最终降低住院率和手术率。
IFX是首个用于治疗炎症性肠病(IBD)的人鼠嵌合性抗 TNF-α IgG1单克隆抗体,可以通过拮抗 CD 免疫炎症通路上的关键炎症因子TNF-α,有效地促进产TNF的炎性细胞凋亡,从而快速促进肠道炎症的消散[16, 17]。IFX可减少炎性反应局部的炎性细胞聚集,且不产生系统性的细胞免疫抑制作用,从而最终缓解CD慢性炎性反应的进展。这一生物学制剂具有的诸如效果好、起效快、药物传递可靠和副作用少等许多特点都支持用英IFX而不是传统的皮质激素作为儿童CD的一线治疗方案。
目前我们治疗IBD尚不能达到治愈的目的,只能诱导缓解,维持缓解,保证生长发育[18]。本研究结果提示所有CD患儿应用IFX后腹痛、腹泻、便血症状均在短期内得到缓解,并且1例患儿肛门瘘管未经手术自行愈合,减轻了患儿痛苦,说明IFX能够在治疗儿童CD中起到快速诱导缓解作用。在随访过程中未见症状复发,表明IFX在维持缓解上具有一定作用(缓解期应用了硫唑嘌呤)。更重要的是治疗后所有患儿的身高与体重均有所增长,在2次PCDAI评分中差别较大,说明IFX不影响患儿生长发育;并且由于IFX控制了患儿CD病情的活动,促进肠道黏膜修复,增加了具有正常消化吸收功能的肠道黏膜面积,提高了患儿对营养物质摄取利用效率,有效地解决了患儿热量摄入不足及蛋白质丢失过多的问题,部分缓解了IBD患儿生长发育障碍这一存在于儿童IBD患者特有且突出的临床表现,这是一个非常重要的指标。而以上这些特点都是我们消化儿科医生在为CD患儿选择治疗方案时需重点考虑的方面。
当然对于IBD疗效评估,内镜下黏膜愈合率是个非常重要的指标。本次病例研究在治疗开始前所有患儿均有内镜下或手术过程中的黏膜表现及病理情况,治疗30周仅有2例患儿复查了肠镜,这是本次观察的一个缺陷。并且在复查的2例患儿中还有1例的镜下表现与临床表现大相径庭,表现为愈合面积<50%,判定为无效,说明CD的临床缓解与肠道内的黏膜缓解可能不平行。由于患儿家长依从性的问题及儿童自身的特点,其余11例患儿家长均拒绝复查内镜,此次研究没有获得黏膜缓解率的资料,无法作为与临床缓解率的对比,实为可惜。我们在今后工作中要进一步加强对内镜检查的宣传工作,逐步提高内镜复查率,以便更好地指导临床工作,并有效地掌握第一手黏膜缓解率资料。
CD患儿肠外症状多表现为营养代谢障碍和自身免疫性病变两大类。后者常表现为关节炎、关节痛、虹膜睫状体炎、葡萄膜炎等。本次观察患儿在病程中未出现自身免疫性肠外表现,因此无法评价IFX对儿童CD患者自身免疫性病变的缓解作用。
有研究显示,临床使用IFX超过1年,则发生恶性肿瘤,尤其是肝脾 T 细胞淋巴瘤的发生率会有增加,但其恶性肿瘤发病率与同年的基础流行病学资料相比差异无统计学意义,故IFX与恶性肿瘤的相关性仍不确切[19, 20]。在我们应用IFX治疗的患儿中所有病例均对IFX表现出很好的耐受性,13例患儿中无1例出现恶心、头痛、头晕、胸痛等的急性输液反应症状,1例患儿出现反复呼吸道感染症状,在控制感染后可继续使用该药物。所有患儿均未发现包括良/恶性肿瘤、心脏疾病,肝脏疾病、皮肤疾病等药品说明书及文献中所提及的常见不良反应[21, 22, 23, 24]。值得指出的是我们所有患儿在应用IFX前均严格除外了结核、肝炎及其他常见感染性疾病,保证了患儿在应用IFX疗程中及结束后未出现机会感染及潜在结核激活等二次打击风险。
由于本研究为单中心回顾性研究,病例数较少,疗程仅为30周,随访时间短,不能除外IFX长期应用所致的恶性肿瘤及儿童生长发育方面的潜在副作用,长期疗效与安全性需进一步多中心、前瞻性、大样本的研究才能得出更翔实可靠的数据。
| [1] | 胡品津. 炎症性肠病诊断与治疗的共识意见(2012年•广州)解读[J]. 胃肠病学, 2012, 14(15): 709-711. |
| [2] | Buderus S, Scholz D, Behrens R, et al. Inflammatory bowel disease in pediatric patients: Characteristics of newly diagnosed patients from the CEDATA-GPGE Registry[J]. Dtsch Arztebl Int, 2015, 112(8): 121-127. |
| [3] | Randall C, Vizuete J, Wendorf G, et al. Current and emerging strategies in the management of Crohn's disease[J]. Best Pract Res Clin Gastroenterol, 2012, 26(5): 601-610. |
| [4] | 孙怡燕, 吴永发, 徐灿, 等. 英夫利西单抗治疗克罗恩病的疗效观察[J]. 第二军医大学学报, 2010, 31(3): 338-339. |
| [5] | 邓应江, 敖智容, 秦红, 等. 英夫利西单抗治疗克罗恩病的疗效与安全性研究[J]. 西南国防医药, 2012, 22(5): 505-507. |
| [6] | 陈志勇, 游洁玉, 刘莉, 等. 英夫利西单抗治疗儿童克罗恩病疗效观察[J]. 继续医学教育, 2014, 28(5): 23-25. |
| [7] | 中华医学会儿科学会消化学组儿童炎症性肠病协作组. 儿童炎症性肠病诊断规范共识意见[J]. 中国实用儿科杂志, 2010, 25(4): 263-265. |
| [8] | Hanauer SB, Feagan BG, Lichtenstein GR, et al. Maintenance infliximab for Crohn's disease: the ACCENT I randomised trial[J]. LANCET, 2002, 359(9317): 1541-1549. |
| [9] | Mary JY, Modigliani R. Development and validation of an endoscopic index of the severity for Crohn's disease: a prospective multicentre study. Groupe d'Etudes Theraeutiques des Affections Inflammatoires du Tube Digestif (GETAID)[J]. Gut, 1989, 30(7): 983-989. |
| [10] | Strober W, Fuss IJ. Proinflammatory cytokines in the pathogenesis of inflammatory bowel diseases[J]. Gastroenterology, 2011, 140(6): 1756-1767. |
| [11] | even G, Assaad A, Biehl T, et al. Use of anti tumor necrosis factor-alpha monoclonal antibody for ulcerative jejunoileitis[J]. World J Gastroenterol, 2012, 18(36): 5135-5137. |
| [12] | Molodecky NA, Soon IS, Rabi DM, et al. Increasing incidence and prevalence of the inflammatory bowel diseases with time, based on systematic review[J]. Gastroenterology, 2012, 142(1): 46-54. |
| [13] | Baert F, Caprilli R, Angelucci E. Medical therapy for Crohn's disease: top-down or step-up?[J]. Dig Dis, 2007, 25(3): 260-266. |
| [14] | Osterman MT, Haynes K, Delzell E, et al. Effectiveness and safety of immunomodulators with anti-tumor necrosis factor therapy in Crohn's disease[J]. Clin Gastroenterol Hepatol, 2015, 13(7): 1293-1301. |
| [15] | Poullenot F, Laharie D. First line therapy of inflammatory bowel disease[J]. Rev Prat, 2014, 64(9): 1242-1248. |
| [16] | Peyrin-Biroulet L. Anti-TNF therapy in inflammatory bowel diseases: a huge review[J]. Minerva Gastroenterol Dietol, 2010, 56(2): 233-243. |
| [17] | Fernandes C, Allocca M, Danese S, et al. Progress with anti-tumor necrosis factor therapeutics for the treatment of inflammatory bowel disease[J]. Immunotherapy, 2015, 7(2): 175-190. |
| [18] | Vatansever A, ?eki? C, Ekinci N, et al. Effects of mucosal TNF-alpha levels on treatment response in Crohn's disease patients receiving anti-TNF treatment[J]. Hepatogastroenterology, 2014, 61(136): 2277-2282. |
| [19] | 陈洁.炎症性肠病[M]//陈洁, 许春娣, 黄志华. 儿童胃肠肝胆胰疾病. 北京: 中国医药科技出版社, 2006: 213-222. |
| [20] | Moss AC, Fernandez Becker N, Jo Kim K, et al. The impact of infliximab infusion reactions on long-term outcomes inpatients with Crohn’s disease[J]. Aliment Pharmacol Ther, 2008, 28(2): 221-227. |
| [21] | Han PD, Cohen RD. Managing immunogenic responses to Infliximab: treatment implications for patients with Crohn’s disease[J]. Drugs, 2004, 64(16): 1767-1777. |
| [22] | Lis K, Kuzawińska O, Ba?kowiec-Iskra E. Tumor necrosis factor inhibitors-state of knowledge[J]. Arch Med Sci, 2014, 22, 10(6): 1175-1185. |
| [23] | Uyanikoglu A, Ermis F, Akyuz F, et al. Infliximab in inflammatory bowel disease: attention to adverse events[J]. Eur Rev Med Pharmacol Sci, 2014, 18(16): 2337-2342. |
| [24] | O'Meara S, Nanda KS, Moss AC. Antibodies to infliximab and risk of infusion reactions in patients with inflammatory bowel disease: a systematic review and meta-analysis[J]. Inflamm Bowel Dis, 2014, 20(1): 1-6. |
 2015, Vol. 17
2015, Vol. 17