促性腺激素释放激素类似物(gonadotropin releasing hormone analogue,GnRHa)是目前治疗中枢性性早熟(central precocious puberty,CPP)的主要药物,其治疗目的主要有两点:(1)抑制过早或过快的性发育;(2)改善因骨龄提前而减少的成年身高。但GnRHa治疗过程中部分患儿因生长减速明显,常需联合重组人生长激素治疗方能改善成年身高,而联合治疗费用非常昂贵。目前国内外有关GnRHa治疗对成年身高的影响研究较多[1, 2, 3],但均未能给出下丘脑-垂体-性腺轴(hypothalamic-pituitary-gonadal axis,HPGA)抑制到何种程度对成年身高最有利的参考数据。本课题旨在研究GnRHa治疗过程中HPGA抑制程度与CPP女童成年预测身高(predict adult height,PAH)的关系,以指导临床个体化调节GnRHa治疗剂量,尽可能避免联合药,减轻患儿家庭和社会的经济负担。
1 资料与方法 1.1 研究对象回顾性分析2009年5月至2014年6个月本院诊治的75例CPP女童资料。其中治疗达6个月者75人次,12个月65人次,18个月53人次,24个月39人次。
纳入标准:(1)符合2007年修订的《中枢性(真性)性早熟诊治指南》[4]CPP的诊断标准;(2)GnRHa选择曲普瑞林缓释制剂(商品名:达菲林);(3)排除甲状腺、肾上腺疾病及其他肿瘤性疾病;(4)未使用过重组人生长激素。
1.2 临床资料收集回顾性收集患儿的初治年龄、骨龄(bone age,BA)、身高、体重指数(body mass index,BMI)、靶身高(target height,TH)、子宫卵巢容积[按椭球体积计算公式:容积=(长径×横径×前后径)×π/6]、促黄体生成素(luteinizing hormone,LH)及促卵泡刺激素(follicular estrogen hormone,FSH)峰值、雌二醇(estradiol,E2)水平(激素水平均采用化学发光法测定,检测最低浓度分别为0.1 U/L、0.1 U/L、18.35 pmol/L)。
1.3 治疗方案达菲林最初3个月每28 d注射1次,以后每28~35 d注射1次。初始剂量80~120 μg/kg,最大剂量3.75 mg。3个月后行简易GnRHa激发试验,即为:治疗性肌注GnRHa 30 min后,一次采血测LH和FSH。LH<2 IU/L和LH/FSH<1,提示HPGA功能被抑制,然后剂量逐渐减少,每次45~110 μg/kg,最大剂量3.75 mg。根据性腺抑制与身高增长情况、骨龄进展情况进行剂量调整。
1.4 GnRHa疗效分析分别于GnRHa治疗后6月、12月、18月及24月时记录患儿的身高、生长速率(growth velocity,GV,cm/年)、BA、子宫卵巢容积及LH、FSH峰值、E2水平(所有时间点均行简易GnRHa激发试验)。
1.5 不同时间点PAH值的计算GnRHa治疗起始、治疗后6月、12月、18月及24月时,根据各时间点身高、BA,查阅G-P图谱测骨龄法预测成年身高表[5],计算PAH。
1.6 统计学分析采用易侕统计软件(http://empowerstats.com/cn)进行统计分析。计数资料以均数±标准差(x±s)表示,多组间比较采用方差分析;不同时间点的两两比较采用配对t检验;相关性分析采用Pearson法;HPGA抑制程度对PAH改善作用采用阈值效应与饱和效应分析。P<0.05为差异有统计学意义。
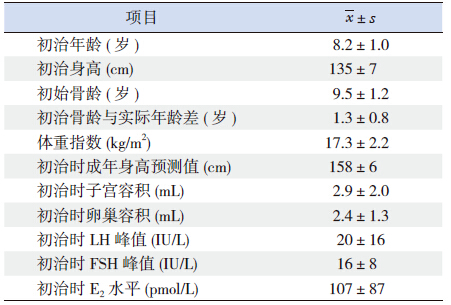
2 结果 2.1 一般情况首次治疗的平均年龄8.2±1.0岁(7.2~9.2岁),骨龄9.5±1.2岁(8.3~10.7岁),较实际年龄提前1年以上,治疗前平均身高135±7 cm,成年预测身高平均为158±6 cm,子宫卵巢达青春期水平,LH峰值平均为20±16 IU/L,FSH峰值平均为16±8 IU/L,LH/FSH峰值>0.6,符合真性性早熟的诊断标准。见表 1。
| 表 1 研究对象一般资料 (n=75) |
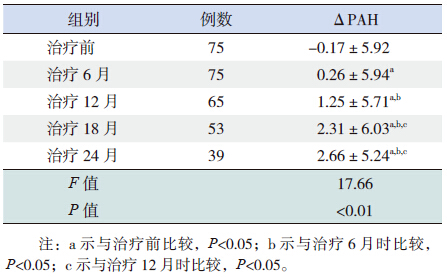
治疗前ΔPAH(PAH-TH)为-0.17±5.92 cm,GnRHa治疗后不同时间点ΔPAH改变分别为0.26±5.94 cm(6月)、1.25±5.71 cm(12月)、2.31±6.03 cm(18月)、2.66±5.24 cm(24月)。可见随着治疗时间延长,ΔPAH明显增高(F值=17.66,P<0.01),其中治疗12、18、24月时ΔPAH较治疗初期及治疗6个月时明显增高(P均<0.05),治疗18个月及24个月时ΔPAH较12个月时明显增高(P<0.05),治疗18个月和24个月的ΔPAH差异无统计学意义(P=0.806)。治疗24个月时较治疗初期ΔPAH增加2.83 cm。见表 2。
| 表 2 GnRHa治疗后ΔPAH变化 (x±s) |
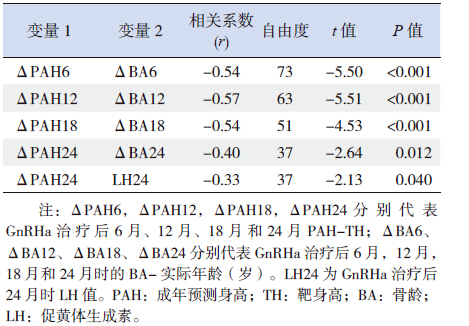
Pearson相关性分析发现ΔPAH与BA的改变(ΔBA)呈负相关,提示ΔPAH的提高,主要由BA的增长减慢所致;另外治疗24月时LH值与ΔPAH呈负相关(r=-0.33,P=0.04),说明LH值抑制不佳对ΔPAH有损(表 3)。12月时ΔBA与FSH水平呈正相关(r=0.30,P=0.014),24月时ΔBA与LH水平呈正相关(r=0.34,P=0.035),提示FSH及LH控制不良会促进BA增长,对ΔPAH不利。
| 表 3 ΔPAH影响因素的相关性检验结果 |
本研究将各个时间点的ΔPAH和ΔBA作为结局变量,子宫容积、卵巢容积、GV、 LH、 FSH 和 E2作为危险因素,分别将每个结局变量与每个危险因素一一对应建立模型,进行阈值效应分析。
结果显示子宫容积对ΔPAH有阈值效应,治疗24月时,折点为2.3 mL,即当子宫容积>2.3 mL时,其容积每增加1 mL,ΔPAH增加6.4 cm,提示GnRHa治疗后子宫容积维持在2.3 mL以上对成年身高的改善有利;根据我国真性性早熟治疗指南,GnRHa治疗后宜将性征控制在青春前期水平(国外文献报道青春前期的子宫容积<3.0 mL[6]),故建议将子宫容积控制在2.3~3.0 mL之间对改善PAH有利。此时GnRHa的治疗剂量平均为79 μg/kg,剂量范围55~90 μg/kg。
治疗24月时,LH对ΔPAH阈值效应的折点为0.8 IU/L,即当LH<0.8 IU/L时,LH每下降0.1 IU/L,ΔPAH增加1.02 cm,说明LH低于折点,对成年身高有利;LH对ΔBA阈值效应的折点为1.4 IU/L,即当LH<1.4 IU/L时,LH每下降1 IU/L,ΔBA减少0.9岁,骨龄的延缓增长,最终将提高成年身高。故宜将LH控制在0.8 IU/L以下,利于身高改善。此时GnRHa的治疗剂量平均为71.5 μg/kg,剂量范围45~100 μg/kg。
治疗6月时,FSH对ΔBA有阈值效应,其折点为2.6 IU/L,即当FSH<2.6 IU/L,FSH每下降1 IU/L,BA增长减少0.3岁,对成年身高有利;治疗12月时,FSH对ΔBA存在阈值效应,其折点3.3 IU/L,当FSH>3.3 IU/L,FSH每上升1 IU/L,BA增长0.4岁,对成年身高不利;治疗18月时,FSH对ΔBA也有阈值效应,其折点为2.4 IU/L,当FSH<2.4 IU/L,FSH每下降1 IU/L,BA增长减少0.5岁,对成年身高有利;治疗24月时,FSH对ΔBA有阈值效应,其折点为3.2 IU/L,当FSH<3.2 IU/L,FSH每下降1 IU/L,BA增长减少0.4岁,对成年身高有利。综合以上4个时间点阈值效应发现将FSH控制在2.4 IU/L以下对延缓BA的增长有利,将改善成年身高。此时GnRHa的治疗剂量平均为78 μg/kg,剂量范围45~105 μg/kg。卵巢容积及GV对ΔPAH及ΔBA均未见阈值效应。
3 讨论GnRHa治疗能有效改善CPP儿童的成年身高,治疗效果与治疗开始的年龄密切相关,其治疗的年龄越小,效果就越明显[7]。儿童的GnRHa应用国际共识[3]中提到发病小于6岁者应用GnRHa可获得最大的身高净获,但陈秋莉等[1]的15年的追踪研究发现小于6岁组与6~8岁组身高净获相似。本研究中患儿初治年龄为7.2~9.2岁,初治骨龄8.3~10.7岁,
经过2年的GnRHa治疗,其PAH较治疗前增加2.83 cm,提示即使在较大年龄组(7~9岁)使用GnRHa仍可取得较好疗效,这个结果与Allali等[8]研究结果(治疗前后增加2.2 cm)一致。
GnRHa治疗过程中部分患儿存在生长过度减速的情况,其机制尚不明确,目前大多数学者们认为其可能机制是GnRHa治疗抑制性激素的产生,影响性激素对骨的直接促增殖作用 [9],也可能是影响性激素间接对生长轴的正性诱导作用及肝脏生长激素受体及相关生长激素结合蛋白的分泌[10],对生长激素-胰岛素样生长因子1(GH-IGF-1)轴有负性影响。Fuld 等[11]提出在不同的GnRHa剂量之下生长速率所受到的影响程度是不同的,我国中枢性(真性)性早熟诊治指南[4]中也指出GnRHa治疗的维持量应当个体化,根据性腺轴功能抑制情况而定。目前临床上通过BA、生殖系统 B 超、LH等性激素水平监测治疗效果,但在监测过程中仍存在许多问题,因此治疗后监测的最优方案仍需长期研究。
根据成年身高预测表[5],BA的增长减慢将改善PAH。本研究显示在GnRHa治疗后的6月、12月、18月及24月PAH的增加与BA的增长呈负相关,说明BA增长的越慢(控制得越好),PAH增加越明显。
子宫卵巢的容积控制在什么范围内对PAH有利呢?指南并未对此给出明确的建议,仅提出治疗后应将性征发育控制在青春前期水平。张庆等[12]报道我国女童青春前期的子宫容积<1.5 mL,卵巢容积<1.0 mL。国外文献则认为青春前期子宫容积应<3.0 mL,卵巢容积<2.0 mL[6]。本研究发现将子宫容积控制在2.3~3.0 mL之间对改善PAH有利。子宫容积受到雌激素水平的调控,适度的性激素对身高增长有协同作用,故认为过于严格地降低雌激素水平和子宫容积对PAH不利。遗憾的是,由于本单位检验中心采用的化学发光法测定雌激素,其检测最低浓度为18.35 pmol/L,在GnRHa治疗随访时大多数患儿雌激素水平低于最低测定值,未能分析雌激素在何种范围对ΔPAH有利。
对促性激素水平应控制在何种范围,国内指南亦未给出具体的建议。对于 LHRH 激发试验 LH 受抑的定义目前没有形成共识。部分研究认为LH 峰值应<2.0~3.0 IU/L[13, 14, 15]。美国Neely 等 [16]报道GnRHa治疗6月时LH峰值应抑制在0.7 IU/L左右,LH/FSH 应抑制在0.67左右最好。本研究结果显示宜将LH控制在0.8 IU/L以下,利于身高改善。同时本研究发现将FSH控制在2.4 IU/L以下对延缓BA的增长有利。
另外本研究折点分析时发现GnRHa的治疗剂量平均为71.5、78、79 μg/kg时对改善PAH有利。但剂量范围波动于45~105 μg/kg之间,个体化剂量差异很大,从而佐证了性早熟诊治指南[4]中GnRHa治疗的维持量应当个体化。
综上,GnRHa治疗能改善CPP女童的PAH,其PAH的改善主要由于BA增长延缓所致。选择合适的个体化GnRHa治疗剂量,将子宫容积控制在2.3~3.0 mL之间,LH控制在0.8 IU/L以下,FSH控制在2.4 IU/L以下,对延缓BA的增长及改善成年身高有利。但由于本研究例数尚不多,且未能随访到成年终身高,尚需继续随访和期待多中心研究验证。
| [1] | 陈秋莉, 马华梅, 李燕虹,等. 促性腺激素释放激素类似物改善中枢性性早熟和快速进展型早发育女孩成年身高:单中心15年102例病例追踪研究[J]. 中华内分泌代谢杂志, 2013, 29(3): 236-240. |
| [2] | Kim EY. Long-term effects of gonadotropin-releasing hormone analogs in girls with central precocious puberty[J]. Korean J Pediatr, 2015, 58(1): 1-7. |
| [3] | Carel JC, Eugster EA, Rogol A, et al. Consensus statement on the use of gonadotropin-releasing hormone analogs in children[J]. Pediatrics, 2009, 123(4): e752-e762. |
| [4] | 中华医学会儿科学分会内分泌遗传代谢学组.中枢性(真性) 性早熟诊治指南[J].中华儿科杂志, 2007, 45(6): 426-427. |
| [5] | 杜敏联.根据G-P图谱测骨龄法预测成年身高表[M]//杜敏联.青春期内分泌学. 北京: 人民卫生出版社, 2006, 417-418. |
| [6] | Ziereisen F, Guissard G, Damry N, et al. Sonographic imaging of the pediatric female pelvis[J]. Eur Radiol, 2005, 15(7): 1296-1309. |
| [7] | 梁雁, 应艳琴, 罗小平. 儿童性早熟诊断和治疗中应该重视的问题[J]. 中华儿科杂志, 2011, 49(6): 401-404. |
| [8] | Allali S, Lemaire P, Couto-Silva AC, et al. Predicting the adult height of girls with central precocious puberty[J]. Med Sci Moni, 2011, 17(6): 41-48. |
| [9] | 赵兰, 钟燕. 中枢性性早熟对儿童体格及性发育的影响[J].中国当代儿科杂志, 2014, 16(5): 555-559. |
| [10] | Brito VN, Latronico AC, Cukier P, et al. Factors determining normal adult height in girls with gonadotropin-dependent precocious puberty treated with depot gonadotropin releasing hormone analogs[J]. Clin Endocrinol Metab, 2008, 93(7): 2662-2669. |
| [11] | Fuld K, Chi C, Neely EK. A randomized trial of 1- and 3-month depot leuprolide doses in the treatment of central precocious puberty[J]. J Pediatr, 2011, 159(6): 982-987. |
| [12] | 张庆, 郑名芳, 高峻, 等. 正常女童生殖器超声多参数的检测[J]. 中华医学超声杂志(电子版), 2009, 6(6): 1057-1064. |
| [13] | Kim YJ, Lee HS, Lee YJ, et al. Multicenter clinical trial of leuprolide acetate depot (Luphere depot 3.75 mg) for efficacy and safety in girls with central precocious puberty[J]. Ann Pediatr Endocrinol Metab, 2013, 18(4): 173-178. |
| [14] | Demirbilek H, Alikasifoglu A, Gonc NE, et al. Assessment of gonadotrophin suppression in girls treated with GnRH analogue for central precocious puberty; validity of single luteinizing hormone measurement after leuprolide acetate injection[J]. Clin Endocrinol (Oxf), 2012, 76(1): 126-130. |
| [15] | 蔡锡顶, 朱蓓, 李珍, 等. LHRH 激发试验对性早熟女童GnRHa治疗的评估[J]. 临床儿科杂志, 2013, 31(12): 1121-1124. |
| [16] | Neely EK, Lee PA, Bloch CA, et al. Leuprolide acetate 1-month depot for central precocious puberty: hormonal suppression and recovery[J]. Int J Pediatr Endocrinol, 2010, 2010: 398639. |
 2015, Vol. 17
2015, Vol. 17