2. 天津市儿童医院, 天津 300074
川崎病(Kawasaki disease, KD)又称为皮肤黏膜淋巴结综合征(mucocutaneous lymph node syndrome),是一种主要发生在6个月到5岁(发病高峰年龄为18~24个月)[1]的婴幼儿的急性发热出疹性疾病。KD最主要的问题是心血管损害及其并发症,其中以冠状动脉损害(coronary artery lesion, CAL)最常见。近年来随着丙种球蛋白的应用,KD患儿CAL发生率已不到5%,但在发达国家和地区,KD仍然是小儿后天性心脏病最常见的原因,并且是患儿成年后动脉粥样硬化、急性心肌梗死、心肌缺血的重要危险因素[2, 3, 4, 5]。现大量研究表明FGF23浓度的增高能导致心脏损害,但具体机制还不是很明确,有文献指出成纤维细胞生长因子23(FGF23)内含子1中c.212-37insC(rs3832879)多态性与CAL密切相关[6, 7, 8],但国内尚未见该类研究报道。本研究通过采用聚合酶链反应(PCR)、基因测序等技术,分析FGF23该位点多态性在汉族儿童中的分布情况,探讨此多态性与KD及CAL发生的相关性。
1 资料与方法 1.1 研究对象选取2010年10月至2013年8月在天津市儿童医院就诊治疗的KD患儿40例,其中男孩26例,女孩14例,年龄为2个月至6岁,平均年龄27±24个月,所纳入的KD患儿均符合国际诊断标准诊断意见[9]。病例组中根据患儿是否伴发CAL[9],分为CAL组(16例,其中男孩10例,女孩6例)与非CAL组(24例,其中男孩16例,女孩8例)。选取同时期该院门诊体检的健康儿童26例作为对照组,均排除与KD相关疾病及因素,其中男孩17例,女孩9例,年龄为8个月至6岁,平均年龄36±18个月。所有研究对象均为居住在天津及附近地区的汉族儿童,且病例组与对照组年龄、性别差异均无统计学意义。本研究获得了天津医科大学伦理委员会的批准及患儿监护人书面知情同意。
1.2 标本采集收集研究对象外周静脉血2 mL,加入含EDTA抗凝管中,置于-80℃冰箱保存用于提取DNA。
1.3 DNA的提取和PCR扩增用DNA试剂盒(Promega公司)提取外周血DNA,于-20℃下保存备用。参考文献[8]设计引物,上游引物5'-ATCAATCCAGGGAGGTTTCA-3',下游引物5'-GGAAACAGGTCACCAGGGTA-3',委托苏州金唯智生物科技有限公司合成,使用前引物终浓度为10 pmol/μL。PCR反应体系为50 μL:模板4 μL,MasterMix 22 μL,ddH2O 22 μL,上下游引物各1 μL,应用德国Eppendorf 公司生产的PCR扩增仪进行反应。扩增条件为:94℃预变性5 min;94℃变性30 s,58℃退火30 s,72℃延伸1 min,共循环36次;最后72℃延伸7 min。
1.4 PCR产物测序和分析取4 μL PCR产物,1.50%琼脂糖凝胶上电泳,在凝胶成像分析系统下进行观察拍照、分析结果。取323 bp处扩增条带阳性标本的PCR产物35 μL,委托北京金唯智生物科技有限公司及北京生工生物工程技术服务有限公司进行测序。应用Chromas软件分析所获测序结果。利用NCBI网站在线blast对所获序列进行对比分析。
1.5 统计学分析采用SPSS 20.0统计软件进行统计学分析,计数资料采用频数和百分率(%)表示,应用拟合优度χ2 检验判断KD组和对照组基因型频率是否符合Hardy-Weinberg平衡,基因多态性分布情况比较采用χ2检验,并计算优势比(OR)及其95%可信区间(95%CI)。P<0.05示差异有统计学意义。
2 结果 2.1 PCR扩增产物PCR扩增的目的片段FGF23 c.212-37insC (rs3832879)长度应为323 bp,分别以200 bp及两种类型的50 bp Marker为核酸分子量参照标准,阴性对照中未出现条带,送检标本中扩增产物目标条带在300~500 bp或300~350 bp之间,与预期结果一致,表明实验不存在污染,扩增产物为rs3832879基因序列(图 1)。
 |
图 1 FGF23 基因位点rs3832879 PCR 产物电泳图 A:以200 bp Marker为核酸分子量参照标准。B、C:以两种不同类型50 bp Marker 为核酸分子量参照标准。ddH2O:阴性对照;M: Marker;1~3:对照组;4~7:KD 组。阴性对照中未出现条带,标本1~7 扩增产物目标条带在300~500 bp 间。 |
利用NCBI查询扩增片段FGF23 c.212-37insC (rs3832879)的基因序列,并利用该网站在线blast对所获序列进行对比分析,显示与NCBI网站公布的FGF23基因SNPrs3832879位点的基因序列对比,本研究PCR产物与目的基因序列相符(98%)。所有研究对象中共有20例(30%)含有该插入碱基。由于基因突变造成测序结果不同,将突变点截图得图 2。
 |
图 2 FGF23 c.212-37insC(rs3832879) 基因型测序图 部分基因型中含有插入C 碱基:FGF23 c.212-37insC(rs3832879)。箭头所指为插入C 碱基。 |
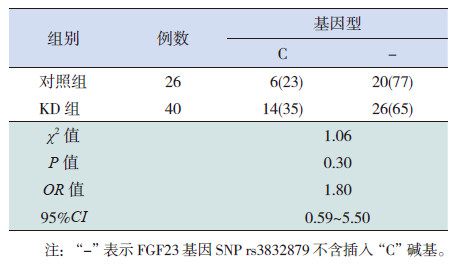
KD组与对照组基因型频率均符合Hardy-Weinberg平衡定律(P>0.05),具有群体代表性。20例具有FGF23基因SNP rs3832879位点多态性的儿童中,KD组14例(35%),对照组6例(23%),两组FGF23基因SNP rs3832879位点多态性分布频率差异无统计学意义(P=0.30),提示FGF23基因SNP rs3832879位点多态性与KD易感性无相关性(OR=1.80,95%CI: 0.59~5.50),见表 1。
| 表 1 KD 组和对照组FGF23 基因SNP rs3832879 基因型分布的比较 |
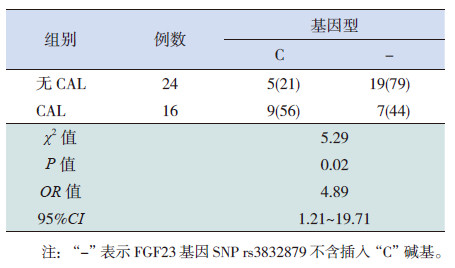
14例具有FGF23基因SNP rs3832879位点多态性的KD患儿中,9例(56%)CAL患儿和5例(21%)非CAL患儿具有该多态性位点,CAL与非CAL亚组该基因型频率分布差异有统计学意义(P=0.02),提示该位点多态性与KD患儿发生CAL具有相关性(OR=4.89,95%CI: 1.21~19.71),见表 2。
| 表 2 并发和未并发CAL 两组FGF23 基因SNP rs3832879基因型分布的比较 |
KD患儿的心脏损害主要包括心肌炎、心内膜炎及CAL,是小儿获得性心脏损害的最重要的因素。CAL的病因至今仍未完全阐明,目前较一致的观点是:CAL是在遗传因素的基础上,免疫系统异常活化、细胞浸润以及冠状动脉内皮损伤、功能紊乱等多因素相互作用的结果。
成纤维细胞生长因子(fibroblast growth factor, FGF)是20世纪在大脑及垂体的组织提取物中发现的一种能促进成纤维细胞生长的活性物质,70年代提纯后,因其作用而被命名。FGF家族在机体内参与一系列的生理功能,如胚胎发育、细胞分化、器官形成、组织修复、肿瘤生长和侵袭等[10]。FGF23是成纤维细胞生长因子家族中FGF19亚组成员,定位于染色体12p13,与FGF中的大部分成员一样,其含有两个大内含子序列,两个内含子序列将功能区分为3个外显子区域。FGF23主要来源于骨组织,由成骨细胞产生和分泌,在肝脏、心脏、甲状旁腺、骨髓等其他组织器官中都有表达,FGF23通过与FGF受体或αKlotho共受体形成复合物发挥作用,在维持肾脏磷和VitD自稳态平衡方面发挥着重要的作用。现研究发现FGF23除了与钙磷调节有关外,还与心脏的损害有关,现已被证实其能导致终末期肾脏病(end stage renal disease, ESRD)患者病死率增高,并与ESRD中高心血管事件发生率息息相关[11, 12, 13],并且,FGF23与左心室肥大、左心室功能障碍、房颤的发生、冠状动脉血管病变及心力衰竭严重程度和预后密切相关[14, 15, 16, 17]。有研究指出,FGF23为心脏损害的独立危险因素,可能成为心血管病态变化的预测因素[17],这使得FGF23基因位点多态性的研究具有了重要的意义。
本研究发现FGF23 rs3832879位点多态性与KD的易感性无相关性,而与KD并发CAL具有相关性。临床及动物研究显示FGF可能通过促成血管损伤、内皮功能紊乱等病理过程参与VitD心血管双向调控效应而发挥作用[18, 19],另有研究表示FGF23与VitD可通过影响免疫细胞而导致心脏损伤[20]。Faul等[21]首次指出由于αKlotho在心脏中没有表达,而FGF23也并未激活MAPK信号通路,可能的机制为:非依赖αKlotho的FGF23与FGFR结合后,激活心脏钙调神经磷脂酶-活化T细胞核因子(NFAT)信号传导系统,从而造成了心脏的损害。Itoh等[22]也提出FGF23通过Ca2+/ NFAT通路对心脏起作用。而在大量研究中得到证实的与KD及KD并发CAL密切相关的基因ITPKC、CASP3等正是通过激活Ca2+/ NFAT通路起作用的[23, 24, 25]。NFATs是抗原刺激T淋巴细胞后产生的一种细胞因子,如一些物质所需的转录因子。在细胞核内,NFAT通过作用于一些细胞因子基因启动子中的顺式作用元件而调控细胞因子的表达,NFAT是钙调神经磷酸酶(calcineurin, CaN)的最重要的底物,其中NFATc、NFATp、NFAT4主要存在于T淋巴细胞中,NFAT3存在于包括心脏的其他组织细胞,在免疫细胞T、B细胞中,Ca2+和CaN已经被证明是细胞内激活免疫反应的信号通路,当内外因素作用使T淋巴细胞通过其受体与抗原提呈细胞反应后,血浆中的钙离子升高,活化CaN,使NFATs去磷酸化,从而激活T淋巴细胞,而心肌中也存在同样的通路,激活损伤心肌的基因而发挥作用。由此推测,本研究中FGF23是通过激活KD患儿免疫系统,导致患儿冠状动脉内皮损伤,增加CAL发生的危险性。
综上所述,本研究显示,FGF23 rs3832879位点多态性与KD的发生无相关性,但与KD患儿CAL的发生具有相关性,其机制可能通过激活相应免疫系统发挥作用,这为KD患儿CAL的评估提供了相关依据。但鉴于本研究样本量较少,并且考虑到种族、民族、区域的差异及试验条件的限制,仍需要大样本、多种族的相关研究来证实FGF23该位点多态性与KD及其CAL发生的确切关系。
| [1] | Eleftheriou D, Levin M, Shingadia D, et al. Management of Kawasaki disease[J]. Arch Dis Child, 2014, 99(1): 74-83. |
| [2] | Matsushita K, Tamura T, Nishiga M, et al. Acute myocardial infarction and 30-year coronary aneurysm follow-up by serial angiography in a young adult with Kawasaki disease[J]. Cardiovasc Interv Ther, 2015, 30(2): 142-146. |
| [3] | Cho HJ, Yang SI, Kim KH, et al. Cardiovascular risk factors of early atherosclerosis in school-aged children after Kawasaki disease[J]. Korean J Pediatr, 2014, 57(5): 217-221. |
| [4] | Giacchi V, Sciacca P, Stella I, et al. Assessment of coronary artery intimal thickening in patients with a previous diagnosis of Kawasaki disease by using high resolution transthoracic echocardiography: our experience[J]. BMC Cardiovasc Disord, 2014, 14(1): 106-112. |
| [5] | 陈婧, 马彬, 林丽星, 等. 不同剂量丙种球蛋白治疗川崎病的疗效的Meta 分析[J]. 中国当代儿科杂志, 2011, 13(8): 638-643. |
| [6] | Isakova T, Houston J, Santacruz L, et al. Associations between fibroblast growth factor 23 and cardiac characteristics in pediatric heart failure[J]. Pediatr Nephrol, 2013. 28(10): 2035-2042. |
| [7] | Masi L, Franceschelli F, Leoncini G, et al. Can fibroblast growth factor (FGF)-23 circulating levels suggest coronary artery abnormalities in children with Kawasaki disease?[J]. Clin Exp Rheumatol, 2013, 31(1): 149-153. |
| [8] | Falcini F, Rigante D, Masi L, et al. Fibroblast growth factor 23 (FGF23) gene polymorphism in children with Kawasaki syndrome (KS) and susceptibility to cardiac abnormalities[J]. Ital J Pediatr, 2013, 39(1): 69-73. |
| [9] | Guidelines for diagnosis and management of cardiovascular sequelae in kawasaki disease (JCS 2013)[J]. Circ J, 2014, 78(10): 2521-2562. |
| [10] | Ohta H, Itoh N. Roles of FGFs as adipokines in adipose tissue development, remodeling, and metabolism[J]. Front Endocrinol (Lausanne), 2014, 5(14): 18-22. |
| [11] | Isakova T, Xie H, Yang W, et al. Fibroblast growth factor 23 and risks of mortality and end-stage renal disease in patients with chronic kidney disease[J]. JAMA, 2011, 305(23): 2432-2439. |
| [12] | Zoccali C, Yilmaz MI , Mallamaci F. FGF23: a mature renal and cardiovascular risk factor?[J]. Blood Purif, 2013, 36(1): 52-57. |
| [13] | Kendrick J, Cheung AK, Kaufman JS, et al. FGF-23 associates with death, cardiovascular events, and initiation of chronic dialysis[J]. J Am Soc Nephrol, 2011, 22(10): 1913-1922. |
| [14] | Shibata K, Fujita S, Morita H, et al. Association between circulating fibroblast growth factor 23, alpha-Klotho, and the left ventricular ejection fraction and left ventricular mass in cardiology inpatients[J]. PLoS One, 2013, 8(9): e73184. |
| [15] | Seiler S, Cremers B, Rebling NM, et al. The phosphatonin fibroblast growth factor 23 links calcium-phosphate metabolism with left-ventricular dysfunction and atrial fibrillation[J]. Eur Heart J, 2011, 32(21): 2688-2696. |
| [16] | Poelzl G, Trenkler C, Kliebhan J, et al. FGF23 is associated with disease severity and prognosis in chronic heart failure[J]. Eur J Clin Invest, 2014,44(12): 1150-1158. |
| [17] | Brandenburg VM, Kleber ME, Vervloet MG, et al. Fibroblast growth factor 23 (FGF23) and mortality: The Ludwigshafen Risk and Cardiovascular Health Study[J]. Atherosclerosis, 2014, 237(1): 53-59. |
| [18] | Touchberry CD, Green TM, Tchikrizov V, et al. FGF23 is a novel regulator of intracellular calcium and cardiac contractility in addition to cardiac hypertrophy[J]. Am J Physiol Endocrinol Metab, 2013, 304(8): E863-873. |
| [19] | Kovesdy CP , Quarles LD. Fibroblast growth factor-23: what we know, what we don't know, and what we need to know[J]. Nephrol Dial Transplant, 2013, 28(9): 2228-2236. |
| [20] | Bacchetta J, Sea JL, Chun RF, et al. Fibroblast growth factor 23 inhibits extrarenal synthesis of 1,25-dihydroxyvitamin D in human monocytes[J]. J Bone Miner Res, 2013, 28(1): 46-55. |
| [21] | Faul C, Amaral AP, Oskouei B, et al. FGF23 induces left ventricular hypertrophy[J]. J Clin Invest, 2011, 121(11): 4393-4408. |
| [22] | Itoh N, Ohta H. Pathophysiological roles of FGF signaling in the heart[J]. Front Physiol, 2013, 4(10): 247-251. |
| [23] | Wang W, Lou J, Zhong R, et al. The roles of Ca2+/NFAT signaling genes in Kawasaki disease: single- and multiple-risk genetic variants[J]. Sci Rep, 2014, 4(8): 5208-5215. |
| [24] | Onouchi Y, Suzuki Y, Suzuki H, et al. ITPKC and CASP3 polymorphisms and risks for IVIG unresponsiveness and coronary artery lesion formation in Kawasaki disease[J]. Pharmacogenomics J, 2013, 13(1): 52-59. |
| [25] | Kuo HC, Hsu YW, Wu CM, et al. A replication study for association of ITPKC and CASP3 two-locus analysis in IVIG unresponsiveness and coronary artery lesion in Kawasaki disease[J]. PLoS One, 2013, 8(7): e69685. |
 2015, Vol. 17
2015, Vol. 17